Immunoglobuline G

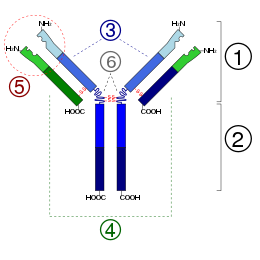
2 fragment crystallizable region
3 twee zware ketens
4 twee lichte ketens
5 plaats waar het antigeen zich bindt
6 hinge-region, scharnier
Immunoglobuline G, afgekort tot IgG, is een immunoglobuline, dus een antistof, dat wordt aangemaakt bij grotere hoeveelheden of bij een herhaald contact met het antigeen. Het is het belangrijkste van de vijf immunoglobinen in het menselijke lichaam, de andere vier zijn IgM, IgD, IgA en IgE. Het IgG-molecuul kan als een typische antistof worden beschouwd. Het zorgt binnen het immuunsysteem van de mens vooral voor de afweer tegen virussen en bacteriën en is de antistof, die het meeste in de bloedbaan voorkomt.
IgG is een monomeer en ieder IgG bestaat uit vier peptiden. Binnen de lichte keten bevinden zich twee zwavelbruggen, een in het variabele gebied en een in het constante gebied. Er zijn vier van deze bruggen in de zware γ-keten, die twee keer zo lang is als de lichte keten. Iedere disulfideverbinding vormt een peptidelus van 60 tot 70 aminozuurresiduen. Als de aminozuursequenties van deze lussen worden vergeleken, valt een grote mate van overeenkomst op. Dit houdt in dat elke immunoglobuline-peptideketen uit series van globulaire, bolvormige gebieden bestaat met een zeer gelijksoortige secundaire en tertiaire structuur, met een gelijke plooiing. IgG is onder te verdelen in vier subklassen: IgG1, IgG2, IgG3 en IgG4. De vier subklassen van humaan IgG verschillen weinig van elkaar in de aminozuursequentie. IgG kan door de placenta van de zwangere vrouw bij de foetus terechtkomen en zorgt in de eerste zes maanden voor de afweer van de baby.
De complementariteitsbepalende regio's bevinden zich aan de uiteinden van de variabele gebieden.
De twee lichte ketens wegen ieder 25 kDa en de twee zware ieder 50 kDa. Dat geeft samen 150 kDa.
- ruimtelijke structuur
- vijf soorten immunoglobuline


