Móżdżek


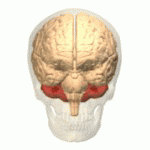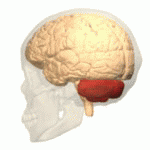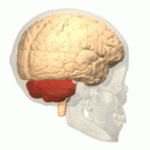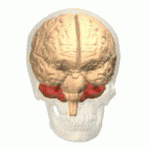
Móżdżek (łac. cerebellum – „mały mózg”) – główna część tyłomózgowia wszystkich kręgowców. Choć zazwyczaj mniejszy od kresomózgowia, u niektórych zwierząt takich jak mrukowate może osiągać te same rozmiary bądź być nawet większy[1]. U ludzi odgrywa ważną rolę w kontroli motorycznej, może też uczestniczyć w funkcjach poznawczych takich jak uwaga czy język, jak też w regulacji odczuwania strachu i przyjemności[2], jednak jego funkcje związane z ruchem zostały najlepiej ustalone. Ludzki móżdżek nie inicjuje ruchu, ale uczestniczy w jego koordynacji, zapewnia precyzję i odpowiedni czas wykonywania ruchu. Otrzymuje informacje wejściowe z narządów zmysłów przez rdzeń kręgowy i z innych części mózgu oraz integruje je, umożliwiając precyzyjnie zgraną aktywność ruchową[3]. Uszkodzenie móżdżku wywołuje u człowieka zaburzenia ruchów precyzyjnych, równowagi, postawy i uczenia się ruchów[3].
Anatomicznie móżdżek ludzki to oddzielna struktura umocowana do podstawy mózgu, schowana pod półkulami mózgowymi. Jego korę charakteryzują drobno rozmieszczone równoległe szczeliny, uderzająco kontrastujące z szerokimi, nieregularnymi zakrętami kory mózgu. Te równoległe szczeliny ukrywają fakt, że kora móżdżku stanowi w rzeczywistości ciągłą warstwę tkanki ciasno pofałdowanej w stylu przywodzącym na myśl akordeon. W obrębie tej cienkiej warstwy wyróżnia się kilka typów neuronów o wysoce regularnym rozmieszczeniu. Za najważniejsze uważa się komórki Purkiniego i komórki ziarniste. Ta złożona organizacja umożliwia masywną zdolność przetwarzania sygnałów, ale prawie cały sygnał wyjściowy z kory móżdżku biegnie przez grupę niewielkich jąder, zanurzonych w istocie białej wnętrza móżdżku[4].
Poza bezpośrednią rolą w kontroli ruchu móżdżek jest niezbędny w kilku rodzajach motorycznego uczenia się, z czego najistotniejsze jest uczenie się korygowania w reakcji na zmiany w koordynacji senso-motorycznej. Kilka modeli teoretycznych skonstruowano celem wyjaśnienia kalibracji senso-motorycznej w terminach plastyczności synaptycznej w móżdżku. Modele te pochodzą od tego sformułowanego przez Davida Marra i Jamesa Albusa, bazującego na obserwacji, że każda móżdżkowa komórka Purkiniego otrzymuje dwa drastycznie różne rodzaje informacji wejściowej: pierwszy zawiera tysiące słabych sygnałów z włókien równoległych komórek ziarnistych, drugi to bardzo silny sygnał z pojedynczego włókna pnącego[5]. Podstawowy pomysł teorii Marra-Albusa polega na tym, że włókno pnące służy jako „sygnał nauczający”, indukuje długo trwającą zmianę w sile sygnałów włókien równoległych. Obserwacje długo trwającej depresji sygnałów włókien równoległych dostarczyły wsparcia teoriom tego rodzaju, ale ich trafność pozostaje przedmiotem kontrowersji[6].
Budowa
[edytuj | edytuj kod]Na poziomie makroskopowym móżdżek składa się z ciasno pofałdowanej warstwy kory móżdżku, z istoty białej pod nią i wypełnionej płynem komory czwartej u podstawy. Cztery parzyste jądra móżdżku są zagłębione w istotę białą. Każda część kory składa się z tego samego zestawu neuronów, rozmieszczonych w sposób wysoce stereotypowy. Na poziomie pośrednim móżdżek i struktury pomocnicze można podzielić na setki lub tysiące niezależnie funkcjonujących modułów zwanych „mikrostrefami” bądź „mikroprzedziałami”.
Anatomia makroskopowa
[edytuj | edytuj kod]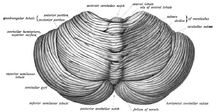
Móżdżek leży w dole tylnym czaszki. Z przodu od niego znajdują się komora czwarta, most i rdzeń przedłużony[7]. Od leżącego powyżej kresomózgowia oddziela go warstwa skórzastej opony twardej zwana namiotem móżdżku. Wszystkie połączenia móżdżku z innymi strukturami mózgowia przebiegają przez most. Anatomia zalicza móżdżek wraz z mostem do tyłomózgowia wtórnego, stanowiącego górną część tyłomózgowia. Na podobieństwo kresomózgowia móżdżek dzieli się na dwie półkule, zawiera również wąską strefę pośrodkową zwaną robakiem. Zbiór dużych fałdów służy umownie do podziału na 10 płatów. Dzięki dużej liczbie drobnych komórek ziarnistych móżdżek zawiera więcej neuronów, niż kora nowa, i to 3,6 razy. Wartość ta utrzymuje się u wielu różnych gatunków ssaków[8].
Większą część objętości móżdżku stanowi bardzo gęsto pofałdowana warstwa istoty szarej: kora móżdżku. Jej grzbiety noszą nazwę zakrętów. Szacuje się, że gdyby kora móżdżku człowieka została całkowicie rozprostowana, byłaby warstwą długą na 1 metr i szeroką na 5 cm, co daje powierzchnię 500 cm², upakowaną w objętość o wymiarach 6 cm × 5 cm × 10 cm[9]. Poniżej istoty szarej kory móżdżku leży istota biała, zbudowana z mielinowych włókien nerwowych, nazywana czasem po łacinie arbor vitae („drzewem życia”) z uwagi na rozgałęziony, przywodzący na myśl drzewo, wygląd w przekroju. Leżą w niej cztery jądra móżdżku, zbudowane z istoty szarej[10].
Połączenia móżdżku z różnymi częściami układu nerwowego to trzy parzyste konary móżdżku: konar górny móżdżku, konar środkowy móżdżku i konar dolny móżdżku. Ich nazwy odwołują się do położenia względem robaka. Konar górny stanowi głównie wyjście kierujące się do kory mózgu, obejmujące włókna eferentne przez jądra wzgórza do górnych neuronów ruchowych w korze mózgu. Wychodzą one z jąder móżdżku. Konar środkowy łączy się z mostem i otrzymuje informację wejściową wyłącznie z mostu, głównie z jąder mostu. Do mostu trafia ona z kory mózgu i jest przekazywana z jąder mostu przez poprzeczne włókna mostu do móżdżku. Konar środkowy jest największy i jego włókna aferentne grupują się w trzy niezależne pęczki dochodzące do różnych części móżdżku. Konar dolny otrzymuje informację z włókien aferentnych z jąder przedsionkowych, rdzenia kręgowego i nakrywki. Konar dolny wyprowadza informację przez włókna eferentne do jąder przedsionkowych i tworu siatkowatego. Całość móżdżku otrzymuje modulację z dolnego jądra oliwki przez dolny konar[4].
Podział
[edytuj | edytuj kod]
Opierając się o wygląd powierzchni, można wyróżnić 3 płaty móżdżku. Płat przedni móżdżku leży powyżej szczeliny pierwszej, płat tylny móżdżku poniżej tej szczeliny, natomiast płat kłaczkowo-grudkowy móżdżku poniżej szczeliny tylno-bocznej. Wymienione płaty dzielą móżdżek w kierunku dziobowo-ogonowym (u człowieka jest to z góry na dół). Jednak jeśli chodzi o funkcję, istnieje ważniejszy podział wzdłuż wymiaru przyśrodkowo-bocznego. Pozostawiając płat kłaczkowo-grudkowy, charakteryzujący się odrębnymi połączeniami i funkcjami, móżdżek można podzielić funkcjonalnie na część przyśrodkową zwaną móżdżkiem rdzeniowym oraz większą część boczną nazywaną cerebrocerebellum[10]. Wąski pasek wypuklającej się tkanki leżącej pośrodkowo zwany jest robakiem[10].
Najmniejszy region móżdżku, zwany płatem kłaczkowo-grudkowym, nosi także miano móżdżka przedsionkowego. Jest to najstarsza ewolucyjnie część móżdżku, archicerebellum, biorąca udział w utrzymaniu równowagi i orientacji przestrzennej. Łączy się głównie z jądrami przedsionkowymi, choć otrzymuje też informacje ze wzroku i innych zmysłów. Uszkodzenie tego regionu skutkuje zaburzeniami równowagi i chodu[10].
Strefa pośrodkowa płatów przedniego i tylnego tworzy móżdżek rdzeniowy, zwany spinocerebellum bądź paleocerebellum – móżdżkiem dawnym. Ta część móżdżku umożliwia głównie precyzyjne dostosowanie ruchów ciała i kończyn. Otrzymuje informacje proprioceptywne z kolumn grzbietowych rdzenia kręgowego (w tym z drogi rdzeniowo-móżdżkowej) i z nerwu trójdzielnego, jak również dane wzrokowe i słuchowe. Wysyła włókna do jąder móżdżku, które z kolei przesyłają informacje zarówno do kory mózgu, jak i do pnia mózgu, umożliwiając modulację zstępujących układów motorycznych[10].
Część boczna, u człowieka największa, obejmuje cerebrocerebellum, czyli neocerebellum, móżdżek nowy. Otrzymuje dane wyłącznie z kory mózgu (zwłaszcza z płata ciemieniowego) poprzez jądra mostu (szlak korowo-mostowo-móżdżkowy) i wysyła je głównie do brzuszno-bocznego wzgórza (związek z obszarami motorycznymi kory przedruchowej i pierwszorzędowej kory ruchowej) oraz jądra czerwiennego[10]. Panuje niezgoda odnośnie do najlepszego sposobu opisu funkcji bocznego móżdżku. Uważa się go za zaangażowany w planowanie ruchów, które mają nastąpić[11], w ewaluację informacji czuciowej do działania[10] i w liczne funkcje czysto poznawcze, jak ustalanie czasownika najlepiej pasującego do danego rzeczownika (np. „siedzieć” do „krzesło”)[12][13][14][15].
Histologia
[edytuj | edytuj kod]
Skróty: • (+): Pobudzanie
• (-): Hamowanie
• MF: Włókna kiciaste móżdżku
• DCN: Jądra móżdżku
• IO: Dolne jądro oliwki
• CF: Włókna pnące
• CFC: Kolaterale włókien pnących
• GC: Komórka ziarnista móżdżku
• PF: Włókna równoległe
• PC: Komórki Purkiniego
• GgC: Komórka Golgiego
• SC: Komórka gwiaździsta
• BC: Komórka koszyczkowa

Dwa rodzaje neuronów odgrywają dominującą rolę w obwodach móżdżku: komórki Purkiniego i komórki ziarniste. Podobnie wyróżnia się 3 typy aksonów: włókna kiciaste i włókna pnące (dochodzące do móżdżku z zewnątrz) i włókna równoległe (aksony komórek ziarnistych). Istnieją też dwa główne szlaki, rozpoczynające się od włókien kiciastych i pnących, oba kończące się w jądrach móżdżku[9].
Włókna kiciaste (mszyste[16]) sięgają bezpośrednio jąder móżdżku, ale też dają początek następującemu szlakowi: włókna kiciaste → komórki ziarniste → włókna równoległe → komórki Purkiniego → jądra móżdżku. Włókna pnące dochodzą do komórek Purkiniego, wysyłając także kolaterale bezpośrednio do jąder[9]. Włókna kiciaste i pnące przenoszą informacje specyficzne dla danego włókna. Móżdżek otrzymuje też sygnały dopaminergiczne, serotoninergiczne, noradrenergiczne i cholinergiczne, które prawdopodobnie zapewniają ogólną modulację[17].
Korę móżdżku budują 3 warstwy. Najgłębiej leży gruba warstwa ziarnista, tworzona przez gęsto upakowane komórki ziarniste wraz z interneuronami, głównie Golgiego, ale też Lugaro i jednobiegunowe komórki szczoteczkowe. Pośrodku leży warstwa zwojowa (Purkiniego), wąska strefa zawierają perykariony komórek Purkiniego i komórek glejowych Bergmanna. Na wierzchu spoczywa warstwa drobinowa, zawierająca spłaszczone drzewa dendrytyczne komórek Purkiniego wraz z szeroką paletą włókien równoległych penetrujących drzewa dendrytyczne komórek Purkiniego pod kątem prostym. Najbardziej zewnętrzna warstwa kory móżdżku także zawiera dwa typy interneuronów hamujących: komórki gwiaździste i komórki koszyczkowe. Oba tworzą synapsy GABAergiczne na dendrytach komórek Purkiniego[9].
Komórki Purkiniego
[edytuj | edytuj kod]
Komórki Purkiniego należą do najbardziej wyróżniających się neuronów mózgowia oraz do najwcześniejszych rozpoznawanych. Opisał je po raz pierwszy czeski anatom Jan Evangelista Purkyně w 1837. Wyróżniają się kształtem drzewa dendrytycznego: dendryty rozgałęziają się bardzo obficie, lecz są silnie spłaszczone w płaszczyźnie prostopadłej do zakrętów móżdżku. Wobec tego dendryty komórki Purkiniego tworzą gęstą, a płaską sieć, przez którą przechodzą pod kątem prostym włókna prostopadłe[9]. Dendryty pokrywają kolce dendrytyczne, każdy z nich tworzy połączenie synaptyczne, którym odbiera informacje z włókna równoległego. Komórka Purkiniego odbiera więcej sygnałów wejściowych na swych synapsach, niż jakakolwiek inna komórka mózgu. Liczbę kolców dendrytycznych na pojedynczej komórce Purkiniego szacuje się na nawet 200 000[9]. Duże, okrągłe ciała komórek Purkiniego upakowane są w wąskiej (jednokomórkowej grubości) warstwie kory móżdżku, zwanej warstwą Purkiniego lub zwojową. Po odejściu kolaterali do okolicznych części kory jej aksony wędrują do jąder móżdżku, by tworzyć liczbę rzędu tysiąca połączeń każdy z kilkoma typami komórek jąder, wszystkimi w niewielkiej przestrzeni. Komórki Purkiniego wykorzystują jako neuroprzekaźnik GABA, wobec czego oddziałują hamująco[9].
Komórki Purkiniego tworzą kluczowe ogniwo obwodu móżdżku. Ich znaczna wielkość i wyróżniający się wzorzec aktywności czynią je względnie łatwymi obiektami badań wzorców odpowiedzi w czasie zachowań zwierząt z wykorzystaniem pozakomórkowych technik zapisu. Komórki Purkiniego normalnie wytwarzają wysokiej częstotliwości potencjał czynnościowy nawet przy braku sygnału wejściowego. U czuwających zwierząt średnia wartość oscyluje zazwyczaj wokół 40 Hz. Mówi się o kolcach prostych i złożonych. Ten pierwszy to pojedynczy potencjał iglicowy z następczym okresem refrakcji trwającym około 10 ms; drugi to stereotypowa sekwencja potencjałów iglicowych z bardzo krótkim interwałem między iglicami i o spadającej amplitudzie[19]. Badania fizjologiczne wykazały, że kolce złożone (pojawiające się z progową częstotliwością około 1 Hz i nigdy ze znacznie wyższą od 10 Hz) są w sposób wiarygodny powiązane z aktywacją włókien pnących, podczas gdy kolec prosty powstaje dzięki połączeniu aktywności podstawowej i sygnałowi z włókna równoległego. Po kolcach złożonych następuje często przerwa trwająca kilkaset milisekund, podczas której nie obserwuje się aktywności w postaci kolców prostych[20].
Specyficzna, łatwo rozpoznawalna cecha komórek Purkiniego to ich ekspresja kalbindyny[21]. Barwienie na kalbindynę mózgu szczura po jednostronnym przewlekłym urazie nerwu kulszowego wskazuje, że komórki Purkiniego mogą na nowo powstawać w dorosłym już mózgu, rozpoczynając nową organizację płata móżdżku[22].

Komórki ziarniste
[edytuj | edytuj kod]
Komórki ziarniste móżdżku, w odróżnieniu od komórek Purkiniego, należą do najmniejszych neuronów mózgu. Stanowią także najliczniejsze neurony mózgu. U człowieka całkowitą ich liczbę szacuje się na średnio około 50 miliardów, co stanowi aż ¾ neuronów mózgu[9]. Ich perykariony upakowane są w grubą warstwę u dna kory móżdżku. Wypuszczają jedynie 4–5 dendrytów, z których każdy kończy się poszerzeniem zwanym „pazurem dendrytycznym”[9]. Otrzymywane są tam pobudzenia z włókien kiciastych i bodźce hamujące z komórek Golgiego[9].
Cienkie, niezmielinizowane aksony komórek ziarnistych wznoszą się pionowo do górnej, drobinowej warstwy kory móżdżku, gdzie rozdzielają się na dwie gałęzie – każda biegnąca poziomo jako włókno równoległe. Miejsce podziału przyjmuje kształt litery „T”. Włókna równoległe człowieka biegną przez średnio 3 mm w każdym kierunku po podziale, mają więc razem 6 mm, co stanowi dziesiątą część całkowitej szerokości tej warstwy kory móżdżku[9]. Na swojej drodze przechodzą przez drzewa dendrytyczne komórek Purkiniego, kontaktując się z jedną na 3–5, przed które przechodzą, co w sumie oznacza 80–100 połączeń synaptycznych z kolcami dendrytycznymi komórek Purkiniego[9]. Neurotransmiterem komórek ziarnistych jest glutaminian, wobec czego przenoszą one pobudzenie[9].
Wszystkie informacje wejściowe komórki ziarniste pobierają z włókien kiciastych, lecz przewyższają je liczebnie – u człowieka stosunkiem dwustukrotnym. Wobec tego informacja wyrażana stanem aktywności komórek ziarnistych jest taka sama, jak informacja przenoszona przez włókna kiciaste, ale rekodowana w bardziej wymagający sposób. Ponieważ komórki ziarniste są tak małe i gęsto upakowane, trudno jest odnotować ich aktywność u zachowującego się zwierzęcia. Przekłada się to na niewielką ilość danych, na bazie których można tworzyć teorie opisujące ich działanie. Najpopularniejszy pomysł na ich działanie zaproponował w 1969 David Marr, wedle którego kodują one kombinacje sygnałów włókien kiciastych. Chodzi o to, że każda komórka ziarnista otrzymuje sygnał wejściowy z 4–5 włókien kiciastych, komórka ziarnista nie odpowie więc, jeśli otrzyma tylko jeden z sygnałów od włókna kiciastego, odpowie natomiast, jeśli otrzyma więcej sygnałów. Ten kombinatoryczny schemat kodowania może potencjalnie pozwalać móżdżkowi na znacznie precyzyjniejsze rozróżnienia wzorców, niż umożliwiałyby to same włókna kiciaste[23].
Włókna kiciaste
[edytuj | edytuj kod]Włókna kiciaste móżdżku wchodzą do warstwy ziarnistej z miejsca ich początku – wiele zaczyna się w jądrach mostu, inne nawet w rdzeniu kręgowym, jądrach przedsionkowych itp. W móżdżku ludzkim całkowita liczba włókien kiciastych szacowana jest na 200 000 000[9]. Tworzą one synapsy pobudzające z komórkami ziarnistymi i komórkami jąder. W obrębie warstwy ziarnistej włókna kiciaste tworzą serię poszerzeń nazywanych „rozetami”. Kontakt pomiędzy włóknami kiciastymi a dendrytami komórek ziarnistych odbywa się w strukturach noszących miano kłębków (glomeruli). Każdy z tych ostatnich składa się z rozety włókna kiciastego ulokowanej w centrum i łączących się z nią do 20 pazurów dendrytycznych komórek ziarnistych. Zakończenia komórek Golgiego infiltrują tę strukturę, wytwarzając synapsy hamujące na dendrytach komórek ziarnistych. Cały zespół otacza pochewka z komórek glejowych[9]. Każde włókno kiciaste wysyła kolaterale do kilku zakrętów móżdżku, tworząc w sumie 20–30 rozet, wobec tego jedno włókno kiciaste może kontaktować się z szacunkowo 400–600 komórkami ziarnistymi[9].
Włókna pnące
[edytuj | edytuj kod]Komórki Purkiniego otrzymują także sygnały z jądra dolnego oliwki przeciwnej strony pnia mózgu przez włókna pnące. Choć jądro oliwkowe dolne leży w rdzeniu przedłużonym i otrzymuje sygnały z rdzenia kręgowego, pnia mózgu i jego kory, wysyła je wyłącznie do móżdżku. Włókna pnące dają kolaterale do jąder móżdżku, nim dotrą do kory móżdżku – każde na pojedynczej komórce Purkiniego[9]. Uderzająco kontrastuje to z ponad setką tysięcy sygnałów, jakie komórka Purkiniego otrzymuje z włókien równoległych – każda komórka Purkiniego otrzymuje sygnał z jednego tylko włókna pnącego. Jednak to pojedyncze włókno „pnie się” po dendrytach komórki Purkiniego, wije się wokół nich i wytwarza na nich do 300 synaps[9]. Sieciowy sygnał wejściowy jest tak silny, że pojedynczy potencjał czynnościowy włókna pnącego potrafi wywołać przedłużony kompleks kolców na komórce Purkiniego: wybuch kilku kolców w rzędzie, o zmniejszającej się amplitudzie, z następczą przerwą, podczas której aktywacja ulega supresji. Synapsy włókna pnącego pokrywają perykarion i proksymalne dendryty, tworząc strefę pozbawioną połączeń włókien równoległych[9].
Włókna pnące z niewielką częstotliwością wchodzą w pobudzenie, jednak pobudzenie już jednego takiego włókna powoduje wybuch kilku potencjałów czynnościowych na docelowej komórce Purkiniego (kolec złożony). Kontrast pomiędzy włóknem równoległym i pnącym łączącymi się z komórką Purkiniego (ponad 100 000 do dokładnie jednego) jest być może najbardziej prowokującą do refleksji cechą budowy móżdżku, skłaniającą do teoretyzowania. Funkcja włókien pnących stanowi najbardziej kontrowersyjną sprawę dotyczącą móżdżku. Istnieją dwie szkoły myślenia na ten temat. Zwolennicy Marra i Albusa utrzymują, że sygnały z włókna pnącego spełniają rolę sygnału nauczającego. Inni sądzą, że ich rolą jest bezpośrednie kształtowanie sygnałów wychodzących z móżdżku. Obu poglądów broniono długo w licznych publikacjach. Wedle jednego z przeglądów wśród prób syntezy różnych hipotez działania tychże włókien warto spojrzeć na pracę Eschera. Każdy punkt widzenia zdaje się autorom wyjaśniać pewien zbiór odkryć, jednak kiedy ktoś próbuje połączyć razem różne poglądy, nie powstaje spójny obraz działania włókien pnących. Dla większości badaczy włókna te przewodzą wiadomość o błędzie w aktywności ruchowej, czy to w zwyczajny sposób wpływając na modulację częstości, czy też jako pojedynczy sygnał niespodziewanego zdarzenia. Wedle innych badaczy wiadomość kryje się w stopniu synchronizacji i rytmiczności populacji włókien pnących[20].
Jądra
[edytuj | edytuj kod]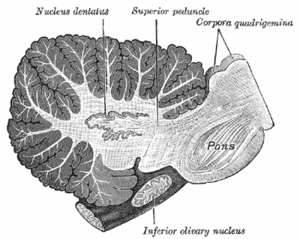
Jądra móżdżku stanowią skupienia istoty szarej zatopione w istocie białej w środku móżdżku. Są one, z niewielkim wyjątkiem pobliskich jąder przedsionkowych, jedynym miejscem sygnałów wyjściowych z móżdżku. Jądra te otrzymują kolaterale z włókien kiciastych i pnących, jak też sygnały hamujące z komórek Purkiniego. Wyróżnia się 4 jądra: jądro zębate, jądro kulkowate, jądro wierzchu i jądro czopowate. Każde komunikują się z różnymi częściami kory móżdżku i mózgu. Jądra kulkowate i czopowate określa się po angielsku niekiedy jako jądro wsunięte. Jądro wierzchu i jądro wsunięte zaliczają się do móżdżku rdzeniowego. Jądro zębate, u ssaków znacznie większe od pozostałych, to cienka, zwinięta warstwa istoty szarej. Komunikuje się ona wyłącznie z bocznymi częściami kory móżdżku. Płat kłaczkowo-guzkowy to jedyna część kory móżdżku, która nie daje wypustek do jąder móżdżku, zamiast tego kierując je do jąder przedsionkowych[9].
Większość neuronów jąder móżdżku ma duże perykariony i sferyczne drzewa dendrytyczne o promieniu około 400 μm, jako neuroprzekaźnika zaś używa glutaminianu. Ich wypustki docierają do różnorodnych celów poza móżdżkiem. Pomiędzy nimi leży niewielka liczba małych komórek gabaergicznych, łączących się głównie z jądrem dolnym oliwki, źródłem włókien pnących. Wobec tego wypustki z jądra oliwki zapewniają hamujące sprzężenie zwrotne pobudzeniom idącym przez włókna pnące. Udowodniono, że każdy mały zestaw komórek jądra kontaktuje się z tym samym zestawem komórek oliwki, który wysyła doń włókna pnące; komórki te nawzajem dokładnie sobie odpowiadają[9].
Kiedy akson komórki Purkiniego wchodzi do jednego z jąder, rozgałęzia się, docierając do dużych i małych komórek jądra. U kota kontaktuje się z około 35 komórkami. Odwrotnie pojedyncza kocia komórka jądra móżdżku otrzymuje sygnał od szacunkowo 860 komórek Purkiniego[9].
Podział na strefy
[edytuj | edytuj kod]
Z punktu widzenia anatomii makroskopowej kora móżdżku stanowi homogeniczną płytę tkanki. Z punktu widzenia mikroanatomii wszystkie części tejże płyty zdają się prezentować tę samą strukturę. Pod wieloma względami jednak struktura móżdżku wykazuje kompartmentację. Występują w niej duże przedziały zwane strefami, które można podzielić na mniejsze, zwane mikrostrefami[24].
Pierwsze oznaki kompartmentacji przyniosły badania pól odbiorczych komórek w różnych częściach móżdżku nowego[24]. Każda część ciała mapowana jest do specyficznych punktów móżdżku, jednak istnieją liczne powtórzenia podstawowej mapy, tworzące układy zwane „złamaną somatotropią” (fractured somatotopy)[25]. Jaśniej wskazuje na kompartmentację barwienie metodami immunologicznymi dla pewnych rodzajów białek. Najlepiej poznane markery noszą w języku angielskim nazwę zebrins, jako że barwienie nimi daje w efekcie złożony wzór przypominający pasy zebry. Paski tworzone dzięki tym barwnikom i innym markerom kompartmentacji przebiegają prostopadle do zakrętów móżdżku – są wąskie w kierunku przyśrodkowo-bocznym, a znacznie szersze w kierunku podłużnym. Różne markery tworzą odmienne wzory pasów, których długość i szerokość zależy od miejsca, jednak ogólny kształt pozostaje podobny[24].
Oscarsson w późnych latach siedemdziesiątych XX wieku zaproponował podział stref kory móżdżku na mniejsze jednostki zwane mikrostrefami[26]. Te ostatnie definiuje się jako grupy komórek Purkiniego o tym samym somatotropowym polu odbiorczym. Odkryto, że mikrostrefy zawierają każda liczbę komórek Purkiniego rzędu tysiąca, zorganizowanych w długi, wąski pasek, ułożony prostopadle do zakrętów kory[24]. To właśnie wiąże się ze spłaszczeniem w jednej płaszczyźnie drzewa dendrytycznego komórek Purkiniego – spłaszczeniem zgodnym z kierunkiem, w którym przebiega mikrostrefa, tworzącym kąt prosty z włóknami równoległymi[9].
Jednak nie tylko pola odbiorcze definiują strukturę mikrostref. Równie ważna jest informacja dostarczana przez włókna pnące z dolnego jądra oliwki. Odgałęzienia włókien pnących (zazwyczaj w liczbie około 10) zazwyczaj aktywują komórki Purkiniego należącej do tej samej mikrostrefy. Co więcej, neurony oliwki wysyłające włókna pnące do tej samej mikrostrefy mają tendencję do łączenia się ze sobą neksusami, co synchronizuje ich aktywność i powoduje, że komórki Purkiniego jednej strefy wykazują skorelowaną aktywność w postaci kolców potencjału w milisekundowej skali czasu[24]. Ponadto komórki Purkiniego należące do danej mikrostrefy wysyłają swe aksony do tego samego skupienia komórek w jądrze móżdżku[24]. W końcu aksony komórek koszyczkowych są znacznie dłuższe w kierunku podłużnym, niż w przyśrodkowo-bocznym, co ogranicza je w dużym stopniu do jednej mikrostrefy[24]. W efekcie interakcje międzykomórkowe w obrębie mikrostrefy są znacznie silniejsze, niż pomiędzy różnymi mikrostrefami[24].
W 2005 Richard Apps i Martin Garwicz podsumowali dowody na tworzenie przez mikrostrefy większych jednostek, które ochrzcili mianem multizonal microcomplex („mikrokompleksów wielostrefowych”). Taki mikrokompleks obejmować ma kilka oddzielonych od siebie przestrzennie mikrostref komunikujących się z tą samą grupą neuronów jąder móżdżku plus grupę związanych neuronów oliwkowych wysyłających wypustki do wszystkich mikrostref, jak również do wspomnianego obszaru jądrowego[24].
Funkcja
[edytuj | edytuj kod]Najsilniejsze argumenty za przypisaniem móżdżkowi konkretnych funkcji pochodzą z badań nad skutkami uszkodzeń móżdżku. Ludzie i inne zwierzęta z uszkodzonym móżdżkiem wykazują przede wszystkim tożstronne zaburzenia kontroli motorycznej. W dalszym ciągu generują odpowiednią siłę mięśniową, lecz ich ruchom brak precyzji, pojawiają się nieskoordynowane, niedokładne, niezgrane w czasie ruchy. Standardowy test badający uszkodzenia tej struktury polega na dotknięciu celu palcem z odległości ramienia: zdrowa osoba sięgnie swym palcem celu szybko, po linii prostej, podczas gdy osoba z uszkodzeniem móżdżku zrobi to wolniej, nierówno, wielokrotnie korygując ruch ręki w jego trakcie. Deficyty innych niż motoryczne funkcji móżdżku są trudniejsze do wykrycia. Wobec tego od dekad za główną funkcję móżdżku uważa się kalibrację ruchów precyzyjnych, a nie rozpoczynanie ruchów czy decyzję o momencie ich rozpoczęcia[10].
Przed ostatnią dekadą XX wieku funkcje móżdżka ograniczano wyłącznie do motorycznych. Jednak nowsze odkrycia postawiły cień wątpliwości. Obrazowanie funkcjonalne pokazało aktywność móżdżku związaną z językiem, uwagą i obrazami mentalnymi. Wykazano interakcje między móżdżkiem a niemotorycznymi obszarami kory mózgowej. Wiele niezwiązanych z motoryką objawów rozpoznano u ludzi z urazem, który wydawał się ograniczać do móżdżku[27][28]. W szczególności móżdżkowy zespół poznawczo-emocjonalny (zespół Schmahmanna)[29] opisany u dorosłych[30] i dzieci[31]. Szacunki bazujące na mapowaniu funkcjonalnym z użyciem fMRI sugerują, że ponad połowa móżdżku nowego powiązana jest z pewnymi strefami kory mózgu[32].
Kenji Doya argumentował, że funkcje móżdżku najlepiej zrozumieć można nie w terminach zachowań, na które wpływa, ale obliczeń neuronalnych, których dokonuje. Móżdżek składa się z wielkiej liczby mniej lub bardziej niezależnych modułów, każdy o tej samej geometrycznie regularnej budowie wewnętrznej, wobec czego domniemuje się wykonywanie przezeń tych samych obliczeń. Jeśli połączenia wejściowe i wyjściowe danego modułu wiążą go z obszarami ruchowymi (jak w wielu wypadkach jest), będą uczestniczyć w zachowaniach związanych z ruchem. Jeśli jednak połączenia wiodą do obszarów związanych nie z ruchem, a z funkcjami poznawczymi, inne będą behawioralne korelaty działania tego modułu. Tak więc móżdżek włącza się w regulację wielu różnych cech funkcjonalnych, jak: uczucia, emocje i zachowanie[33][34]. Doya zaproponował, że działanie móżdżku najlepiej wyjaśnić można jako predykcyjny wybór działania w oparciu o modele wewnętrzne środowiska bądź narzędzia służące uczeniu nadzorowanemu, w odróżnieniu do zwojów podstawy, uczących się przez wzmocnienia, i kory mózgu, prezentującej uczenie nienadzorowane[28][35].
Zasady
[edytuj | edytuj kod]Względna prostota i regularność anatomii móżdżku doprowadziły do wczesnych nadziei na możliwość podobnej prostoty funkcji obliczeniowych, wyrażanych choćby w jednej z pierwszych książek poświęconych elektrofizjologii móżdżku, The Cerebellum as a Neuronal Machine („Móżdżek jako maszyna neuronalna”) autorstwa John Carew Eccles[36], Masao Ito i János Szentágothai[37]. Choć pełne zrozumienie działania móżdżku pozostaje nieuchwytne, zidentyfikowano przynajmniej 4 ważne zasady: (1) przetwarzania na zasadzie sprzężenia w przód (feedforward processing), (2) dywergencja i konwergencja (3) modułowość i (4) plastyczność.
- Przetwarzanie na zasadzie sprzężenia w przód: Móżdżek różni się od innych części mózgowia (zwłaszcza kory mózgu), gdyż przetwarza sygnały prawie całkowicie w oparciu o sprzężenie w przód. Oznacza to, że sygnał przepływa w jednym kierunku przez system od wejścia do wyjścia, z bardzo niewielką transmisją wewnętrzną w odwrotnym kierunku. Mała ilość powracających informacji istniejąca w takim układzie składa się z wzajemnego hamowania, nie ma wzajemnych obwodów pobudzających. Taki tryb działania oznacza, że móżdżek, w przeciwieństwie do kory mózgu, nie może generować samopodtrzymujących się wzorców aktywności neuronalnej. Sygnał wchodzi do obwodu, jest przetwarzany na każdym etapie po kolei, w końcu opuszcza układ. Eccles, Ito i Szentágothai pisali że eliminacja możliwości nawracających łańcuchów pobudzenia neuronalnego stanowi niewątpliwie wielką zaletę w działaniu móżdżku na sposób komputera, jako że pozostała część układu nerwowego wymaga odeń przypuszczalnie raczej szybkich i wyraźnych odpowiedzi na dane wejściowe[38].
- Dywergencja i konwergencja: W móżdżku ludzkim informacja z 200 000 000[9] włókien kiciastych przechodzi do 40 miliardów komórek ziarnistych, których włókna równoległe przekazują ją do 15 milionów komórek Purkiniego[9]. Ponieważ ułożone są podłużnie, jakiś tysiąc komórek Purkiniego należących do danej mikrostrefy może otrzymywać sygnał wejściowy z aż 100 milionów włókien równoległych, natomiast sygnał wyjściowy skupiają w grupie poniżej 50 komórek jąder móżdżku[24]. Tak więc sieć móżdżka otrzymuje niewielką liczbę sygnałów wejściowych, przetwarza te dane bardzo rozlegle przez ściśle ustrukturyzowaną sieć wewnętrzną, po czym wysyła przez bardzo małą liczbę komórek wysyłających sygnał wyjściowy.
- Modułowość: system móżdżku dzieli się funkcjonalnie na mniej bądź bardziej niezależne moduły, których prawdopodobna liczba wynosi setki do tysięcy. Wszystkie moduły łączy podobna struktura, różnią zaś sygnały na wejściu i wyjściu. Moduł (w terminologii Appsa i Garwicza mikrokompartment wielostrefowy) składa się z niewielkiej grupki neuronów w dolnym jądrze oliwki, wiązki wąskich pasków komórek Purkiniego w korze móżdżku (mikrostrefy) i niewielkiej grupy neuronów w jednym z jąder móżdżku. Różne moduły łączy sygnał wejściowy z włókien kiciastych i równoległych, ale pod innymi względami wydają się one działać niezależnie — sygnał wyjściowy z jednego modułu wydaje się nie wpływać istotnie na aktywność innych modułów[24].
- Plastyczność: synapsy między włóknami równoległymi i komórkami Purkiniego oraz synapsy między włóknami kiciastymi i komórkami jąder są podatne na modyfikacje ich siły działania. W pojedynczym module móżdżku sygnał wejściowy z nawet miliarda włókien równoległych przechodzi do grupy poniżej 50 komórek jąder i wpływ każdego włókna równoległego na komórkę jądra jest korygowalny. Takie ułożenie daje olbrzymią elastyczność precyzyjnego dostrajania powiązań pomiędzy sygnałami wejściowymi a wyjściowymi[39].
Nauka
[edytuj | edytuj kod]Istnieją ważne dowody, że móżdżek gra kluczową rolę w niektórych rodzajach motorycznego uczenia się. Zadania, w których móżdżek najczytelniej wchodzi do gry, to te wymagające precyzyjnych korekt sposobu wykonywania. Obszernie dyskutowano, czy uczenie się odbywa się w samym móżdżku, czy też tylko zapewnia od sygnały promujące uczenie się w innych strukturach mózgowia[39]. Większość teorii przypisujących uczenie obwodom móżdżku pochodzi od pomysłów Davida Marra[23] i Jamesa Albusa[5], postulujących, że włókna pnące zapewniają sygnał uczący, indukujący modyfikacje synaps między włóknami równoległymi a komórkami Purkiniego[40]. Marr przyjął, że sygnał włókna pnącego wywołuje wzmocnienie synchronicznie aktywowanych sygnałów włókien równoległych. Większość kolejnych modeli uczenia móżdżkowego szło jednak za Albuses w przypuszczeniu, że włókna pnące mogą dostarczać sygnału błędu, powodując osłabienie synchronicznych aktywacji włókien równoległych. Niektóre z tych późniejszych modeli, jak model filtra adaptacyjnego Fujity[41], stanowiły starania zrozumienia funkcji móżdżka w terminach teorii sterowania optymalnego.
Pomysł działania włókien pnących jako sygnalizatora błędu przebadano w licznych eksperymentach – niektóre wsparły go, inne zaś podały w wątpliwość[20]. W pionierskim badaniu Gilberta i Thacha z 1977 komórki Purkiniego małp uczących się wypełniania zadania wykazywały zwiększoną aktywność w postaci kolców złożonych, która niezawodnie wskazuje na aktywność włókien pnących, podczas okresów, kiedy wykonywanie zadania szło słabo[42]. Kilka badań motorycznego uczenia się kotów pozwoliło zaobserwować aktywność złożoną w przypadku niezgodności pomiędzy planowanym ruchem i ruchem rzeczywiście wykonywanym. Badania odruchu przedsionkowo-ocznego (stabilizującego obraz na siatkówce przy ruchach głowy) pokazały, że aktywność włókien pnących wskazywała poślizg siatkówki, aczkolwiek nie w prosty sposób[20].
Jednym z najszerzej zbadanych zadań dotyczących móżdżkowego uczenia się jest paradygmat warunkowania mrugania, w którym bodziec neutralny (CS), jak ton czy światło jest w sposób powtarzalny parowany z bodźcem bezwarunkowym (US), jak dmuchnięcie, wywołującym odpowiedź w postaci mrugnięcia. Po odpowiedniej liczbie powtórzeń łącznego wystąpienia obu bodźców CS będzie w końcu wywoływał mrugnięcie przed US – wytworzy się odruch warunkowy. Eksperymenty wykazały, że zmiany zlokalizowane w pewnej części jądra wsuniętego bądź kilku konkretnych punktów w korze móżdżku uniemożliwiają uczenie się warunkowej odpowiedzi w postaci mrugnięcia. Jeśli sygnały wychodzące z móżdżku są dezaktywowane farmakologicznie przy nietkniętych sygnałach wchodzących i wewnątrzmóżdżkowych, uczenie się zachodzi nawet jeśli zwierzę nie prezentuje żadnej odpowiedzi, jeśli obwody wewnątrzmóżdżkowe są nieaktywne, nie zachodzi żadna nauka – fakty te zebrane razem silnie świadczą o tym, że uczenie się rzeczywiście zachodzi w móżdżku[43].
Teorie i modele obliczeniowe
[edytuj | edytuj kod]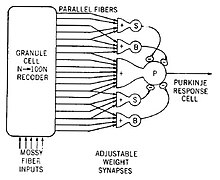
Solidna podstawa wiedzy o budowie anatomicznej i funkcjach behawioralnych móżdżku wytworzyła żyzny grunt dla teorii. Być może istnieje więcej teorii funkcjonowania móżdżku, niż jakiejkolwiek innej części mózgowia. Najbardziej podstawowa różnica dzieli je na „teorie uczenia” i „teorie działania”. Inaczej mówiąc, teorie wykorzystujące plastyczność synaptyczną móżdżku skupiają się na jego roli w uczeniu się, podczas gdy teorie opisujące pewne aspekty trwającego właśnie zachowania się bazują na przetwarzaniu sygnałów w móżdżku. Kilka teorii obu rodzajów sformułowano w postaci modeli matematycznych i symulowano na komputerach[40].
Być może najwcześniejszą „hipotezą działania” była hipoteza "delay line" („linii opóźnienia”) autorstwa Valentino Braitenberga. Oryginalny pomysł Braitenberga i Rogera Atwooda z 1958 stanowił, że powolna propagacja sygnałów wzdłuż włókien równoległych wymusza przewidywalne opóźnienia umożliwiające móżdżkowi wykrywać zależności czasowe w obrębie pewnego okna (zakresu)[44]. Dane eksperymentalne nie wsparły oryginalnego sformułowania hipotezy, jednak Braitenberg w dalszym ciągu argumentował za zmodyfikowaną wersją tego poglądu[45]. Hipoteza, zgodnie z którą móżdżek działa zasadniczo jako czasomierz, była broniona także przez Richarda Ivry'ego[46]. Wpływowa okazała się również teoria sieci tensorowej Pellionisza i Llinása, zaopatrzona w zaawansowane pod względem matematycznym sformułowanie pomysłu, że fundamentalne obliczenia wykonywane przez móżdżek polegają na transformacji współrzędnych zmysłowych w ruchowe[47].
„Teorie uczenia” pochodzą prawie wszystkie od publikacji Marra i Albusa. Praca Marra z 1969 opisywała móżdżek jako narzędzie służące nauce asocjacji ruchów elementarnych kodowanej przez włókna pnące z włóknami kiciastymi kodującymi kontekst zmysłowy[23]. Albus zaproponował w 1971, że komórki Purkiniego działają na zasadzie perceptronu, zainspirowanego neuronauką abstrakcyjnego narzędzia uczącego się[5]. Najbardziej podstawowa różnica między poglądami Marra i Albusa polega na tym, że Marr przyjął, iż aktywność włókien pnących wzmacnia synapsy włókien równoległych, podczas gdy Albus widział ich osłabienie. Albus sformułował również własną wersję algorytmu software, który nazwał CMAC (Cerebellar Model Articulation Controller), który przetestowano w licznych zastosowaniach[48].
Ukrwienie
[edytuj | edytuj kod]Mózgowie zaopatrywane jest w krew przez tętnicę kręgową i tętnicę szyjną wewnętrzną[49]. Od tętnicy kręgowej odchodzi tętnica dolna tylna móżdżku, jej najgrubsza gałąź. Tętnica dolna tylna móżdżku dzieli się na gałąź przyśrodkową podążającą wzdłuż robaka po dolnej jego części, oraz gałąź boczną idącą po dolnej powierzchni półkul móżdżku. Z kolei tętnica dolna przednia móżdżku odchodzi od tętnicy podstawnej, podobnie jak tętnica górna móżdżku[50]. Tętnica dolna przednia móżdżku rozpoczyna się w dolnej lub środkowej części tętnicy podstawnej, po czym skręca bocznie, osiągając powierzchnię kłaczka, by podzielić się na gałęzie przyśrodkową i boczną[51]. Tętnica górna móżdżku odchodzi już od dalszego fragmentu tętnicy podstawnej. Przebiega ona na granicy między konarami móżdżku górnym i środkowym. Wyróżnia się w niej część przedzespoleniową, zazespoleniową i korową[52].
Znaczenie kliniczne
[edytuj | edytuj kod]

Uszkodzenie móżdżku często wywołuje objawy związane z ruchem. Szczegóły zależą od rodzaju i lokalizacji uszkodzenia. Uszkodzenie płata kłaczkowo-grudkowego może objawiać się utratą równowagi i w szczególności zmienionym, nieregularnym chodem na szerokiej podstawie wywołanej trudnością w utrzymaniu równowagi[10]. Uszkodzenie bocznej części zazwyczaj wywołuje trudności w wykonywaniu precyzyjnych świadomych i planowanych ruchów, co może powodować nieprawidłową siłę, kierunek, prędkość i amplitudę ruchu. Inne objawy obejmują obniżone napięcie mięśniowe, dyzartrię, dysmetrię, adiadochokinezę, drżenie zamiarowe[53][54]. Uszkodzenie części pośrodkowej może zaburzać ruchy całego ciała, natomiast uszkodzenie ulokowane bardziej bocznie doprowadzi raczej do upośledzenia precyzyjnych ruchów kończyny czy samej ręki. Uszkodzenie górnej części móżdżku wiązać się może z nieprawidłowościami w chodzie i innymi problemami z koordynacją nóg. Uszkodzenie dolnej części z większą szansą wywoła nieskoordynowane bądź słabo kierowane ruchy kończyn górnych czy dłoni, jak też zaburzenia dotyczące szybkości[10]. Taki zespół objawów ruchowych nosi nazwę ataksji.
Zaburzenia związane z móżdżkiem wykrywa badanie neurologiczne. Obejmuje ono ocenę chodu (chód na szerokiej podstawie wskazuje na ataksję), testy celowania palcem i ocenę postawy[3]. W razie wykrycia objawów skazujących na dysfunkcję móżdżku, można wykonać rezonans magnetyczny, uzyskując w ten sposób dokładny obraz mogących dotyczyć móżdżku zmian strukturalnych[55].
Uszkodzenie móżdżku może być skutkiem następujących stanów: udar mózgu niedokrwienny bądź krwotoczny, obrzęk mózgu, guz mózgu, alkoholizm, uraz fizyczny, np. spowodowany postrzałem bądź eksplozją, przewlekłe stany degeneracyjne, jak zanik oliwkowo-mostowo-móżdżkowy[56][57]. Niektóre postaci migreny również mogą powodować czasową dysfunkcję móżdżku o zmiennym nasileniu[58]. Infekcja może skutkować uszkodzeniem móżdżku, np. w przypadku chorób prionowych[59].
Starzenie się
[edytuj | edytuj kod]Ludzki móżdżek zmienia się z wiekiem. Zmiany mogą różnić się od obserwowanych w innych częściach mózgowia. Móżdżek jest najmłodszą częścią mózgowia (i ciała) u stulatków, biorąc pod uwagę epigenetyczne biomarkery wieku tkanki nazywane zegarem epigenetycznym: jest około 15 lat młodszy od oczekiwanego wieku u stulatka[60]. Dalej idąc, wzory ekspresji genów w móżdżku ludzkim wykazują mniejsze zmiany związane z wiekiem niż kora mózgu[61]. Niektóre badania zaowocowały doniesieniami o redukcji liczby komórek i objętości tkanki, ale ilość danych związanych z tym zagadnieniem nie jest wielka[62][63].
Zaburzenia rozwojowe i degeneracyjne
[edytuj | edytuj kod]
Wrodzone malformacje, zaburzenia dziedziczne i stany nabyte mogą dotykać budowy móżdżku i w efekcie jego działania. Jeśli przyczyna nie jest odwracalna, jedyne możliwe postępowanie polega na pomaganiu pacjentowi żyć z dysfunkcją[64]. Wizualizacja ultrasonograficzna móżdżku płodu od 18 do 20 tygodnia ciąży może służyć do screeningu zaburzeń rozwoju cewy nerwowej z czułością dochodzącą do 99%[65].
Podczas prawidłowego rozwoju endogenny sygnał sonic hedgehog stymuluje gwałtowną proliferację komórek progenitorowych komórek ziarnistych (CGNP) zewnętrznej warstwy ziarnistej (EGL). Móżdżek rozwija się w czasie późnej embriogenezy i wczesnego okresu po narodzeniu, proliferacja CGNP w EGL ma szczyt we wczesnym okresie rozwoju, u myszy w 7 dniu po porodzie. Gdy CGNP ulegną końcowego różnicowaniu w komórki ziarniste móżdżku (CGN), migrują do wewnętrznej warstwy ziarnistej (IGL), tworząc dojrzały móżdżek (u myszy w 20 dniu po porodzie)[66]. Mutacje nieprawidłowo aktywujące sygnalizację sonic hedgehog predysponują u ludzi do nowotworów móżdżku (rdzeniak, czyli medulloblastoma) i zespołu nabłoniaków znamionowych Gorlina, podobnie w genetycznie zaprojektowanych modelach mysich[67][68].
Malformacje wrodzone i niedorozwój robaka móżdżku stanowią cechę charakterystyczną zespołów Dandy’ego-Walkera i Joubert[69][70]. Bardzo rzadko móżdżek może w ogóle się nie rozwinąć[71]. Dziedziczne zaburzenia neurologiczne jak choroba Machado-Josepha, zespół ataksja-teleangiektazja i ataksja Friedreicha wywołują progresywną neurodegenerację móżdżku[56][64]. Wrodzone malformacje mózgowia poza móżdżkiem mogą z kolei powodować wpuklenie móżdżku, jak w niektórych postaciach zespołu Arnolda-Chiariego[72].
Inne stany wiążące się ściśle z degeneracją móżdżku obejmują idiopatyczne progresywne zaburzenia neurologiczne jake jak zanik wieloukładowy[73] i zespół Ramsaya Hunta typu I[74], jak też zaburzenia autoimmunologiczne, w tym o charakterze paraneoplastycznym, gdzie guz nowotworowy rozwijający się w innym miejscu ciała indukuje odpowiedź immunologiczną powodującą utratę komórek móżdżku[75]. Atrofia móżdżku wynikać może z ostrego niedoboru tiaminy, jak w chorobie beri-beri i zespołach Wernickego i Korsakowa[76], bądź witaminy E[64].
Atrofię móżdżku obserwowano w wielu innych zaburzeniach neurologicznych, jak pląsawica Huntingtona, stwardnienie rozsiane[59], drżenie samoistne, postępująca padaczka miokloniczna, choroba Niemanna-Picka. Może też być wynikiem ekspozycji na toksyny, takie jak metale ciężkie, leki lub substancje psychoaktywne[64].
Ból
[edytuj | edytuj kod]Panuje konsensus co do zaangażowania móżdżku w odczuwaniu bólu[77][78]. Informacja pochodzi ze zstępujących szlaków korowo-móżdżkowych i wstępujących rdzeniowo-móżdżkowych poprzez jądra móżdżku i dolne oliwki. Część informacji jest przekształcana przez układ motoryczny z wytworzeniem unikania bólu w zależności od jego intensywności.
Sądzi się, że bezpośrednia informacja bólowa, jak też pośrednia, indukuje długotrwałe zachowanie polegające na unikaniu bólu, skutkujące przewlekłymi zmianami postawy i w efekcie funkcjonalną i anatomiczną przebudową jąder przedsionkowych i proprioceptywnych. W rezultacie przewlekły ból neuropatyczny może powodować makroskopową przebudowę tyłomózgowia, w tym móżdżku[79]. Rozmiar tego remodelingu i indukcja progenitorowych markerów neuronalnych sugerują związek neurogenezy w dorosłym mózgu.
Anatomia porównawcza i ewolucja
[edytuj | edytuj kod]
Obwody móżdżku prezentują się podobnie w różnych gromadach kręgowców, włączając w to ryby, gady, ptaki i ssaki[80]. U głowonogów cechujących się dobrze rozwiniętym mózgowiem, takich jak ośmiornice, występuje analogiczna struktura[81].
Obserwuje się istotną zmienność rozmiarów i kształtu móżdżku wśród kręgowców. Móżdżek płazów rozwinięty jest słabo. U minogokształtnych i śluzic trudno odróżnić go od pnia mózgu. Choć u grup tych występuje móżdżek rdzeniowy, główne jego struktury to niewielkie, parzyste jądra odpowiadające móżdżkowi przedsionkowemu[82]. U gadów móżdżek jest nieco większy, znacznie większy zaś u ptaków, a jeszcze większy u ssaków. Duże parzyste i kręte płaty znane z ludzkiej anatomii są typowe dla ssaków, jednak u innych zwierząt móżdżek zazwyczaj składa się z jednego pośrodkowego płata i cechuje się gładką bądź nieznacznie żłobkowaną powierzchnią. U ssaków główną pod względem masy część stanowi neocerebellum, podczas gdy u innych kręgowców przeważa móżdżek rdzeniowy[82].
Móżdżek ryb chrzęstnoszkieletowych i ryb kostnoszkieletowych jest niezwykle duży i złożony. W przynajmniej jednej istotnej kwestii różni się budową wewnętrzną od móżdżka ssaczego: u ryb nie obejmuje wyodrębnionych jąder. Zamiast nich zasadniczym celem wypustek komórek Purkiniego są różnego typu komórki rozlokowane wzdłuż kory móżdżku, niespotykane u ssaków. U mrukowatych, rodziny elektroczułych ryb słodkowodnych, móżdżek znacznie przewyższa wielkością resztę mózgowia. Największą jego częścią jest struktura nosząca miano valvula, cechująca się niezwykle regularną architekturą i otrzymująca dużą część danych wejściowych ze zmysłu elektrycznego[83].
Cechą charakterystyczną ssaczego móżdżku jest ekspansja płatów bocznych, komunikujących się głównie z korą nową. Kiedy z małp wąskonosych wyewoluowały człekokształtne, rozwój bocznych części móżdżku trwał nadal, w tandemie z rozwojem płatów czołowych kory mózgu. U bazalnych człowiekowatych, jak też u człowieka rozumnego aż do środkowego plejstocenu móżdżek kontynuował swoją ekspansję, jednak nie dorównywał tempem płatom czołowym. Najnowszy etap ewolucji człowieka wiązać się może ze wzrostem względnej wielkości móżdżku, gdyż ten rósł przy zmniejszeniu wielkości kory nowej[84]. Wielkość ludzkiego móżdżku w porównaniu z resztą mózgowia wzrastała, podczas gdy przeciwnie działo się z kresomózgowiem[85]. Z rozwojem i wprowadzaniem zadań ruchowych zdolności wzrokowo-przestrzenne i uczenie umiejscawiają się w móżdżku, uważa się, że wzrost tego ostatniego wiąże się w jakiś sposób z większymi zdolnościami poznawczymi człowieka[86]. Półkule boczne móżdżku są obecnie 2,7 raza większe u człekokształtnych, niż u małp zwierzokształtnych[85]. Wspomniane zmiany w wielkości móżdżku nie mogą być wytłumaczone większą masą mięśniową. Wskazują raczej, że rozwój móżdżku wiąże się ściśle z resztą mózgowia lub że aktywności neuronalne odbywające się w móżdżku były ważne w ewolucji człowiekowatych. Dzięki roli móżdżku w funkcjach poznawczych wzrost jego rozmiaru mógł odegrać rolę w ekspansji poznawczej[85].
Podobne struktury
[edytuj | edytuj kod]Większość kręgowców ma móżdżek czy jedną lub więcej podobnych struktur, obszarów mózgowia przypominających móżdżek cytoarchitekturą i neurochemią[80]. Jedyną przywodzącą na myśl móżdżek strukturą znalezioną u ssaków jest jądro ślimakowe grzbietowe (DCN), jedno z dwóch głównych jąder czuciowych odbierających dane bezpośrednio z nerwu słuchowego. DCN cechuje struktura warstwowa. Warstwa spodnia zawiera komórki ziarniste podobne do spotykanych w móżdżku, z których wychodzą włókna równoległe wznoszące się do warstwy powierzchownej i przecinające ją poziomo. Warstwa powierzchowna zawiera neurony gabaergiczne zwane po angielsku cartwheel cells. Przypominają one komórki Purkiniego anatomicznie i chemicznie: otrzymują informację z włókien równoległych, jednak nie ma tu nic przypominającego włókna pnące. DCN kierują informacje do neuronów piramidowych. Są glutaminianergiczne, ale też przypominają komórki Purkiniego pod pewnymi względami: mają kolczaste, spłaszczone drzewo dendrytyczne otrzymujące dane z włókien równoległych, mają też jednak dendryty podstawne otrzymujące dane z włókien nerwu słuchowego, podróżujące przez DCN pod kątem prostym do włókien równoległych. DCN jest najlepiej rozwinięte u gryzoni i innych małych ssaków, u naczelnych jest znacznie zredukowane. Nie zrozumiano dobrze jego funkcji. Najpopularniejszy pogląd spekuluje o powiązaniu ze słuchem przestrzennym[87].
U większości gatunków ryb i płazów występuje linia boczna, wyczuwająca fale wody. Jeden z obszarów mózgowia otrzymujący informację z linii bocznej, jądro oktawolateralne przyśrodkowe, przypomina swą budową móżdżek, zawiera komórki ziarniste i włókna równoległe. U elektrowrażliwych ryb informacja z układu elektroczułego przechodzi do jądra oktawolateralnego grzbietowego, które również przywodzi swą strukturą na myśl móżdżek. U promieniopłetwych pokrywka wzrokowa ma warstwę brzeżną o budowie przypominającej móżdżek[80].
Wszystkie te przypominające móżdżek struktury wydają się być głównie czuciowe, a nie ruchowe. W każdej z nich występują komórki ziarniste dające początek włóknom równoległym łączącym się z neuronami przypominającymi komórki Purkiniego za pomocą modyfikowalnych synaps. Żadna z nich nie ma jednak włókien pnących porównywalnych z móżdżkowymi – zamiast nich otrzymują bezpośrednio dane z peryferyjnych narządów zmysłowych. Nie wykazano funkcji żadnej z nich, ale najważniejsze spekulacje widzą je jako przekształcające dane zmysłowe w pewien skomplikowany sposób, być może kompensując zmiany postawy ciała[80]. James Bower i inni argumentowali, częściowo na podstawie ich struktur i częściowo w oparciu o badania móżdżku, że i sam móżdżek jest zasadniczo strukturą czuciową, a uczestniczy w kontroli ruchów przez manewrowanie ciałem pod kontrolą zwrotnych sygnałów zmysłowych[88]. Pomimo poglądu Bowera istnieją silne dowody na bezpośredni wpływ móżdżku na motorykę u ssaków[89][90].
Historia
[edytuj | edytuj kod]
Opisy
[edytuj | edytuj kod]Nawet najwcześniejsi anatomowie potrafili rozpoznać móżdżek dzięki jego wyróżniającemu wyglądowi. Arystoteles i Herofilos (cytowanie przez Galena) nazywali go parencephalis, w przeciwstawieniu do encephalon bądź właściwego mózgu. Rozległy opis Galena to najwcześniejszy, jaki przetrwał. Uczony spekulował, że z móżdżka wychodzą nerwy ruchowe[91].
Znaczny postęp nie nastąpił później aż do renesansu. Andreas Vesalius krótko przedyskutował móżdżek. Jego anatomię opisał bardziej dokładnie Thomas Willis w 1664. Więcej prac anatomicznych powstało w XVIII stuleciu, ale dopiero na początku XIX wieku powstał pogląd na funkcjonowanie móżdżku. Luigi Rolando w 1809 dokonał kluczowego odkrycia, obserwując skutki uszkodzenia móżdżku w postaci zaburzeń ruchowych. Jean Pierre Flourens w pierwszej połowie XIX stulecia przeprowadził szczegółowe doświadczenia, ujawniając, że zwierzęta z uszkodzonym móżdżkiem w dalszym ciągu potrafią się poruszać, jednak z upośledzoną koordynacją (dziwaczne ruchy, niezdarny chód, słabość mięśni), a powrót do zdrowia po uszkodzeniu może być prawie całkowity, jeśli zmiana nie była rozległa[92]. Na początku XX wieku szeroko zaakceptowano, że główną funkcją móżdżku jest kontrola ruchowa, w pierwszej połowie tego wieku powstały liczne szczegółowe opisy objawów klinicznych związanych z uszkodzeniami móżdżku u ludzi[3].
Etymologia
[edytuj | edytuj kod]Nazwa cerebellum stanowi zdrobnienie od cerebrum (mózgowie)[93]; dokładnie znaczy to „mały mózg”. Nazwa łacińska stanowi bezpośrednią transliterację starogreckiego παρεγκεφαλίς (parencephalis), używanego w dziełach Arystotelesa, pierwszego znanego autora opisującego tę strukturę[94]. W literaturze anglojęzycznej nie używa się innych określeń, jednak historycznie funkcjonowały różne miana wywodzące się z łaciny lub greki, jak cerebrum parvum[95], encephalion[96], encranion[95], cerebrum posterius[97] i parencephalis[95].
Przypisy
[edytuj | edytuj kod]- ↑ Evolution of Cerebellum. W: William Hodos: Encyclopedia of Neuroscience. Springer, 2009, s. 1240–1243. DOI: 10.1007/978-3-540-29678-2_3124.
- ↑ Wolf U, Rapoport MJ, Schweizer TA. Evaluating the affective component of the cerebellar cognitive affective syndrome. „J. Neuropsychiatry Clin. Neurosci.”. 21 (3), s. 245–53, 2009. DOI: 10.1176/jnp.2009.21.3.245. PMID: 19776302.
- ↑ a b c d Fine EJ, Ionita CC, Lohr L. The history of the development of the cerebellar examination. „Semin. Neurol.”. 22 (4), s. 375–84, 2002. DOI: 10.1055/s-2002-36759. PMID: 12539058.
- ↑ a b Dale Purves: Dale Purves: Neuroscience. Wyd. 5. Sunderland, Mass.: Sinauer, 2011, s. 417–423. ISBN 978-0-87893-695-3.
- ↑ a b c Albus JS. A theory of cerebellar function. „Math. Biosciences”. 10 (1–2), s. 25–61, 1971. DOI: 10.1016/0025-5564(71)90051-4.
- ↑ Dale Purves: Neuroscience.. Wyd. 4. New York: W. H. Freeman, 2007, s. 197–200. ISBN 0-87893-697-1.
- ↑ Chapter 20. W: Susan Standring, Neil R. Borley: Gray's anatomy : the anatomical basis of clinical practice. Wyd. 40. London: Churchill Livingstone, 2008, s. 297. ISBN 978-0-8089-2371-8.
- ↑ Herculano-Houzel S. Coordinated scaling of cortical and cerebellar numbers of neurons. „Front. Neuroanat.”. 4:12, 2010. DOI: 10.3389/fnana.2010.00012.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y Ch. 7 Cerebellum. W: Llinas RR, Walton KD, Lang EJ: The Synaptic Organization of the Brain. Shepherd GM (editor). New York: Oxford University Press, 2004. ISBN 0-19-515955-1.
- ↑ a b c d e f g h i j The cerebellum. W: Ghez C, Fahn S: Principles of Neural Science, 2nd edition. Kandel ER, Schwartz JH (editor). New York: Elsevier, 1985, s. 502–522.
- ↑ Kingsley RE: Concise Text of Neuroscience. Wyd. 2nd. Lippincott Williams & Wilkins, 2000. ISBN 0-683-30460-7.
- ↑ Petersen SE, Fox PT, Posner MI, Mintun M, Raichle ME. Positron emission tomographic studies of the processing of single words. „Journal of Cognitive Neuroscience”. 1, s. 153–170, 1989. DOI: 10.1162/jocn.1989.1.2.153. PMID: 23968463.
- ↑ Timmann D, Daum I. Cerebellar contributions to cognitive functions: a progress report after two decades of research. „Cerebellum”. 6 (3), s. 159–62, 2007. DOI: 10.1080/14734220701496448. PMID: 17786810.
- ↑ Strick PL, Dum RP, Fiez JA. Cerebellum and nonmotor function. „Annual Review of Neuroscience”. 32, s. 413–434, 2009. DOI: 10.1146/annurev.neuro.31.060407.125606. PMID: 19555291.
- ↑ Buckner RL. The cerebellum and cognitive function: 25 years of insight from anatomy and neuroimaging. „Neuron”. 80 (3), s. 807–815, 2013. DOI: 10.1016/j.neuron.2013.10.044. PMID: 24183029.
- ↑ Narkiewicz 2004a ↓, s. 200.
- ↑ Schweighofer N, Doya K, Kuroda S. Cerebellar aminergic neuromodulation: towards a functional understanding. „Brain Res. Brain Res. Rev.”. 44 (2–3), s. 103–116, 2004. DOI: 10.1016/j.brainresrev.2003.10.004. PMID: 15003388.
- ↑ Felizola SJ, Nakamura Y, Ono Y, Kitamura K, Kikuchi K, Onodera Y, Ise K, Takase K, Sugawara A, Hattangady N, Rainey WE, Satoh F, Sasano H. PCP4: a regulator of aldosterone synthesis in human adrenocortical tissues.. „J. Mol. Endocrinol.”. 52 (2), s. 159–167, 2014. DOI: 10.1530/JME-13-0248. PMID: 24403568. PMCID: PMC4103644.
- ↑ Eccles JC, Llinás R, Sasaki K. The excitatory synaptic action of climbing fibers on the purkinje cells of the cerebellum. „J. Physiol.”. 182 (2), s. 268–96, 1966. DOI: 10.1113/jphysiol.1966.sp007824. PMID: 5944665. PMCID: PMC1357472.
- ↑ a b c d Simpson JI, Wylie DR, De Zeeuw CI. On climbing fiber signals and their consequence(s). „Behav. Brain Sci.”. 19 (3), s. 384–398, 1996. DOI: 10.1017/S0140525X00081486.
- ↑ Whitney ER, Kemper TL, Rosene DL, Bauman ML, Blatt GJ. Calbindin-D28k is a more reliable marker of human Purkinje cells than standard Nissl stains: a stereological experiment.. „J. Neurosci. Methods”. 168 (1), s. 42–7, 2008. DOI: 10.1016/j.jneumeth.2007.09.009. PMID: 17961663.
- ↑ Rusanescu G, Mao J. Peripheral nerve injury induces adult brain neurogenesis and remodeling. „Journal of Cellular and Molecular Medicine”. 20, 2016. DOI: 10.1111/jcmm.12965. PMID: 27665307.
- ↑ a b c David Marr. A theory of cerebellar cortex. „J. Physiol.”. 202 (2), s. 437–70, 1969. DOI: 10.1113/jphysiol.1969.sp008820. PMID: 5784296. PMCID: PMC1351491.
- ↑ a b c d e f g h i j k Apps R, Garwicz M. Anatomical and physiological foundations of cerebellar information processing. „Nature Reviews Neuroscience”. 6 (4), s. 297–311, 2005. DOI: 10.1038/nrn1646. PMID: 15803161.
- ↑ Manni E, Petrosini L. A century of cerebellar somatotopy: a debated representation. „Nature Reviews Neuroscience”. 5 (3), s. 241–9, 2004. DOI: 10.1038/nrn1347. PMID: 14976523.
- ↑ Oscarsson O. Functional units of the cerebellum-sagittal zones and microzones. „Trends Neurosci.”. 2, s. 143–145, 1979. DOI: 10.1016/0166-2236(79)90057-2.
- ↑ Rapp B: The Handbook of Cognitive Neuropsychology: What Deficits Reveal about the Human Mind. Psychology Press, 2001, s. 481. ISBN 1-84169-044-9.
- ↑ a b Doya K. Complementary roles of basal ganglia and cerebellum in learning and motor control. „Curr. Opin. Neurobiol.”. 10 (6), s. 732–739, 2000. DOI: 10.1016/S0959-4388(00)00153-7. PMID: 11240282.
- ↑ Mario Manto, Peter Mariën. Schmahmann's syndrome - identification of the third cornerstone of clinical ataxiology. „Cerebellum & Ataxias”. 2, s. 2, 2015. DOI: 10.1186/s40673-015-0023-1. PMID: 26331045. PMCID: PMC4552302.
- ↑ Schmahmann JD, Sherman JC. The cerebellar cognitive affective syndrome. „Brain”. 121 (4), s. 561–79, April 1998. DOI: 10.1093/brain/121.4.561. PMID: 9577385.
- ↑ Levisohn L, Cronin-Golomb A, Schmahmann JD. Neuropsychological consequences of cerebellar tumour resection in children: cerebellar cognitive affective syndrome in a paediatric population. „Brain”. 123 (5), s. 1041–50, 2000. DOI: 10.1093/brain/123.5.1041. PMID: 10775548.
- ↑ Buckner RL, Krienen FM, Castellanos A, Diaz JC, Yeo BT. The organization of the human cerebellum estimated by intrinsic functional connectivity. „J. Neurophysiol.”. 106 (5), s. 2322–2345, 2011. DOI: 10.1152/jn.00339.2011. PMID: 21795627. PMCID: PMC3214121.
- ↑ Hernáez-Goñi P, Tirapu-Ustárroz J, Iglesias-Fernández L, Luna-Lario P. Participación del cerebelo en la regulación del afecto, la emoción y la conducta (The role of the cerebellum in the regulation of affection, emotion and behavior). „Revista de Neurologia”. 51 (10), s. 597–609, 2010. PMID: 21069639. (hiszp.).
- ↑ Turner BM, Paradiso S, Marvel CL, Pierson R, Boles Ponto LL, Hichwa RD, Robinson RG. The cerebellum and emotional experience. „Neuropsychologia”. 45 (6), s. 1331–41, 2007. DOI: 10.1016/j.neuropsychologia.2006.09.023. PMID: 17123557. PMCID: PMC1868674.
- ↑ Doya K. What are the computations of the cerebellum, the basal ganglia and the cerebral cortex?. „Neural Networks”. 12 (7–8), s. 961–974, 1999. DOI: 10.1016/S0893-6080(99)00046-5. PMID: 12662639.
- ↑ The Nobel Prize in Physiology or Medicine 1963 - Sir John Eccles. Nobel Media AB 2021, 1963.
- ↑ Eccles JC, Ito M, Szentágothai J: The Cerebellum as a Neuronal Machine. Springer-Verlag, 1967.
- ↑ The Cerebellum as a Neuronal Machine, s. 311
- ↑ a b Boyden ES, Katoh A, Raymond JL. Cerebellum-dependent learning: the role of multiple plasticity mechanisms. „Annu. Rev. Neurosci.”. 27, s. 581–609, 2004. DOI: 10.1146/annurev.neuro.27.070203.144238. PMID: 15217344.
- ↑ a b Houk JC, Buckingham JT, Barto AG. Models of the cerebellum and motor learning. „Behav. Brain Sci.”. 19 (3), s. 368–383, 1996. DOI: 10.1017/S0140525X00081474.
- ↑ Fujita M. Adaptive filter model of the cerebellum. „Biol. Cybern.”. 45 (3), s. 195–206, 1982. DOI: 10.1007/BF00336192. PMID: 7171642.
- ↑ Gilbert PF, Thach WT. Purkinje cell activity during motor learning. „Brain Res.”. 128 (2), s. 309–28, 1977. DOI: 10.1016/0006-8993(77)90997-0. PMID: 194656.
- ↑ Christian KM, Thompson RF. Neural substrates of eyeblink conditioning: acquisition and retention. „Learn. Mem.”. 10 (6), s. 427–55, 2003. DOI: 10.1101/lm.59603. PMID: 14657256.
- ↑ Braitenberg V, Atwood RP. Morphological observations on the cerebellar cortex. „J. Comp. Neurol.”. 109 (1), s. 1–33, 1958. DOI: 10.1002/cne.901090102. PMID: 13563670.
- ↑ Braitenberg V, Heck D, Sultan F. The detection and generation of sequences as a key to cerebellar function: Experiments and theory. „Behav. Brain Sciences”. 20 (2), s. 229–277, 1997. DOI: 10.1017/s0140525x9700143x. PMID: 10096998.
- ↑ Ivry RB, Spencer RM, Zelaznik HN, Diedrichsen J. The cerebellum and event timing. „Ann. N. Y. Acad. Sci.”. 978, s. 302–307, 2002. DOI: 10.1111/j.1749-6632.2002.tb07576.x. PMID: 12582062. Bibcode: 2002NYASA.978..302I.
- ↑ Pellionisz A, Llinás R. Space-time representation in the brain. The cerebellum as a predictive space-time metric tensor. „Neuroscience”. 7 (12), s. 2949–70, 1982. DOI: 10.1016/0306-4522(82)90224-X. PMID: 7162624.
- ↑ Horváth G. CMAC: Reconsidering an old neural network. „Intelligent Control Systems and Signal Processing”, 2003. [dostęp 2009-12-24].
- ↑ Narkiewicz 2004b ↓, s. 402.
- ↑ Narkiewicz 2004b ↓, s. 405.
- ↑ Narkiewicz 2004b ↓, s. 406.
- ↑ Narkiewicz 2004b ↓, s. 407.
- ↑ Schmitz TJ: Examination of Coordination. W: O'Sullivan SB, Schmitz TJ: Physical Rehabilitation. Philadelphia: F. A. Davis, 2007, s. 193–225.
- ↑ P. Mariën, M. Manto: The linguistic cerebellum. London, UK: Academic Press, 2016, s. 337–351. ISBN 978-0-12-801608-4.
- ↑ Gilman S. Imaging the brain. Second of two parts. „N. Engl. J. Med.”. 338 (13), s. 889–96, 1998. DOI: 10.1056/NEJM199803263381307. PMID: 9516225.
- ↑ a b NINDS Ataxias and Cerebellar or Spinocerebellar Degeneration Information Page. National Institutes of Health, 16 April 2014. [dostęp 2015-02-02]. [zarchiwizowane z tego adresu (9 lutego 2015)].
- ↑ D Yuhas: Veterans of Iraq, Afghanistan Show Brain Changes Related to Explosion Exposure. Scientific American, 2016. [dostęp 2016-01-21].
- ↑ Vincent M, Hadjikhani N. The cerebellum and migraine. „Headache”. 47 (6), s. 820–33, 2007. DOI: 10.1111/j.1526-4610.2006.00715.x. PMID: 17578530. PMCID: PMC3761082.
- ↑ a b NINDS Cerebellar Degeneration Information Page. National Institutes of Health, 28-02-2014. [dostęp 2015-02-02]. [zarchiwizowane z tego adresu (2016-12-02)].
- ↑ Horvath S, Mah V, Lu AT, Woo JS, Choi OW, Jasinska AJ, Riancho JA, Tung S, Coles NS, Braun J, Vinters HV, Coles LS. The cerebellum ages slowly according to the epigenetic clock.. „Age”. 7 (5), s. 294–306, 2015. DOI: 10.18632/aging.100742. PMID: 26000617. PMCID: PMC4468311.
- ↑ Fraser HB, Khaitovich P, Plotkin JB, Pääbo S i inni. Aging and gene expression in the primate brain. „PLoS Biology”. 3 (9), s. e274, 2005. DOI: 10.1371/journal.pbio.0030274. PMID: 16048372. PMCID: PMC1181540.
- ↑ Andersen BB, Gunderson HJ, Pakkenberg B. Aging of the human cerebellum: A stereological study. „J. Comp. Neurol.”. 466 (3), s. 356–365, 2003. DOI: 10.1002/cne.10884. PMID: 14556293.
- ↑ Raz N, Gunning-Dixon F, Head D, Williamson A, Acker JD. Age and sex differences in the cerebellum and the ventral pons: A prospective MR study of healthy adults. „Am. J. Neuroradiol.”. 22 (6), s. 1161–1167, 2001. PMID: 11415913.
- ↑ a b c d Richard K. Albert, Robert S. Porter: The Merck Manual of Diagnosis and Therapy. Wyd. 18. Whitehouse Station, New Jersey: Merck Research Libraries, 2006, s. 1886–1887.
- ↑ Campbell, I.; Gilbert, W. M.; Nicolaides, K. H.; Campbell, S.. Ultrasound Screening for Spina Bifida: Cranial and Cerebellar Signs in a High-Risk Population. „Obstetrics & Gynecology”. 70 (2), s. 247–250, 1987. PMID: 3299184.
- ↑ M Hatten. Mechanisms of neural patterning and specification in the developing cerebellum. „Annu Rev Neurosci”. 18, s. 385–408, 1995. DOI: 10.1146/annurev.ne.18.030195.002125. PMID: 7605067.
- ↑ W Polkinghorn. Medulloblastoma: tumorigenesis, current clinical paradigm, and efforts to improve risk stratification. „Nat Clin Pract Oncol”. 4, s. 295–304, 2007. DOI: 10.1038/ncponc0794. PMID: 17464337.
- ↑ M Roussel. Cerebellum development and medulloblastoma. „Curr Top Dev Biol”. 94, s. 235–82, 2011. DOI: 10.1016/B978-0-12-380916-2.00008-5. PMID: 21295689. PMCID: PMC3213765.
- ↑ Joubert Syndrome and related disorders. „Orphanet J Rare Dis”. 5, s. 20, 2010. DOI: 10.1186/1750-1172-5-20. PMID: 20615230. (ang.).
- ↑ NINDS Dandy-Walker Information Page. National Institutes of Health, 2014. [dostęp 2015-01-09]. [zarchiwizowane z tego adresu (2 grudnia 2016)].
- ↑ NINDS Cerebellar Hypoplasia Information Page. National Institutes of Health, 2011. [dostęp 2015-01-09]. [zarchiwizowane z tego adresu (2016-12-09)].
- ↑ Chiari Malformation Fact Sheet. National Institutes of Health, 2014. [dostęp 2015-01-09].
- ↑ Z. Ahmed, YT. Asi, A. Sailer, AJ. Lees i inni. The neuropathology, pathophysiology and genetics of multiple system atrophy. „Neuropathol Appl Neurobiol”. 38 (1), s. 4–24, 2012. DOI: 10.1111/j.1365-2990.2011.01234.x. PMID: 22074330. (ang.).
- ↑ Hunt JR. Dyssynergia cerebellaris myoclonica—Primary atrophy of the dentate system: A contribution to the pathology and symptomatology of the cerebellum. „Brain”. 44 (4), s. 490, 1921. DOI: 10.1093/brain/44.4.490. (ang.).
- ↑ NINDS Paraneoplastic Syndromes Information Page. National Institutes of Health, 2009. [dostęp 2015-01-09]. [zarchiwizowane z tego adresu (4 stycznia 2015)].
- ↑ NINDS Wernicke-Korsakoff Syndrome Information Page. National Institutes of Health, 14 February 2007. [dostęp 2015-01-09]. [zarchiwizowane z tego adresu (12 grudnia 2016)].
- ↑ Moulton, E.A.; Schmahmann, J.D.; Becerra, L.; Borsook, D.. The cerebellum and pain: passive integrator or active participator?. „Brain Research Reviews”. 65 (1), s. 14–27, 2010. DOI: 10.1016/j.brainresrev.2010.05.005. PMID: 20553761. PMCID: PMC2943015.
- ↑ Baumann, O.; Borra, R.J.; Bower, J.M.; Cullen, K.E.; Habas, C.; Ivry, R.B.; Leggio, M.; Mattingley, J.B.; Molinari, M., Moulton, E.A.; Paulin, M.G.; Pavlova, M.A.; Schmahmann, J.D.; Sokolov, A.A.. Consensus paper: the role of the cerebellum in perceptual processes. „Cerebellum”. 14 (2), s. 197–220, 2015. DOI: 10.1007/s12311-014-0627-7. PMID: 25479821. PMCID: PMC4346664.
- ↑ Rusanescu, G.; Mao, J.. Peripheral nerve injury induces adult brain neurogenesis and remodeling. „Journal of Cellular and Molecular Medicine”. 20, 2016. DOI: 10.1111/jcmm.12965. PMID: 27665307.
- ↑ a b c d Bell CC, Han V, Sawtell NB. Cerebellum-like structures and their implications for cerebellar function. „Annu. Rev. Neurosci.”. 31, s. 1–24, 2008. DOI: 10.1146/annurev.neuro.30.051606.094225. PMID: 18275284.
- ↑ Woodhams PL. The ultrastructure of a cerebellar analogue in octopus. „J. Comp. Neurol.”. 174 (2), s. 329–45, 1977. DOI: 10.1002/cne.901740209. PMID: 864041.
- ↑ a b Romer AS, Parsons TS: The Vertebrate Body. Philadelphia: Holt-Saunders International, 1977, s. 531. ISBN 0-03-910284-X.
- ↑ Shi Z, Zhang Y, Meek J, Qiao J, Han VZ. The neuronal organization of a unique cerebellar specialization: the valvula cerebelli of a mormyrid fish. „J. Comp. Neurol.”. 509 (5), s. 449–73, 2008. DOI: 10.1002/cne.21735. PMID: 18537139.
- ↑ Weaver AH. Reciprocal evolution of the cerebellum and neocortex in fossil humans. „Proc. Natl. Acad. Sci. U.S.A.”. 102 (10), s. 3576–3580, 2005. DOI: 10.1073/pnas.0500692102. PMID: 15731345. PMCID: PMC553338. Bibcode: 2005PNAS..102.3576W.
- ↑ a b c Schoenemann PT. Evolution of Brain and Language. „Language Learning”. 59, s. 162–186, 1-12-2009. DOI: 10.1111/j.1467-9922.2009.00539.x.
- ↑ MacLeod CE, Zilles K, Schleicher A, Rilling JK, Gibson KR. Expansion of the neocerebellum in Hominoidea. „J. Hum. Evol.”. 44 (4), s. 401–429, 2003. DOI: 10.1016/S0047-2484(03)00028-9. PMID: 12727461.
- ↑ Roberts PD, Portfors CV. Design principles of sensory processing in cerebellum-like structures. Early stage processing of electrosensory and auditory objects. „Biol. Cybern.”. 98 (6), s. 491–507, 2008. DOI: 10.1007/s00422-008-0217-1. PMID: 18491162.
- ↑ Bower JM. Is the cerebellum sensory for motor's sake, or motor for sensory's sake: the view from the whiskers of a rat?. „Prog. Brain Res.”. 114, s. 463–96, 1997. DOI: 10.1016/S0079-6123(08)63381-6. PMID: 9193161. ISBN 978-0-444-82313-7.
- ↑ Heiney SA, Kim J, Augustine GJ, Medina JF. Precise control of movement kinematics by optogenetic inhibition of Purkinje cell activity. „J. Neurosci.”. 34 (6), s. 2321–30, 2014. DOI: 10.1523/JNEUROSCI.4547-13.2014. PMID: 24501371. PMCID: PMC3913874.
- ↑ Witter L, Canto CB, Hoogland TM, de Gruijl JR, De Zeeuw CI. Strength and timing of motor responses mediated by rebound firing in the cerebellar nuclei after Purkinje cell activation. „Front. Neural Circuits”. 7, s. 133, 2013. DOI: 10.3389/fncir.2013.00133. PMID: 23970855. PMCID: PMC3748751.
- ↑ Ch. 11: Cerebellum. W: Clarke E, O'Malley CD: The Human Brain and Spinal Cord. Wyd. 2. Norman Publishing, 1996, s. 629. ISBN 0-930405-25-0.
- ↑ Ito M. Historical review of the significance of the cerebellum and the role of Purkinje cells in motor learning. „Ann. N. Y. Acad. Sci.”. 978, s. 273–288, 2002. DOI: 10.1111/j.1749-6632.2002.tb07574.x. PMID: 12582060.
- ↑ Lewis CT, Short C: A Latin dictionary founded on Andrews' edition of Freund's Latin dictionary. Oxford: Clarendon Press, 1879.
- ↑ Marshall LH, Magoun HW: Discoveries in the human brain. Neuroscience prehistory, brain structure, and function. Totowa: Humana Press, 1998.
- ↑ a b c Foster FD: An illustrated medical dictionary. New York: D. Appleton and Company, 1891.
- ↑ Kraus LA: Kritisch-etymologisches medicinisches Lexikon (Dritte Auflage). Göttingen: Verlag der Deuerlich- und Dieterichschen Buchhandlung, 1844.
- ↑ Schreger CHT: Synonymia anatomica. Synonymik der anatomischen Nomenclatur. Fürth: 1805.
Bibliografia
[edytuj | edytuj kod]- Olgierd Narkiewicz: Budowa wewnętrzna móżdżku. W: Adam Bochenek, Wiesław Łasiński, Józef Markowski, Olgierd Narkiewicz, Stanisław Hiller, Janina Hurynowicz, Michał Reicher, Zofia Zegarska: Anatomia człowieka. T. IV: Układ nerwowy ośrodkowy. Warszawa: Wydawnictwo Lekarskie PZWL, 2004. ISBN 978-83-200-3449-3.
- Olgierd Narkiewicz: Naczynia ośrodkowego układu nerwowego. W: Adam Bochenek, Wiesław Łasiński, Józef Markowski, Olgierd Narkiewicz, Stanisław Hiller, Janina Hurynowicz, Michał Reicher, Zofia Zegarska: Anatomia człowieka. T. IV: Układ nerwowy ośrodkowy. Warszawa: Wydawnictwo Lekarskie PZWL, 2004. ISBN 978-83-200-3449-3.
