Adenosina difosfato

| Adenosina difosfato Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | adenosine 5'-(trihydrogen diphosphate) |
| Identificadores | |
| Número CAS | |
| PubChem | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C10H15N5O10P2 |
| Massa molar | 427.201 |
| Riscos associados | |
| LD50 | 3333 mg/kg (camundongo, intraperitoneal)[1] |
| Compostos relacionados | |
| Fosfatos de adenosina relacionados | Monofosfato de adenosina Monofosfato cíclico de adenosina Trifosfato de adenosina |
| Compostos relacionados | Adenosina difosfato ribose Citidina difosfato Difosfato de desoxiadenosina Guanosina difosfato Timidina difosfato Uridina difosfato |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |

Adenosina difosfato ou difosfato de adenosina (abreviado na literatura em inglês ADP, adenosine diphosphate), também conhecido como adenosina pirofosfato ou pirofosfato de adenosina (APP, de adenosine pyrophosphate) é um importante composto orgânico importante no metabolismo celular e é essencial no fluxo de energia das células vivas. ADP é um nucleotídeo, isto é, um composto químico formado por um nucleósido e dois radicais fosfato. Neste caso, compõem o nucleótideo uma base purínica, a adenina, e um açúcar do tipo pentose, que é a ribose. Em termos de estrutura molecular, ADP consiste de três importantes componentes estruturais: uma espinha dorsal de açúcar anexado a adenina e dois grupos fosfato ligado ao átomo de carbono 5 de ribose. O grupo difosfato de ADP é ligado ao carbono 5’ da espinha dorsal de açúcar, enquanto a adenina é ligada ao carbono 1’.[2]
É a parte sem fosforilação da ATP. O ADP é produzido quando há alguma descarboxilação em alguns compostos da glicólise no ciclo de Krebs.
ADP pode ser interconvertido a trifosfato de adenosina (ATP) e monofosfato de adenosina (AMP). ATP contém mais um grupo fosfato do que ADP. AMP contém um grupo fosfato a menos. A transferência de energia usada por todos os seres vivos é resultado de defosforilação de ATP por enzimas conhecidas como ATPases. A clivagem de um grupo fosfato de ATP resulta no acoplamento de energia para reações metabólicas e um subproduto de ADP.[2] ATP é continuamente reformado a partir de espécies de baixa energia ADP e AMP. A biossíntese de ATP é alcançada através de processos tais como fosforilação ao nivel de substrato, fosforilação oxidativa e fotofosforilação, todos os quais facilitam a adição de um grupo fosfato a ADP.
Bioenergética
[editar | editar código-fonte]A ciclagem de ADP fornece a energia necessária para realizar trabalho em um sistema biológico, o processo termodinâmico de transferência de energia de uma fonte para outra. Existem dois tipos de energia: energia potencial e energia cinética. A energia potencial pode ser pensada como energia armazenada ou energia utilizável que está disponível para realizar trabalho. A energia cinética é a energia de um objeto como resultado de seu movimento. O significado do ATP está em sua capacidade de armazenar energia potencial dentro das ligações fosfato. A energia armazenada entre essas ligações pode então ser transferida para realizar trabalho. Por exemplo, a transferência de energia do ATP para a proteína miosina causa uma mudança conformacional ao conectar-se à actina durante a contração muscular.
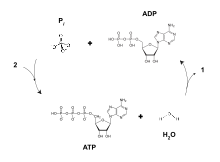
São necessárias múltiplas reações entre a miosina e a actina para produzir efetivamente uma contração muscular e, portanto, é necessária a disponibilidade de grandes quantidades de ATP para produzir cada contração muscular. Por esta razão, os processos biológicos evoluíram para produzir formas eficientes de repor a energia potencial do ATP a partir do ADP.[3]
A quebra de uma das ligações de fósforo do ATP gera aproximadamente 30,5 kilojoules por mole de ATP (7,3 kcal).[4] ADP pode ser convertido, ou alimentado de volta a ATP através do processo de liberação da energia química disponível nos alimentos; em humanos, isso é constantemente realizado por meio de respiração aeróbica na mitocôndria.[3] As plantas usam caminhos fotossintéticos para converter e armazenar energia da luz solar, também conversão de ADP a ATP.[4] Os animais usam a energia liberada na quebra de glicose e outras moléculas para converter ADP a ATP, que pode então ser usado para alimentar o crescimento necessário e a manutenção das células.[3]
Respiração celular
[editar | editar código-fonte]Catabolismo
[editar | editar código-fonte]A via catabólica de dez etapas da glicólise é a fase inicial da liberação de energia livre na quebra da glicose e pode ser dividida em duas fases, a fase preparatória e a fase de compensação. ADP e fosfato são necessários como precursores para sintetizar ATP nas reações de compensação do ciclo TCA (ciclo de Krebs) e mecanismo de fosforilação oxidativa.[5] Durante a fase de compensação da glicólise, as enzimas fosfoglicerato quinase e piruvato quinase facilitam a adição de um grupo fosfato ao ADP por meio de fosforilação a nível de substrato.[6]
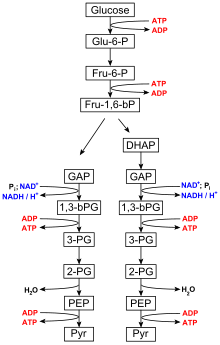
Glicólise
[editar | editar código-fonte]Glicólise é realizado por todos os organismos vivos e consiste em 10 etapas. A reação líquida para o processo global de glicólise é:[7]
- Glicose + 2 NAD+ + 2 Pi + 2 ADP → 2 piruvato + 2 ATP + 2 NADH + 2 H2O
As etapas 1 e 3 requerem a entrada de energia derivada da hidrólise de ATP a ADP e Pi (fosfato inorgânico), enquanto as etapas 7 e 10 requerem a entrada de ADP, cada uma produzindo ATP.[8] As enzimas necessárias para quebrar a glicose são encontrados no citoplasma, o fluido viscoso que preenche as células vivas, onde ocorrem as reações glicolíticas.
Ciclo do ácido cítrico
[editar | editar código-fonte]O ciclo do ácido cítrico, também conhecido como ciclo de Krebs ou ciclo dos ácidos tricarboxílicos (abreviado na literatura em inglês como ciclo TCA, de tricarboxylic acid) é um processo de 8 etapas que leva o piruvato gerado pela glicólise e gera 4 NADH, FADH2 e GTP, que é posteriormente convertido em ATP.[9] É somente na etapa 5, onde o GTP é gerado, por succinil-CoA sintetase, e então convertido a ATP, que ADP é usado (GTP + ADP → GDP + ATP).[10]
Fosforilação oxidativa
[editar | editar código-fonte]Fosforilação oxidativa produz 26 dos 30 equivalentes de ATP gerados na respiração celular pela transferência de elétrons de NADH ou FADH2 a O2 através de transportadores de elétrons.[11] A energia liberada quando os elétrons são passados de NADH ou FADH2 de energia mais alta para o O2 de energia mais baixa é requerida para fosforilar ADP e mais uma vez gerar ATP.[12] É esse acoplamento de energia e fosforilação do ADP ao ATP que dá à cadeia de transporte de elétrons o nome de fosforilação oxidativa.
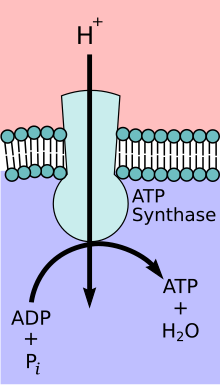
Complexo mitocondrial ATP sintase
[editar | editar código-fonte]Durante as fases iniciais da glicólise e do ciclo TCA, cofatores como NAD+ doam e aceitam elétrons[13] que auxiliam na capacidade da cadeia de transporte de elétrons de produzir um gradiente de prótons através da membrana mitocondrial interna.[14] O complexo ATP sintase existe dentro da membrana mitocondrial (porção FO) e se projeta-se na matriz (porção F1). A energia derivada como resultado do gradiente químico é então usada para sintetizar ATP por acoplar a reação de fosfato inorgânico para ADP no sítio ativo da enzima ATP sintase; a equação para isso pode ser escrito como ADP + Pi → ATP.
Ativação de plaquetas sanguíneas
[editar | editar código-fonte]Em condições normais, pequenas plaquetas em forma de disco circulam livremente no sangue e sem interação umas com as outras. O ADP é armazenado em corpos densos dentro das plaquetass sanguíneas e é liberado após a ativação plaquetária. O ADP interage com uma família de receptores de ADP encontrados nas plaquetas (P2Y1, P2Y12 e P2X1), que leva à ativação plaquetária.[15]
- Receptores P2Y1 iniciar a agregação plaquetária e a mudança de forma como resultado de interações com o ADP.
- Receptores P2Y12 amplificar ainda mais a resposta ao ADP e levar à conclusão da agregação.
ADP no sangue é convertido em adenosina pela ação de ecto-ADPases, inibindo a ativação plaquetária adicional via receptores de adenosina.
Referências
- ↑ Pharmaceutical Chemistry Journal Vol. 20, Pg. 160, 1986.
- ↑ a b Cox, Michael; Nelson, David R.; Lehninger, Albert L (2008). Lehninger principles of biochemistry
 . San Francisco: W.H. Freeman. ISBN 978-0-7167-7108-1
. San Francisco: W.H. Freeman. ISBN 978-0-7167-7108-1 - ↑ a b c Nave, C.R. (2005). «Adenosine Triphosphate». Hyper Physics [serial on the Internet]. Georgia State University
- ↑ a b Farabee, M.J. (2002). «The Nature of ATP». ATP and Biological Energy [serial on the Internet]. Arquivado do original em 1 de dezembro de 2007
- ↑ Jensen TE, Richter EA (Março 2012). «Regulation of glucose and glycogen metabolism during and after exercise». J. Physiol. 590 (Pt 5): 1069–76. PMC 3381815
 . PMID 22199166. doi:10.1113/jphysiol.2011.224972
. PMID 22199166. doi:10.1113/jphysiol.2011.224972 - ↑ Liapounova NA, Hampl V, Gordon PM, Sensen CW, Gedamu L, Dacks JB (Dezembro 2006). «Reconstructing the mosaic glycolytic pathway of the anaerobic eukaryote Monocercomonoides». Eukaryotic Cell. 5 (12): 2138–46. PMC 1694820
 . PMID 17071828. doi:10.1128/EC.00258-06
. PMID 17071828. doi:10.1128/EC.00258-06 - ↑ Medh, J.D (3 Abril 2013). «Glycolysis» (PDF). CSUN.Edu
- ↑ Bailey, Regina. «10 Steps of Glycolysis»
- ↑ «Citric Acid Cycle» (PDF). Takusagawa’s Note. Consultado em 4 Abril 2013. Arquivado do original (PDF) em 24 Março 2012
- ↑ «Biochemistry» (PDF). UCCS.edu. Arquivado do original (PDF) em 28 de fevereiro de 2013
- ↑ Freeman, W H (2002). «Oxidative phosphorylation». Consultado em 4 de abril 2013
- ↑ Medh, J. D. «Electron Transport Chain (Overview)» (PDF). CSUN.edu. Consultado em 4 de abril 2013
- ↑ Belenky P, Bogan KL, Brenner C (Janeiro 2007). «NAD+ metabolism in health and disease». Trends Biochem. Sci. 32 (1): 12–9. PMID 17161604. doi:10.1016/j.tibs.2006.11.006
- ↑ Murray (2003). Harper's illustrated biochemistry. New York: McGraw-Hill. ISBN 0-07-121766-5
- ↑ Murugappa, S; Kunapuli, SP (2006). «The role of ADP receptors in platelet function». Front. Biosci. 11: 1977–86. PMID 16368572. doi:10.2741/1939