Cloreto de fosforila

| Cloreto de fosforila Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Nome IUPAC | Phosphoryl chloride Phosphorus trichloride oxide |
| Outros nomes | Oxicloreto de fósforo Tricloreto fosfórico |
| Identificadores | |
| Número CAS | |
| Número EINECS | |
| Número RTECS | TH4897000 |
| Propriedades | |
| Fórmula molecular | POCl3 |
| Massa molar | 153.33 g/mol |
| Aparência | Líquido claro incolor, produz fumos em ar úmido |
| Densidade | 1.645 g/cm3, líquido |
| Ponto de fusão | 1.25 °C (274.4 K) |
| Ponto de ebulição | 105.8 °C (379.0 K) |
| Solubilidade em água | Reage |
| Estrutura | |
| Forma molecular | tetraédrico |
| Momento dipolar | 2.54 D |
| Riscos associados | |
| MSDS | ICSC 0190 |
| Classificação UE | Muito tóxico (T+) Nocivo (Xn) Corrosivo (C) |
| Índice UE | 015-009-00-5 |
| NFPA 704 | |
| Frases R | R14, R22, R26, R35, R48/23 |
| Frases S | S1/2, S7/8, S26, S36/37/39, S45 |
| Compostos relacionados | |
| Compostos relacionados | Cloreto de tiofosforila Oxibrometo de fósforo Tricloreto de fósforo Pentacloreto de fósforo |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Cloreto de fosforila (comumente chamado oxicloreto de fósforo), ou ainda tricloreto de fosforilo, é o composto inorgânico de fórmula química POCl3.
Apresenta-se como um líquido incolor que hidrolisa ao ar úmido resultando em ácido fosfórico liberando fumarolas asfixiantes de cloreto de hidrogênio. É produzido industrialmente em larga escala a partir do tricloreto de fósforo e oxigênio ou pentóxido de fósforo. É principalmente usado para produzir ésteres fosfato tais como o fosfato de tricresilo.
Foi descoberto em 1847 por Würtz.
Estrutura
[editar | editar código-fonte]Como o fosfato, o cloreto de fosforila apresenta-se molecular na forma tetraédrica. Apresenta três ligações P-Cl e uma ligação dupla forte P=O, com uma energia de dissociação de ligação estimada de 533,5 kJ/mol. Com base no comprimento da ligação e eletronegatividade, a regra de Schomaker-Stevenson sugere que a ligação dupla formada é muito dominante (e contraste com POF3). A ligação P=O não utiliza os orbitais d sobre o fósforo como é geralmente descrito em livros texto mais antigos na medida que cálculos quânticos químicos demonstraram que os orbitais d não estão envolvidos na ligação principal do grupo químico (ver Molécula hipervalente). Textos mais modernos favorecem uma descrição de orbitais moleculares que envolve a doação do par de elétrons solitários do oxigênio do orbital p para as ligações anti-ligação fósforo-cloro constituindo, assim, ligação π[1] em termos de ligação de valência isso envolve um sistema quatro centros de seis elétrons P-Cl deslocalizados ocupando dois orbitais, além de uma ligação dupla P=O.
- onde pm = picometros
Propriedades químicas
[editar | editar código-fonte]POCl3 reage com água e álcoois resultando em cloreto de hidrogênio e ácido fosfórico ou ésteres fosfatos, respectivamente:
- O=PCl3 + 3 H2O → O=P(OH)3 + 3 HCl
Se a água é substituída por um álcool, o resultado é um éster fosfato trialquil. Tais reações são frequentemente realizadas na presença de um aceptor de HCl tal como a piridina ou uma amina. Se POCl3 é aquecido com um excesso de fenóis (ArOH) na presença de um catalisador ácido de Lewis tal como o cloreto de magnésio, um fosfato de triarila tal como o fosfato de trifenila é formado. Por exemplo:
- 3 C6H5OH + O=PCl3 → O=P(OC6H5)3 + 3 HCl
POCl3pode também atuar como uma base de Lewis, formando adutos com uma variedade de ácidos de Lewis tais como o tetracloreto de titânio:
- Cl3P+-O− + TiCl4 → Cl3P+-O−-TiCl4
O aduto com o cloreto de alumínio (POCl3·AlCl3) é bastante estável, e então o POCl3 pode ser usado para remover AlCl3 completamente de misturas reacionais ao fim de uma reação de Friedel-Crafts. POCl3 reage com o brometo de hidrogênio na presença de AlCl3 produzindo POBr3.
Preparação
[editar | editar código-fonte]O cloreto de fosforila pode ser preparado pela reação de tricloreto de fósforo com oxigênio a 0–50 °C (o ar é inefetivo):
- 2 PCl3 + O2 → 2 O=PCl3
Uma síntese alternativa implica a reação do pentacloreto de fósforo (PCl5) e pentóxido de fósforo P4O10. Uma vez que estes compostos são ambos sólidos, um modo conveniente de realizar a reação consiste em clorar a mistura de PCl3 e P4O10, os quais geram o PCl5 in situ. Como o PCl3 é consumido, o POCl3 torna-se o solvente da reação.
- 6 PCl3 + 6 Cl2 → 6 PCl5
- 6 PCl5 + P4O10 → 10 POCl3
Pentacloreto de fósforo também forma POCl3 por reação com a água, mas esta reação é menos facilmente controlada do que a reação acima.
Como resultado da decomposição de pentacloreto de fósforo pelo contato com água, foi chamado quando em mistura com o cloreto de hidrogênio formado, que em água forma o chamado ácido clorídrico, de "ácido clorofosfórico"[2]:
- PCl5 + H2O → POCl3 + 2 HCl
Usos
[editar | editar código-fonte]O mais importante uso para o cloreto de fosforila é na fabricação de ésteres triarilfosfato (como descrito acima), tais como o fosfato de trifenila e o fosfato de tricresilo. Estes ésteres têm sido usados por muitos anos como retardadores de chama e plastificantes de PVC. Enquanto isso os ésteres de trialquilo, tais como fosfato de tributila (feito de forma semelhante a partir do butan-1-ol) são utilizados como solventes de extração líquido-líquido em reprocessamento nuclear, e em outras aplicações.
Na indústria de semicondutores, POCl3 é usado como um fonte segura líquida de fósforo em processos de difusão. O fósforo atua como um dopante usado para criar camadas do tipo N sobre um wafer de silício.
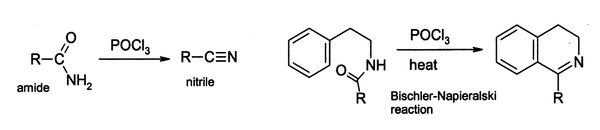
No laboratório, POCl3 é largamente usado como um agente desidratante, por exemplo na conversão de amidas primárias a nitrilas. Similarmente, certas aril-amidas podem ser ciclizadas a derivados de dihidroisoquinolina usando-se a reação de Bischler-Napieralski.
Acredita-se que tais reações ocorre, via um cloreto de imidoíla; em certos casos onde este é estável, o cloreto de imidoila é o produto final. Por exemplo piridonas e pirimidonas pode ser convertidas a derivados clorados de piridinas e pirimidinas, os quais são importantes na indústria farmacêutica.[3]
Referências
- ↑ D. B. Chesnut (1999). «The Electron Localization Function (ELF) Description of the PO Bond in Phosphine Oxide». Journal of the American Chemical Society. 121 (10): 2335-2336. doi:10.1021/ja984314m
- ↑ Alexander William Williamson; Chemistry, for students; Clarendon Press, 1868. (Google e-Livro). Pág. 174-175
- ↑ R. C. Elderfield, Heterocyclic Compounds, Vol. 6, p 265
Este artigo incorpora texto (em inglês) da Encyclopædia Britannica (11.ª edição), publicação em domínio público.