Hepatite C

| Hepatite C | |
|---|---|
| Vírus da hepatite C visto ao microscópio eletrónico, purificado a partir de uma cultura celular. (escala = 50 nanómetros) | |
| Especialidade | Gastroenterologia, infecciologia |
| Sintomas | Geralmente nenhum[1] |
| Complicações | Insuficiência hepática, cancro do fígado, varizes esofágicas e gástricas[2] |
| Duração | Crónica (80%)[1] |
| Causas | Vírus da hepatite C transmitido por contacto sanguíneo[1][3] |
| Método de diagnóstico | Análises ao sangue para anticorpos ou ARN do vírus[1] |
| Prevenção | Agulhas esterelizadas, rastreio de sangue doado[4] |
| Tratamento | Medicação, transplante de fígado[5] |
| Medicação | Sofosbuvir, simeprevir[1][4] |
| Frequência | 143 milhões / 2% (2015)[6] |
| Mortes | 496 000 (2015)[7] |
| Classificação e recursos externos | |
| CID-10 | B17.1, B18.2 |
| CID-9 | 070.70,070.4, 070.5 |
| CID-11 | 1517862018 |
| OMIM | 609532 |
| DiseasesDB | 5783 |
| MedlinePlus | 000284 |
| eMedicine | med/993 ped/979 |
| MeSH | D006526 |
A hepatite C é uma doença infecciosa causada pelo vírus da hepatite C (VHC) que afeta sobretudo o fígado.[2] No momento da infeção inicial, é frequente que as pessoas não manifestem sintomas ou que manifestem apenas sintomas muito ligeiros. Ocasionalmente pode verificar-se febre, urina mais escura, dor abdominal ou icterícia. Após a infeção inicial, o vírus permanece no fígado de 75% – 85% das pessoas inicialmente infetadas, tornando-se uma infeção crónica. No início da fase crónica geralmente não se manifestam sintomas. No entanto, ao longo dos anos a infeção pode levar ao aparecimento de doenças hepáticas e ocasionalmente cirrose.[1] Em alguns casos, os indivíduos com cirrose manifestam complicações como Insuficiência hepática ou cancro do fígado, podendo ainda ocorrer complicações que apresentam risco imediato de vida, como varizes esofágicas ou gástricas.[2]
O contágio com VHC é feito através de contacto sanguíneo, associado sobretudo com a partilha de seringas, uso de material médico mal esterilizado e transfusões de sangue.[1][3] No entanto, com rastreio de sangue o risco de contágio por transfusão é inferior a um por cada dois milhões.[1] A infeção pode também ser transmitida de mãe para filho durante o nascimento.[1] Não se transmite por contacto superficial.[4] o VHC é um dos cinco tipos conhecidos de vírus da hepatite: A, B, D e E.[8] O diagnóstico é realizado com análises ao sangue que detetam a presença de anticorpos para o vírus ou ARN do vírus. O rastreio é recomendado para grupos de risco.[1]
Não existe vacina contra a hepatite C.[1][9] As medidas de prevenção incluem não partilhar seringas e o rastreio do sangue doado.[4] A infeção pode ser tratada com os medicamentos sofosbuvir ou simeprevir, cuja taxa de cura é de 90%.[1][4] Antes destes tratamentos estarem disponíveis era usada uma combinação de peginterferão e ribavirina, que tinha uma taxa de cura de apenas 50% e maiores efeitos adversos. No entanto, o acesso aos novos medicamentos tem custos elevados.[4] Os indivíduos que desenvolvem cirrose ou cancro do fígado podem necessitar de um transplante de fígado. A hepatite C é a principal causa de transplantes de fígado, embora o vírus normalmente se volte a manifestar mesmo depois do transplante.[5]
Estima-se que haja em todo o mundo 130 a 200 milhões de pessoas infetadas com hepatite C.[4][10][11] Em 2013 houve cerca de 11 milhões de novos casos.[12] A doença é mais comum em África e na Ásia oriental.[4] No mesmo ano, a doença foi a causa de 343 000 mortes por cancro do fígado e 358 000 mortes por cirrose.[13] A existência da hepatite C foi proposta durante a década de 1970 e demonstrada em 1989.[14] A doença afecta apenas o ser humano e os chimpanzés.[15]
Sinais e sintomas
[editar | editar código-fonte]Infecção aguda
[editar | editar código-fonte]A infecção da hepatite C manifesta-se através de sintomas agudos em 15% dos casos.[16] Os sintomas são geralmente pouco intensos e imprecisos, entre os quais a falta de apetite, fadiga, náuseas, dores musculares ou nas articulações e perda de peso.[17] A maior parte dos casos de infecção aguda não tem relação com a icterícia.[18] A infecção desaparece por si própria e de forma espontânea em 10 a 50% dos casos, o que ocorre com mais frequência em indivíduos jovens do sexo feminino.[18]
Infecção crónica
[editar | editar código-fonte]Cerca de 80% daqueles que são expostos ao vírus contraem uma infecção crónica.[19] Durante as primeiras décadas, a maior parte dos infectados não nota qualquer sintoma significativo,[20] embora a hepatite C crónica esteja associada à fadiga.[21] Após vários anos, a doença torna-se a principal causa de cirrose e de cancro do fígado.[5] Cerca de 10 a 30% dos indivíduos infectados desenvolve cirrose num prazo de 30 anos.[5][17] A cirrose é mais frequente entre os que estão igualmente infectados com a hepatite B ou o VIH, entre alcoólicos e em indivíduos do sexo masculino.[17] Os que desenvolvem cirrose apresentam um risco vinte vezes maior de contrair um hepatocarcinoma, ao ritmo de 1 a 3% ao ano,[5][17] e no caso de estar associado ao excesso de álcool o risco aumenta para 100 vezes.[22] A hepatite C está na origem de 27% dos casos de cirrose e de 25% dos casos de hepatocarcinoma em todo o mundo.[23]
A cirrose hepática pode levar à hipertensão portal, acumulação de líquidos no abdómen, susceptibilidade a hemorragias, varizes (sobretudo no estômago e esófago), icterícia, e um síndroma de alteração psíquica conhecido como encefalopatia hepática. É uma das causas mais comuns na requisição de transplantes hepáticos.[24]
Complicações extra-hepáticas
[editar | editar código-fonte]Ainda que muito raramente, a hepatite C está associada ao Síndrome de Sjögren (um transtorno auto-imune), à trombocitopenia, ao lichen planus, à diabetes mellitus e a transtornos linfoproliferativos das células B.[25] Estima-se que a trombocitopenia se manifeste entre 0,16% a 45,4% dos indivíduos com hepatite C crónica.[26] Têm também sido apontadas associações prováveis com o prurigo nodularis[27] e com a glomerulonefrite membranoproliferativa.[21] A infecção por hepatite C está ainda associada a uma condição conhecida como crioglobulinemia, uma inflamação dos vasos sanguíneos pequenos e médios causada pela deposição de complexos imunes envolvendo crioglobulinas.[28]
Infecção oculta
[editar | editar código-fonte]Embora algumas pessoas infetadas com hepatite C possam aparentar ter eliminado o vírus, podem no entanto permanecer infetadas.[29] O vírus não é detectável nos exames convencionais, embora possa ser confirmado através de exames ultra-sensíveis.[30] O primeiro método de detecção consistia em demonstrar a presença do genoma viral em biópsias do fígado. Os métodos mais recentes incluem um teste de anticorpos às principais proteínas do vírus e a detecção do genoma viral na sequência da concentração das partículas virais com ultracentrifugação.[31] Também se tem verificado a existência de uma forma de infeção com enzimas hepáticas no soro moderadamente elevadas de forma persistente, mas sem anticorpos da hepatite C.[32]
A este tipo de infeção têm sido associados diversos cenários clínicos.[33] Pode ser observada em pessoas com anticorpos anti-hepatite C, mas com níveis normais de enzimas hepáticas no soro; em pessoas sem anticorpos com níveis enzimáticos elevados de causa desconhecida; em populações saudáveis sem evidências de doença hepática: e em grupos de risco de infeção por VHC, incluindo pessoas em hemodiálise ou familiares de pessoas com VHC oculto. A relevância clínica desta forma de infeção ainda está a ser investigada.[34] As consequências da infeção oculta aparentam ser menos graves do que as da infeção crónica, mas podem variar desde mínimas a carcinoma hepatocelular.[31]
A taxa de infeção oculta entre os indivíduos aparentemente curados é controversa, mas aparenta ser baixa.[35] 40% das pessoas com hepatite, mas com serologia negativa e ausência de genoma viral detectável no soro, apresentam o vírus da hepatite C durante a biópsia.[36] No entanto, desconhece-se ainda a prevalência em crianças.[37]
Virologia
[editar | editar código-fonte]O vírus da hepatite C (VHC) é um Vírus ARN de senso positivo, de reduzida dimensão, de estirpe única e encapsulado.[5] É um membro do género hepacivírus da família Flaviviridae.[21] Existem sete principais genótipos de VHC, ordenados de um a sete.[38] Nos Estados Unidos, cerca de 70% dos casos têm origem no genótipo 1, 20% no genótipo 2, sendo atribuído a cada genótipo restante cerca de 1% dos casos.[17] O genótipo 1 é igualmente o mais comum na América do Sul e na Europa.[5]
Transmissão
[editar | editar código-fonte]
A principal forma de transmissão em países desenvolvidos é através da partilha de seringas, enquanto que nos países em desenvolvimento o contágio tem origem sobretudo em transfusões sanguíneas e práticas clínicas pouco seguras.[3] A causa do contágio é desconhecida em cerca de 20% dos casos,[39] embora se acredite que possam ser contabilizados na partilha de seringas.[18]
Partilha de seringas
[editar | editar código-fonte]A partilha de seringas é um dos maiores comportamentos de risco para a transmissão da hepatite C em grande parte do mundo.[40] Entre 77 países que dispõem de dados, 25 deles revelaram ter taxas de prevalência de hepatite C entre a população de toxicodependente de 60% a 80%,[19][40] e doze deles superior a 80%.[19] Acredita-se que dez milhões de toxicodependentes estejam infectados com a doença. A China (1,6 milhões), Estados Unidos (1,5 milhões) e a Rússia (1,3 milhões) são os países com o maior número absoluto de infecções.[19] A incidência de hepatite C entre reclusos nos Estados Unidos, por exemplo, é dez a vinte vezes maior do que a verificada na generalidade da população. Tem sido apontada como causa a existência de múltiplos comportamentos de alto risco dentro das prisões como a troca de seringas durante o consumo de drogas e a tatuagem com equipamento não esterilizado.[41][42]
Contágio em meio hospitalar
[editar | editar código-fonte]As transfusões sanguíneas, as transfusões de produtos sanguíneos, ou o transplante de órgãos sem o devido rastreio do vírus da hepatite C representam um avultado risco de infecção.[17] O rastreio universal de VHC tornou-se obrigatório no Canadá em 1990[43] e nos Estados Unidos em 1992.[44] Esta medida reduziu o risco de contágio de uma em cada 200 unidades de sangue[44] para entre uma em cada 10 000 a 10 000 000 unidades de sangue.[18][39] Embora muito residual, o risco de contágio continua a existir, já que entre o momento em que um potencial dador de sangue é infectado e a possível detecção da doença através de análises tem que decorrer um período de 10 a 70 dias, dependendo do método usado.[39] Devido ao elevado custo financeiro dos testes, alguns países ainda não rastreiam a presença de hepatite C.[23]
Indivíduos que tenham sido alvo de uma lesão provocada por uma agulha contaminada com VHC têm uma probabilidade de 1,8% de vir a contrair a doença.[17] O risco é maior se a agulha em questão é oca ou o golpe é profundo.[23] Embora baixo, existe também algum risco na exposição de mucosas ao sangue infectado, não havendo no entanto qualquer risco se a exposição ao sangue infectado ocorrer na pele intacta.[23]
O equipamento hospitalar tem igualmente sido referido como um dos meios de transmissão da hepatite C, através da reutilização de seringas, da reutilização de recipientes para administração de medicamentos, de sacos de infusão, e de equipamento cirúrgico mal esterilizado, entre outros factores de risco.[23] A ausência ou insuficiente implantação de medidas estritas de prevenção em instalações clínicas ou dentárias, públicas ou privadas, é apontada como a principal causa da disseminação do VHC no Egipto, o país com a maior taxa de infecção em todo o mundo.[45]
Relações sexuais
[editar | editar código-fonte]A probabilidade da transmissão da hepatite C através de contacto sexual é uma questão controversa.[46] Embora haja uma associação entre comportamentos sexuais de risco e a hepatite C, desconhece-se se a transmissão da doença se deve à própria actividade sexual enquanto factor de risco ou ao consumo não admitido de drogas.[17] A maioria das conclusões sustenta que não haja risco para casais heterossexuais monogâmicos.[46] No entanto, são factores de risco as práticas sexuais que envolvam um maior risco de trauma da mucosa anogenital, como o sexo penetrativo anal, ou práticas que sejam realizadas quando haja uma doença sexualmente transmissível concorrente, como o VIH ou úlceras genitais.[46] Nos Estados Unidos, o uso de preservativo enquanto método de protecção contra a hepatite C, é apenas recomendado no contexto de múltiplos parceiros sexuais.[47]
Piercings e tatuagens
[editar | editar código-fonte]Uma tatuagem representa um risco duas a três vezes maior de contrair hepatite C.[48] Isto pode dever-se tanto à má esterilização do equipamento como à própria contaminação da tinta usada.[48] As tatuagens ou piercings realizados antes de meados da década de 80, de forma clandestina ou de forma não profissional são um motivo de preocupação adicional, uma vez que é provável que não tenham sido usados quaisquer mecanismos de esterilização. O risco também aparenta ser maior consoante a dimensão da própria tatuagem.[48] Estima-se que cerca de metade dos reclusos partilhem equipamento de tatuagem não esterilizado.[48] Mas é raro para os tatuadores em estúdios licenciados estarem ligados diretamente com as infecções virais.[49]
Partilha de objectos de uso pessoal
[editar | editar código-fonte]Determinados objectos de uso pessoal, como lâminas de barbear, escovas de dentes ou material de manicura e pedicura, podem estar contaminados com sangue. A partilha destes objectos pode eventualmente levar à exposição ao VHC.[50][51] Deve haver cuidados redobrados na presença de qualquer estado clínico que envolva hemorragias, como feridas e cortes.[51] O VHC não se transmite através do simples contacto físico, como um abraço, beijo ou partilha de utensílios de cozinha ou de refeição.[51]
Transmissão vertical
[editar | editar código-fonte]A transmissão vertical da hepatite C de uma mãe infectada para o filho ocorre apenas em menos de 10% das gravidezes.[52] Não há medidas que possam diminuir o risco.[52] Não é ainda claro o momento em que durante a gravidez se dá o contágio, mas pensa-se que possa ocorrer entre a gestação e o parto.[39] Os trabalhos de parto longos estão associados a um maior risco de transmissão.[23] Não há ainda provas de que a amamentação transmita o VHC embora, como medida preventiva, a mãe portadora da doença seja aconselhada a evitar amamentar caso os mamilos se apresentem gretados, haja hemorragias locais,[53] ou se se verifique que os níveis virais estão altos.[39]
Diagnóstico
[editar | editar código-fonte]
Estão disponíveis vários testes de diagnóstico de hepatite C, entre eles a detecção do anticorpo do VHC através do ELISA, o Western blot, e a análise quantitativa da reacção em cadeia da polimerase (RCP) do ARN do VHC.[17] O ARN do vírus consegue ser detectado pela RCP normalmente entre uma a duas semanas depois da infecção, enquanto que métodos com base na detecção de anticorpos só possam ser feitos passado muito mais tempo, uma vez que os anticorpos demoram comparativamente muito mais tempo a ser formados.[24]
Define-se como hepatite C crónica qualquer infecção em que o VHC persista por mais de seis meses, tendo como base a presença ou não do seu ARN.[20] As infecções crónicas são geralmenet assintomáticas durante as primeiras décadas,[20] e descobertas frequentemente através da investigação de altos níveis de enzimas hepáticas ou durante exames de rotina em grupos de alto risco. Os exames não conseguem distinguir entre infecções agudas ou crónicas.[23]
Serologia
[editar | editar código-fonte]A detecção de Hepatite C tem normalmente início com um exame sanguíneo que detecte a presença de anticorpos do VHC, recorrendo-se a um imunoensaio enzimático.[17] Caso o resultado seja positivo, é realizado um novo teste que confirme o imunoensaio e que determine a carga viral. A verificação do imunoensaio anterior é feita com recurso a um ensaio de imunoblot recombinante, e determina-se a carga viral através da reacção em cadeia da polimerase do ARN do VHC.[17] Caso não se detecte o ARN do vírus mas o imunoblot seja positivo, significa que a pessoa já teve anteriormente uma infecção que entretanto desapareceu, quer de forma espontânea quer com recurso a tratamento. Caso o imunoblot seja igualmente negativo, significa que o primeiro imunoensaio estava errado e se tratou de um falso positivo.[17] É preciso entre seis e oito semanas a partir da data de infecção para que o imunoensaio possa apresentar resultados positivos.[21]
Os níveis de enzimas durante a fase inicial da infecção variam bastante[20] e, em média, só começam a subir sete semanas depois da infecção.[21] O nível de enzimas hepáticas pouca relação tem com a intensidade da doença.[21]
Biópsia
[editar | editar código-fonte]Para determinar o grau de deterioração e a evolutividade do processo inflamatório do fígado recorre-se à biópsia hepática; existem, no entanto, riscos associados a este exame.[5] As alterações normalmente observadas são linfócitos dentro do parênquima, gânglios linfáticos no hilo hepático e alterações nos canais biliares.[5] Estão disponíveis uma série de exames sanguíneos para tentar determinar o grau de fibrose hepática e diminuir a necessidade da realização de uma biópsia.[5]
Rastreio
[editar | editar código-fonte]Acredita-se que apenas 5% a 50% dos indivíduos infectados nos Estados Unidos e Canadá estão conscientes de que são portadores da doença.[48] O rastreio é recomendado em grupos de alto risco, que incluem também pessoas tatuadas.[48] O rastreio é igualmente recomendado em indivíduos com níveis elevados de enzimas, já que este é normalmente o único indício de hepatite crónica.[54]
Prevenção
[editar | editar código-fonte]À data de 2011, não existe ainda qualquer vacina que ofereça protecção contra a contracção da hepatite C. No entanto, existem algumas em fase de desenvolvimento que mostram resultados promissores.[55] A aplicação de múltiplas medidas de contenção, como os programas de troca de seringas e o tratamento da toxicodependência, reduzem o risco da transmissão do vírus entre toxicodependentes em cerca de 75%.[56] O rastreio de dadores de sangue é importante quando feito à escala nacional, assim como o é a adesão das unidades de saúde aos princípios básicos de precaução, como a esterilização.[21] Em países onde não haja quantidade suficiente de seringas esterilizadas, a administração de medicamentos deve ser feita oralmente em vez de por via intravenosa.[23]
Tratamento
[editar | editar código-fonte]O VHC induz infecção crónica em 50% a 80% dos indivíduos infectados. Entre estes, a taxa de sucesso do tratamento é de 40% a 80%.[57][58] Em casos raros, a infecção pode desaparecer sem qualquer tratamento.[18] Os portadores de hepatite C crónica são aconselhados a evitar bebidas alcoólicas e medicamentos que apresentem toxicidade para o fígado,[17] para além de ser recomendada a vacinação contra a hepatite A e hepatite B.[17] Para aqueles que têm cirrose, recomenda-se também a vigilância do hepatocarcinoma através de ecografia.[17]
Medicação
[editar | editar código-fonte]
Regra geral, recomenda-se tratamento para todas as pessoas com prova de infeção por VHC e sinais de inflamação do fígado.[17] Actualmente, o tratamento consiste na administração combinada de interferão alfa peguilado com o fármaco antiviral ribavirina durante um período de 24 ou 48 semanas, dependendo do genótipo do VHC.[17] Este procedimento apresenta taxas de sucesso entre 70 a 80% para o genótipos 2 e 3, respetivamente, e 45 a 70% para os restantes genótipos.[60] Quando administrado em conjunto com a ribavirina, o interferão alfa peguilado 2a aparenta ser superior ao interferão alfa-2b peguilado, embora as provas não sejam ainda determinantes.[61]
A combinação de boceprevir ou telaprevir com a ribavirina e e o interferão alfa peguilado melhora a resposta antiviral ao genótipo 1 da hepatite c.[62][63][64] Os efeitos secundários deste tratamento são bastante comuns, com cerca de metade dos pacientes a manifestarem sintomas semelhantes aos da gripe e cerca de um terço a manifestar problemas de ordem emocional.[17] O tratamento durante os primeiros seis meses é mais eficaz do que aquele que seja feito depois da infecção se ter tornado crónica.[24] Se o indivíduo contrair uma nova infecção e esta não tiver sido eliminada ao fim de oito a doze semanas, é recomendada a administração de interferão peguilado durante 24 semanas.[24] Em pacientes com talassemia, a ribavirina aparenta ser eficaz, mas aumenta a necessidade de transfusões.[65]
A combinação de sofosbuvir com ribavirina e interferão aparenta ter uma eficácia de aproximadamente 90% em pessoas com o genótipo 1, 4, 5 ou 6.[66] O sofosbuvir apenas com rivavirina aparenta ser eficaz entre 70 a 95% dos casos com os genótipos 2 e 3; no entanto, verifica-se maior prevalência de efeitos adversos.[60][66] Os tratamentos com ledipasvir e sofobusvir apresentam taxas de sucesso entre 93 e 99% para o genótipo 1, embora o seu custo seja bastante elevado.[59] Nos casos de infeção com genótipo do tipo 6, o interferão pegilado e a ribavirina são eficazes entre 60 a 90% dos casos.[67] Existem também alguns dados preliminares para o uso de simeprevir em casos com o genótipo 6.[67]
Cirurgia
[editar | editar código-fonte]A cirrose causada por hepatite C é uma das causas comuns de transplante de fígado[24] embora em 80 a 90% dos casos se verifique recorrência do vírus após a cirurgia.[5][68] A infeção do enxerto leva a que 10 a 30% das pessoas desenvolvam cirrose no prazo de cinco anos.[69] O tratamento com interferão peguilado e ribavirina após o transplante reduz o risco desta ocorrência em 70%.[70]
Medicina alternativa
[editar | editar código-fonte]Existem várias terapias alternativas cujos proponentes advogam ser benéficas no tratamento da hepatite C, como o cardo-leiteiro, ginseng ou a prata.[71] No entanto, nenhuma terapia alternativa mostrou ainda ser capaz de melhorar os resultados da doença, e não existe qualquer evidência de que as terapias alternativas tenham qualquer acção sobre o vírus.[71][72][73]
Prognóstico
[editar | editar código-fonte]A resposta ao tratamento varia consoante o genótipo do vírus. A resposta é positiva em 40% a 50% dos indivíduos infectados com o genótipo 1 depois de 48 semanas de tratamento.[5] Em indivíduos infectados com o genótipo 2, a resposta é positiva em 70% a 80% dos casos após 24 semanas de tratamento.[5] Para o genótipo 4 a resposta positiva é de 65% após 48 semanas de tratamento. As evidências para o tratamento do genótipo 6 são escassas, e as que existem são apenas para 48 semanas de tratamento com a mesma dosagem usada nos casos de genótipo 1.[74]
Epidemiologia
[editar | editar código-fonte]
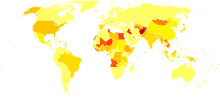
sem dados <10 10-15 15-20 20-25 25-30 30-35 | 35-40 40-45 45-50 50-75 75–100 >100 |
Estima-se que vivam entre 130 e 170 milhões de pessoas com hepatite C crónica, o que corresponde a 3% da população mundial.[75] Anualmente, são registados 3 a 4 milhões de novos casos, e mais de 350 000 pessoas morrem a cada ano devido a doenças relacionadas com a hepatite C.[75] O número de infecções cresceu significativamente ao longo do século XX como consequência do contágio relativo ao consumo de drogas injectáveis, medicação intravenosa ou equipamento médico mal esterilizado.[23]
Entre os portadores crónicos da doença, o risco de contrair cirrose durante um prazo de vinte anos varia consoante os estudos efectuados, mas estima-se que seja entre 10% e 15% para os homens e entre 1% e 5% para as mulheres. Desconhece-se a explicação para esta diferença. Uma vez contraída cirrose, o taxa de risco de contrair hepatocarcinoma é de 1% a 4% ao ano.[76]
Nos Estados Unidos, cerca de 2% da população é portadora do vírus da hepatite C,[17] e anualmente são registados de 35 000 a 185 000 novos casos. A taxa de novas infecções tem vindo a diminuir de forma significativa no Ocidente desde a década de 1990 como consequência do rastreio de sangue em transfusões.[24] As mortes anuais devidas ao VHC nos Estados Unidos variam entre 8 000 a 10 000, esperando-se que este número aumente à medida que são registados as manifestações da doença em indivíduos infectados antes dos rastreios sanguíneos serem norma.[77]
A prevalência é maior em alguns países de África e da Ásia.[78] Entre os países com uma taxa significativamente elevada de infecções conta-se o Egipto (22%), o Paquistão (4,8%) e a China (3,2%).[75] Acredita-se que o caso Egípiio esteja ligado a uma campanha nacional para o tratamento da esquistossomose, actualmente descontinuada, em que foram usadas seringas de vidro esterilizadas de forma imprópria.[23]
História
[editar | editar código-fonte]Em meados da década de 1970, Harvey J. Alter, coordenador da Secção de Doenças Infecciosas no Departamento de Medicina de Transfusão nos Institutos Nacionais da Saúde, e a sua equipa de investigação demonstraram que a maior parte dos casos de hepatite registados após transfusões de sangue não se deviam aos vírus quer da hepatite A quer da B. Apesar desta descoberta e do esforço internacional para a identificação do vírus, inicialmente descrito como "vírus da hepatite não A e não B", tal só seria conseguido mais de uma década depois. Em 1987, Michael Houghton, Qui-Lim Choo, e George Kuo da Chiron Corporation, em colaboração com D.W. Bradley do Centro de Controle e Prevenção de Doenças, recorreram a uma nova abordagem baseada na clonagem molecular de modo a identificar o organismo ainda desconhecido e criar um teste de diagnóstico.[79] Em 1988, a existência do vírus foi confirmada por Alter ao verificar a sua presença numa cultura de vírus não A e não B. Em Abril de 1989, a descoberta do VHC foi publicada ao longo de dois artigos na revista Science.[80][81] A descoberta veio permitir melhorias substanciais no diagnóstico e no tratamento antiviral.[79] Em 2000, Alter e Houghton foram laureados com o Prémio Lasker para a Investigação Clínica em Medicina, pelo seu trabalho de pioneirismo na descoberta do vírus da hepatite C e pelo desenvolvimento de métodos de diagnóstico, que reduziram o risco de hepatite associada à transfusão de sangue nos Estados Unidos de 30% em 1970 para virtualmente zero em 2000.[82]
A Chiron deu entrada de vários pedidos de patente sobre o vírus e respectivos métodos de diagnóstico.[83] Em 1990, a CDC desistiu de registar uma patente concorrente, depois da Chiron ter oferecido uma indemnização no valor de 1,9 milhões de dólares à empresa e 337 500 dólares a Bradley. Em 1994, o próprio Bradley processou a Chiron, procurando invalidar a patente, incluir-se a si como coautor e obter o direito a royalties. Viria, no entanto, a desistir do caso em 1998 depois de ter perdido num tribunal de recurso.[84]
Impacto social
[editar | editar código-fonte]Em 28 de Julho de cada ano celebra-se o Dia Mundial de Combate à Hepatite.[85] O impacto económico da hepatite C é bastante significativo, quer a nível individual, quer a nível social. Nos Estados Unidos, o custo médio da doença ao longo da vida foi estimado em 33 407 dólares em 2003,[86] e o custo de um transplante hepático em 200 000 dólares em 2011.[87] No Canadá, o custo de um tratamento antiviral ascendia em 2003 a 20 000 CAD,[88] e nos Estados Unidos entre 9 200 e 17 600 dólares em 1998.[86] Em muitas regiões do mundo, torna-se impossível comportar o tratamento com antivirais, quer por falta de seguro de saúde, quer pelo tratamento antiviral não estar coberto pela apólice.[89]
Investigação
[editar | editar código-fonte]À data de 2011, havia cerca de cem fármacos para a hepatite C em fase de desenvolvimento.[87] Entre eles encontram-se vacinas, imunomoduladores e inibidores de ciclofilina.[90] Estas inovações e potenciais tratamentos são resultado da melhor compreensão do vírus da hepatite C.[91]
Ver também
[editar | editar código-fonte]Referências
- ↑ a b c d e f g h i j k l «Hepatitis C FAQs for Health Professionals». Centers for Disease Control. 8 de janeiro de 2016. Consultado em 4 de fevereiro de 2016
- ↑ a b c Ryan KJ, Ray CG (editors), ed. (2004). Sherris Medical Microbiology 4ª ed. [S.l.]: McGraw Hill. pp. 551–2. ISBN 0838585299
- ↑ a b c Maheshwari, A; Thuluvath, PJ (fevereiro de 2010). «Management of acute hepatitis C». Clinics in liver disease. 14 (1): 169–76; x. PMID 20123448. doi:10.1016/j.cld.2009.11.007
- ↑ a b c d e f g h «Hepatitis C Fact sheet N°164». WHO. Julho de 2015. Consultado em 4 de fevereiro de 2016
- ↑ a b c d e f g h i j k l m Rosen, HR (23 de junho de 2011). «Clinical practice. Chronic hepatitis C infection» (PDF). The New England Journal of Medicine. 364 (25): 2429–38. PMID 21696309. doi:10.1056/NEJMcp1006613
- ↑ GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 de outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1545–1602. PMC 5055577
 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6 - ↑ GBD 2015 Mortality and Causes of Death, Collaborators. (8 de outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1459–1544. PMID 27733281. doi:10.1016/S0140-6736(16)31012-1
- ↑ «Viral Hepatitis: A through E and Beyond». National Institute of Diabetes and Digestive and Kidney Diseases. Abril de 2012. Consultado em 4 de fevereiro de 2016
- ↑ Webster, Daniel P; Klenerman, Paul; Dusheiko, Geoffrey M (2015). «Hepatitis C». The Lancet. 385 (9973): 1124–1135. ISSN 0140-6736. PMC 4878852
 . PMID 25687730. doi:10.1016/S0140-6736(14)62401-6
. PMID 25687730. doi:10.1016/S0140-6736(14)62401-6 - ↑ Gravitz L. (2011). «A smouldering public-health crisis». Nature. 474 (7350): S2–4. PMID 21666731. doi:10.1038/474S2a
- ↑ Mohd Hanafiah, K; Groeger, J; Flaxman, AD; Wiersma, ST (Abril de 2013). «Global epidemiology of hepatitis C virus infection: new estimates of age-specific antibody to HCV seroprevalence.». Hepatology (Baltimore, Md.). 57 (4): 1333–42. PMID 23172780. doi:10.1002/hep.26141
- ↑ Global Burden of Disease Study 2013, Collaborators (22 de agosto de 2015). «Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013.». Lancet (London, England). 386 (9995): 743–800. PMID 26063472. doi:10.1016/s0140-6736(15)60692-4
- ↑ GBD 2013 Mortality and Causes of Death, Collaborators (17 de dezembro de 2014). «Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013.». Lancet. 385 (9963): 117–71. PMC 4340604
 . PMID 25530442. doi:10.1016/S0140-6736(14)61682-2
. PMID 25530442. doi:10.1016/S0140-6736(14)61682-2 - ↑ Houghton M (novembro de 2009). «The long and winding road leading to the identification of the hepatitis C virus». Journal of Hepatology. 51 (5): 939–48. PMID 19781804. doi:10.1016/j.jhep.2009.08.004
- ↑ Shors, Teri (8 de novembro de 2011). Understanding viruses 2nd ed. Burlington, MA: Jones & Bartlett Learning. 535 páginas. ISBN 9780763785536
- ↑ Maheshwari, A; Ray S; Thuluvath PJ (26 de julho de 2008). «Acute hepatitis C». Lancet. 372 (9635): 321–32. PMID 18657711. doi:10.1016/S0140-6736(08)61116-2
- ↑ a b c d e f g h i j k l m n o p q r s Wilkins, T; Malcolm JK; Raina D; Schade RR (1 de junho de 2010). «Hepatitis C: diagnosis and treatment» (PDF). American family physician. 81 (11): 1351–7. PMID 20521755
- ↑ a b c d e Chronic Hepatitis C Virus Advances in Treatment, Promise for the Future. [S.l.]: Springer Verlag. 2011. p. 4. ISBN 9781461411918
- ↑ a b c d Nelson, PK; Mathers BM, Cowie B, Hagan H, Des Jarlais D, Horyniak D, Degenhardt L (13 de agosto de 2011). «Global epidemiology of hepatitis B and hepatitis C in people who inject drugs: results of systematic reviews». Lancet. 378 (9791): 571–83. PMC 3285467
 . PMID 21802134. doi:10.1016/S0140-6736(11)61097-0
. PMID 21802134. doi:10.1016/S0140-6736(11)61097-0 - ↑ a b c d Chronic Hepatitis C Virus Advances in Treatment, Promise for the Future. [S.l.]: Springer Verlag. 2011. pp. 103–104. ISBN 9781461411918
- ↑ a b c d e f g Ray, Stuart C.; Thomas, David L. (2009). «Chapter 154: Hepatitis C». In: Mandell, Gerald L.; Bennett, John E.; Dolin, Raphael. Mandell, Douglas, and Bennett's principles and practice of infectious diseases 7th ed. Philadelphia, PA: Churchill Livingstone. ISBN 978-0443068393
- ↑ Mueller, S; Millonig G; Seitz HK (28 de julho de 2009). «Alcoholic liver disease and hepatitis C: a frequently underestimated combination» (PDF). World journal of gastroenterology : WJG. 15 (28): 3462–71. PMC 2715970
 . PMID 19630099. doi:10.3748/wjg.15.3462[ligação inativa]
. PMID 19630099. doi:10.3748/wjg.15.3462[ligação inativa] - ↑ a b c d e f g h i j Alter, MJ (7 de maio de 2007). «Epidemiology of hepatitis C virus infection» (PDF). World journal of gastroenterology : WJG. 13 (17): 2436–41. PMID 17552026[ligação inativa]
- ↑ a b c d e f Ozaras, R; Tahan, V (abril de 2009). «Acute hepatitis C: prevention and treatment». Expert review of anti-infective therapy. 7 (3): 351–61. PMID 19344247. doi:10.1586/eri.09.8
- ↑ Zignego, AL; Ferri, C; Pileri, SA; et al. (janeiro de 2007). «Extrahepatic manifestations of Hepatitis C Virus infection: a general overview and guidelines for a clinical approach». Digestive and Liver Disease. 39 (1): 2–17. PMID 16884964. doi:10.1016/j.dld.2006.06.008
- ↑ Louie, KS; Micallef JM; Pimenta JM; Forssen UM (janeiro de 2011). «Prevalence of thrombocytopenia among patients with chronic hepatitis C: a systematic review». Journal of viral hepatitis. 18 (1): 1–7. PMID 20796208. doi:10.1111/j.1365-2893.2010.01366.x
- ↑ Lee, MR; Shumack, S (novembro de 2005). «Prurigo nodularis: a review». The Australasian journal of dermatology. 46 (4): 211–18; quiz 219–20. PMID 16197418. doi:10.1111/j.1440-0960.2005.00187.x
- ↑ Iannuzzella, F; Vaglio, A; Garini, G (maio de 2010). «Management of hepatitis C virus-related mixed cryoglobulinemia». Am. J. Med. 123 (5): 400–8. PMID 20399313. doi:10.1016/j.amjmed.2009.09.038
- ↑ Sugden, PB; Cameron, B, Bull, R, White, PA, Lloyd, AR (Setembro de 2012). «Occult infection with hepatitis C virus: friend or foe?». Immunology and cell biology. 90 (8): 763–73. PMID 22546735. doi:10.1038/icb.2012.20
- ↑ Carreño, V (21 de novembro de 2006). «Occult hepatitis C virus infection: a new form of hepatitis C.». World journal of gastroenterology : WJG. 12 (43): 6922–5. PMID 17109511
- ↑ a b Carreño García, V; Nebreda, JB, Aguilar, IC, Quiroga Estévez, JA (Março de 2011). «Occult hepatitis C virus infection.». Enfermedades infecciosas y microbiologia clinica. 29 Suppl 3: 14–9. PMID 21458706. doi:10.1016/S0213-005X(11)70022-2
- ↑ Pham, TN; Coffin, CS, Michalak, TI (Abril de 2010). «Occult hepatitis C virus infection: what does it mean?». Liver international : official journal of the International Association for the Study of the Liver. 30 (4): 502–11. PMID 20070513. doi:10.1111/j.1478-3231.2009.02193.x
- ↑ Carreño, V; Bartolomé, J, Castillo, I, Quiroga, JA (21 de junho de 2012). «New perspectives in occult hepatitis C virus infection.». World journal of gastroenterology : WJG. 18 (23): 2887–94. PMID 22736911. doi:10.3748/wjg.v18.i23.2887
- ↑ Carreño, V; Bartolomé, J; Castillo, I; Quiroga, JA (maio–junho de 2008). «Occult hepatitis B virus and hepatitis C virus infections.». Reviews in medical virology. 18 (3): 139–57. PMID 18265423. doi:10.1002/rmv.569
- ↑ Nicot, F (2004). «Chapter 19. Liver biopsy in modern medicine.». Occult hepatitis C virus infection: Where are we now?. [S.l.: s.n.] ISBN 978-953-307-883-0
- ↑ Scott, JD; Gretch, DR (21 de fevereiro de 2007). «Molecular diagnostics of hepatitis C virus infection: a systematic review.». JAMA: the Journal of the American Medical Association. 297 (7): 724–32. PMID 17312292. doi:10.1001/jama.297.7.724
- ↑ Robinson, JL (4 de julho de 2008). «Vertical transmission of the hepatitis C virus: Current knowledge and issues». Paediatr Child Health. 13 (6): 529–534. PMC 2532905
 . PMID 19436425
. PMID 19436425 - ↑ Nakano, T; Lau, GM; Lau, GM; et al. (dezembro de 2011). «An updated analysis of hepatitis C virus genotypes and subtypes based on the complete coding region». Liver Int. 32 (2): 339–45. PMID 22142261. doi:10.1111/j.1478-3231.2011.02684.x
- ↑ a b c d e Pondé, RA (fevereiro de 2011). «Hidden hazards of HCV transmission» (PDF). Medical microbiology and immunology. 200 (1): 7–11. PMID 20461405. doi:10.1007/s00430-010-0159-9
- ↑ a b Xia, X; Luo J, Bai J, Yu R (outubro de 2008). «Epidemiology of HCV infection among injection drug users in China: systematic review and meta-analysis». Public health. 122 (10): 990–1003. PMID 18486955. doi:10.1016/j.puhe.2008.01.014
- ↑ Imperial, JC (junho de 2010). «Chronic hepatitis C in the state prison system: insights into the problems and possible solutions». Expert review of gastroenterology & hepatology. 4 (3): 355–64. PMID 20528122. doi:10.1586/egh.10.26
- ↑ Vescio, MF; Longo B, Babudieri S, Starnini G, Carbonara S, Rezza G, Monarca R (abril de 2008). «Correlates of hepatitis C virus seropositivity in prison inmates: a meta-analysis». Journal of epidemiology and community health. 62 (4): 305–13. PMID 18339822. doi:10.1136/jech.2006.051599
- ↑ Day RA; Paul P; Williams B;; et al. (novembro de 2009). Brunner & Suddarth's textbook of Canadian medical-surgical nursing Canadian 2nd ed. Philadelphia, PA: Lippincott Williams & Wilkins. p. 1237. ISBN 9780781799898
- ↑ a b Marx, John (2010). Rosen's emergency medicine: concepts and clinical practice 7th edition. Philadelphia, PA: Mosby/Elsevier. p. 1154. ISBN 9780323054720
- ↑ «Highest Rates of Hepatitis C Virus Transmission Found in Egypt». Al Bawaaba. 9 de agosto de 2010. Consultado em 27 de agosto de 2010
- ↑ a b c Tohme RA, Holmberg SD (julho de 2010). «Is sexual contact a major mode of hepatitis C virus transmission?». Hepatology. 52 (4): 1497–505. PMID 20635398. doi:10.1002/hep.23808
- ↑ «Hepatitis C Group Education Class». United States Department of Veteran Affairs
- ↑ a b c d e f Jafari, S; Copes R, Baharlou S, Etminan M, Buxton J (novembro de 2010). «Tattooing and the risk of transmission of hepatitis C: a systematic review and meta-analysis» (PDF). International journal of infectious diseases : IJID : official publication of the International Society for Infectious Diseases. 14 (11): e928–40. PMID 20678951. doi:10.1016/j.ijid.2010.03.019
- ↑ «Hepatitis C» (PDF). Centers for Disease Control and Prevention (CDC). Consultado em 2 de Janeiro de 2012
- ↑ Lock G; Dirscherl M; Obermeier F; et al. (setembro de 2006). «Hepatitis C — contamination of toothbrushes: myth or reality?». J. Viral Hepat. 13 (9): 571–3. PMID 16907842. doi:10.1111/j.1365-2893.2006.00735.x
- ↑ a b c «Hepatitis C FAQs for Health Professionals». Centers for Disease Control and Prevention (CDC). Consultado em 2 de Janeiro de 2012
- ↑ a b Lam, NC; Gotsch, PB, Langan, RC (15 de novembro de 2010). «Caring for pregnant women and newborns with hepatitis B or C» (PDF). American family physician. 82 (10): 1225–9. PMID 21121533
- ↑ Mast EE (2004). «Mother-to-infant hepatitis C virus transmission and breastfeeding». Advances in Experimental Medicine and Biology. 554: 211–6. PMID 15384578
- ↑ Senadhi, V (julho de 2011). «A paradigm shift in the outpatient approach to liver function tests». Southern Medical Journal. 104 (7): 521–5. PMID 21886053. doi:10.1097/SMJ.0b013e31821e8ff5
- ↑ Halliday, J; Klenerman P, Barnes E (Maio de 2011). «Vaccination for hepatitis C virus: closing in on an evasive target» (PDF). Expert review of vaccines. 10 (5): 659–72. PMC 3112461
 . PMID 21604986. doi:10.1586/erv.11.55
. PMID 21604986. doi:10.1586/erv.11.55 - ↑ Hagan, H; Pouget, ER, Des Jarlais, DC (1 de julho de 2011). «A systematic review and meta-analysis of interventions to prevent hepatitis C virus infection in people who inject drugs». The Journal of infectious diseases. 204 (1): 74–83. PMC 3105033
 . PMID 21628661. doi:10.1093/infdis/jir196
. PMID 21628661. doi:10.1093/infdis/jir196 - ↑ Torresi, J; Johnson D, Wedemeyer H (junho de 2011). «Progress in the development of preventive and therapeutic vaccines for hepatitis C virus» (PDF). Journal of hepatology. 54 (6): 1273–85. PMID 21236312. doi:10.1016/j.jhep.2010.09.040
- ↑ Ilyas, JA; Vierling, JM (agosto de 2011). «An overview of emerging therapies for the treatment of chronic hepatitis C». Clinics in liver disease. 15 (3): 515–36. PMID 21867934. doi:10.1016/j.cld.2011.05.002
- ↑ a b Hoofnagle, JH; Sherker, AH (17 de abril de 2014). «Therapy for hepatitis C--the costs of success.». The New England Journal of Medicine. 370 (16): 1552–3. PMID 24725236. doi:10.1056/nejme1401508
- ↑ a b Liang, TJ; Ghany, MG (16 de maio de 2013). «Current and future therapies for hepatitis C virus infection.». The New England Journal of Medicine. 368 (20): 1907–17. PMID 23675659. doi:10.1056/NEJMra1213651
- ↑ Awad T, Thorlund K, Hauser G, Stimac D, Mabrouk M, Gluud C (abril de 2010). «Peginterferon alpha-2a is associated with higher sustained virological response than peginterferon alfa-2b in chronic hepatitis C: systematic review of randomized trials». Hepatology. 51 (4): 1176–84. PMID 20187106. doi:10.1002/hep.23504
- ↑ Foote BS, Spooner LM, Belliveau PP (setembro de 2011). «Boceprevir: a protease inhibitor for the treatment of chronic hepatitis C». Ann Pharmacother. 45 (9): 1085–93. PMID 21828346. doi:10.1345/aph.1P744
- ↑ Smith LS, Nelson M, Naik S, Woten J (maio de 2011). «Telaprevir: an NS3/4A protease inhibitor for the treatment of chronic hepatitis C». Ann Pharmacother. 45 (5): 639–48. PMID 21558488. doi:10.1345/aph.1P430
- ↑ Ghany MG, Nelson DR, Strader DB, Thomas DL, Seeff LB (outubro de 2011). «An update on treatment of genotype 1 chronic hepatitis C virus infection: 2011 practice guideline by the American Association for the Study of Liver Diseases». Hepatology. 54 (4): 1433–44. PMC 3229841
 . PMID 21898493. doi:10.1002/hep.24641
. PMID 21898493. doi:10.1002/hep.24641 - ↑ Alavian SM, Tabatabaei SV (abril de 2010). «Treatment of chronic hepatitis C in polytransfused thalassaemic patients: a meta-analysis». J. Viral Hepat. 17 (4): 236–44. PMID 19638104. doi:10.1111/j.1365-2893.2009.01170.x
- ↑ a b De Clercq, E (15 de novembro de 2013). «Dancing with chemical formulae of antivirals: A panoramic view (Part 2).». Biochemical pharmacology. 86 (10): 1397–410. PMID 24070654. doi:10.1016/j.bcp.2013.09.010
- ↑ a b Bunchorntavakul, C; Chavalitdhamrong, D; Tanwandee, T (27 de setembro de 2013). «Hepatitis C genotype 6: A concise review and response-guided therapy proposal.». World journal of hepatology. 5 (9): 496–504. PMID 24073301. doi:10.4254/wjh.v5.i9.496
- ↑ Sanders, Mick (2011). Mosby's Paramedic Textbook. [S.l.]: Jones & Bartlett Publishers. p. 839. ISBN 9780323072755
- ↑ Ciria R, Pleguezuelo M, Khorsandi SE; et al. (Maio de 2013). «Strategies to reduce hepatitis C virus recurrence after liver transplantation». World J Hepatol. 5 (5): 237–50. PMC 3664282
 . PMID 23717735. doi:10.4254/wjh.v5.i5.237
. PMID 23717735. doi:10.4254/wjh.v5.i5.237 - ↑ Coilly A, Roche B, Samuel D (Fevereiro de 2013). «Current management and perspectives for HCV recurrence after liver transplantation». Liver Int. 33 Supl. 1: 56–62. PMID 23286847. doi:10.1111/liv.12062
- ↑ a b Hepatitis C and CAM: What the Science Says Arquivado em 20 de março de 2011, no Wayback Machine.. National Center for Complementary and Alternative Medicine (NCCAM). Março de 2011.
- ↑ Liu, J; Manheimer E, Tsutani K, Gluud C (março de 2003). «Medicinal herbs for hepatitis C virus infection: a Cochrane hepatobiliary systematic review of randomized trials». The American journal of gastroenterology. 98 (3): 538–44. PMID 12650784. doi:10.1111/j.1572-0241.2003.07298.x
- ↑ Rambaldi, A; Jacobs, BP; Gluud, C (17 de Outubro de 2007). «Milk thistle for alcoholic and/or hepatitis B or C virus liver diseases». Cochrane Database Syst Rev (4): CD003620. PMID 17943794
- ↑ Fung J; Lai CL; Hung I; et al. (Setembro de 2008). «Chronic hepatitis C virus genotype 6 infection: response to pegylated interferon and ribavirin». The Journal of Infectious Diseases. 198 (6): 808–12. PMID 18657036. doi:10.1086/591252
- ↑ a b c «Hepatitis C». World Health Organization (WHO). Junho de 2011. Consultado em 13 de julho de 2011
- ↑ Yu ML; Chuang WL (março de 2009). «Treatment of chronic hepatitis C in Asia: when East meets West». J. Gastroenterol. Hepatol. 24 (3): 336–45. PMID 19335784. doi:10.1111/j.1440-1746.2009.05789.x
- ↑ Colacino, Joseph M.; Heinz, Beverly A. (25 de outubro de 2004). Hepatitis prevention and treatment. [S.l.]: Springer Science & Business Media. p. 32. 246 páginas. ISBN 978-3-7643-5956-0
- ↑ Philip Spradling. «CDC Health Information for International Travel 2012». CDC. Consultado em 3 de junho de 2020
- ↑ a b Boyer, JL (2001). Liver cirrhosis and its development: proceedings of the Falk Symposium 115. [S.l.]: Springer. pp. 344. ISBN 9780792387602
- ↑ Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M (abril de 1989). «Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome». Science. 244 (4902): 359–62. PMID 2523562. doi:10.1126/science.2523562
- ↑ Kuo, G; Choo, Q L; Alter, H J; et al. (21 de abril de 1989). «An Assay for Circulating Antibodies to a Major Etiologic Virus of Human non-A, non-B Hepatitis». Science. 244 (4902): 362–4. PMID 2496467. doi:10.1126/science.2496467. Consultado em 3 de junho de 2020
- ↑ Winners Albert Lasker Award for Clinical Medical Research, The Lasker Foundation. Retrieved 20 Fevereiro 2008.
- ↑ Patente EP 0318216: Houghton, M; Choo, Q-L e Kuo, G, "NANBV diagnostics", publicada em 31 de Maio de 1989, atribuída a Chiron
- ↑ Wilken, Judge. «United States Court of Appeals for the Federal Circuit». United States Court of Appeals for the Federal Circuit. Consultado em 11 de Janeiro de 2012
- ↑ Eurosurveillance editorial, team (28 de julho de 2011). «World Hepatitis Day 2011» (PDF). Eurosurveillance. 16 (30). PMID 21813077
- ↑ a b Wong, JB (2006). «Hepatitis C: cost of illness and considerations for the economic evaluation of antiviral therapies». PharmacoEconomics. 24 (7): 661–72. PMID 16802842. doi:10.2165/00019053-200624070-00005
- ↑ a b El Khoury, AC; Klimack, WK; Wallace, C; Razavi, H (1 de Dezembro de 2011). «Economic burden of hepatitis C-associated diseases in the United States». Journal of Viral Hepatitis. 19 (3): 153–60. PMID 22329369. doi:10.1111/j.1365-2893.2011.01563.x
- ↑ «Hepatitis C Prevention, Support and Research ProgramHealth Canada». Public Health Agency of Canada. Novembro de 2003. Consultado em 10 de Janeiro de 2012
- ↑ Zuckerman, edited by Howard Thomas, Stanley Lemon, Arie (2008). Viral Hepatitis 3rd ed. Oxford: John Wiley & Sons. 532 páginas. ISBN 9781405143882
- ↑ Ahn, J; Flamm, SL (agosto de 2011). «Hepatitis C therapy: other players in the game». Clinics in liver disease. 15 (3): 641–56. PMID 21867942. doi:10.1016/j.cld.2011.05.008
- ↑ Vermehren, J; Sarrazin, C (fevereiro de 2011). «New HCV therapies on the horizon». Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases. 17 (2): 122–34. PMID 21087349. doi:10.1111/j.1469-0691.2010.03430.x
- Este artigo foi inicialmente traduzido, total ou parcialmente, do artigo da Wikipédia em inglês cujo título é «Hepatitis C».
