Química

| Química |
|---|
 |
| Substâncias Verde: fluoresceína; Vermelho: rodamina B; Amarelo: rodamina 6G; Azul: quinino; Roxo: quinino e rodamina 6G. |
| Campos de pesquisa |
| História |
| Separação de misturas |
| Elementos químicos |
| Composto orgânico |
Química é o estudo científico das propriedades e transformações da matéria.[1] Esta ciência natural abrange desde os elementos que compõem a matéria até os compostos formados por átomos,[2] moléculas e íons[3]: sua composição, estrutura, propriedades, comportamento e as mudanças que sofrem durante uma reação com outras substâncias. A química também aborda a natureza das ligações químicas em compostos químicos. No âmbito de sua disciplina, a química ocupa uma posição intermediária entre a física e a biologia. Às vezes é chamada de ciência central porque fornece uma base para a compreensão de disciplinas científicas básicas e aplicadas em um nível fundamental.[4] Por exemplo, a química explica aspectos do crescimento das plantas (botânica), a formação de rochas ígneas (geologia), como o ozônio atmosférico é formado e como os poluentes ambientais são degradados (ecologia), as propriedades do solo na lua (cosmoquímica), como funcionam os medicamentos (farmacologia) e como coletar evidências de DNA na cena do crime (forense).
É referida como “ciência central” devido ao seu papel na conexão das ciências físicas,[5] que incluem a química, com as ciências da vida, ciências farmacêuticas e ciências aplicadas, como medicina e engenharia. A natureza dessa relação é um dos principais tópicos da filosofia da química e da cientimetria . A frase foi popularizada por seu uso em um livro de Theodore L. Brown e H. Eugene LeMay, intitulado Chemistry: The Central Science, que foi publicado pela primeira vez em 1977, com uma décima quinta edição publicada em 2021. O papel central da química pode ser visto na classificação sistemática e hierárquica das ciências por Auguste Comte. Cada disciplina fornece uma estrutura mais geral para a área que precede (matemática → astronomia → física → química → biologia → ciências sociais). Balaban e Klein propuseram mais recentemente um diagrama mostrando a ordenação parcial das ciências em que a química pode ser argumentada como “a ciência central”, uma vez que fornece um grau significativo de ramificação. Ao formar essas conexões, o campo inferior não pode ser totalmente reduzido aos mais altos. É reconhecido que os campos inferiores possuem ideias e conceitos emergentes que não existem nos campos superiores da ciência. A filosofia da química considera a metodologia e os pressupostos subjacentes à ciência da química. É explorado por filósofos, químicos e equipes de filósofos-químicos. Durante grande parte de sua história, a filosofia da ciência foi dominada pela filosofia da física , mas as questões filosóficas que surgem da química receberam atenção crescente desde a última parte do século XX.
A história desta ciência representa um período de tempo desde a história antiga até o presente. Por volta de 1000 a.C., as civilizações usavam tecnologias que eventualmente formariam a base dos vários ramos da química. Exemplos incluem a descoberta do fogo, extração de metais de minérios , fabricação de cerâmica e esmaltes, fermentação de cerveja e vinho , extração de produtos químicos de plantas para remédios e perfumes , transformação de gordura em sabão , fabricação de vidro e ligas como o bronze .
A protociência da química, a alquimia , não conseguiu explicar a natureza da matéria e suas transformações. No entanto, realizando experimentos e registrando os resultados, os alquimistas prepararam o terreno para a química moderna. Enquanto a alquimia e a química se preocupam com a matéria e suas transformações, os químicos são vistos como aplicando o método científico ao seu trabalho.
No Brasil são considerados profissionais relacionados a ciências químicas, com registro nos Conselhos Federais e Regionais de Química: engenheiros químicos, bacharéis e licenciados em química, bacharéis em química industrial ou química tecnológica, bacharéis em bioquímica.
Definição
[editar | editar código-fonte]A definição de química mudou ao longo do tempo, à medida que novas descobertas e teorias foram adicionadas à funcionalidade da ciência. O termo "química", na visão do notável cientista Robert Boyle, em 1661, significava o assunto dos princípios materiais de corpos mistos. Em 1663, o químico Christopher Glaser descreveu a química como uma "arte científica", pela qual se aprende a dissolver corpos, e extrair deles as diferentes substâncias em sua composição, como uni-los novamente, e exaltá-los à “uma perfeição superior”.[6]
Durante séculos, a humanidade acumulou conhecimento sobre o comportamento das substâncias, baseando-se na experiência e observação. Para tanto, procurou organizar todas as informações em um só campo, mas foi somente a partir do século XIX - quando a soma de todo o conhecimento se tornou concreta e abrangente -, que foi possível estabelecer bases sólidas teóricas para a interpretação dos fatos e conceber uma verdadeira forma de conhecimento sistemático, ou seja, uma ciência própria.
A definição de 1730 da palavra "química", usada por Georg Ernst Stahl, significava a arte de resolver corpos mistos, compostos ou agregados em seus princípios; e de compor tais corpos a partir desses princípios. Em 1837, Jean-Baptiste Dumas considerou a palavra "química" para se referir à ciência preocupada com as leis e efeitos das forças moleculares. Essa definição evoluiu ainda mais até que, em 1947, passou a significar a ciência das substâncias: sua estrutura, suas propriedades e as reações que as transformam em outras substâncias – uma caracterização aceita por Linus Pauling. Mais recentemente, em 1998, o professor Raymond Chang ampliou a definição de "química" para significar “o estudo da matéria e as mudanças que ela sofre”.
Sendo assim:
| “ | "Química é a ciência que estuda as propriedades, a composição e a estrutura das substâncias (elementos e compostos), as transformações a que estão submetidas e a energia liberada ou absorvida durante este processo”. | ” |
— Enciclopédia Barsa, 1997[7] | ||
A química lida com as propriedades dos elementos e compostos, com as possíveis transformações de uma substância em outra, faz previsões sobre as propriedades de compostos anteriormente desconhecidos, fornece métodos para a síntese de novos compostos e métodos de medição para decifrar a composição química de amostras desconhecidas.[8]
Embora todas as substâncias sejam compostas de relativamente poucos "blocos de construção", ou seja, cerca de 80 a 100 dos 118 elementos conhecidos atualmente, as diferentes combinações e arranjos dos elementos levam a vários milhões de compostos muito diferentes, que por sua vez criam formas tão diferentes de matéria, como água, areia, plantas e tecido animal, ou plástico. O tipo de composição determina, em última análise, as propriedades químicas e físicas das substâncias, tornando a química uma ciência abrangente. Além dos conhecimentos escolares, os interessados e estudantes de química podem aprofundar seus conhecimentos através da literatura química.
Os avanços nas várias subáreas da química são muitas vezes o pré-requisito indispensável para novos conhecimentos noutras disciplinas, sobretudo nas áreas da biologia e da medicina, mas também na área da física e das engenharias. Além disso, muitas vezes permitem reduzir os custos de produção de muitos produtos industriais. Por exemplo, catalisadores aprimorados resultam em reações mais rápidas, economizando tempo e energia na indústria. Reações ou substâncias recém-descobertas podem substituir as antigas e, portanto, também interessar à ciência e à indústria.
Etimologia
[editar | editar código-fonte]A palavra química vem de uma modificação durante o Renascimento da palavra alquimia, que se referia a um conjunto anterior de práticas que englobam elementos da química, metalurgia, filosofia, astrologia, astronomia, misticismo e medicina.[9] A alquimia é frequentemente associada à busca de transformar chumbo ou outros metais básicos em ouro, embora os alquimistas também estivessem interessados em muitas das questões da química moderna.[10]
Ao que tudo indica, a palavra química deriva da palavra alquimia, que é encontrada em várias formas nas línguas europeias.[10] A alquimia deriva da palavra árabe kimiya ( كيميا ) ou al-kīmiyāʾ ( الكيمياء )[11].[12] O termo árabe é derivado do grego antigo χημία , khēmia , ou χημεία , khēmeia, 'arte de ligar metais', de χύμα (khúma, “fluido”), de χέω (khéō, “eu despejo” )[13]. No entanto, a origem final da palavra é incerta.[nota 1]
Existem duas visões principais sobre a derivação da palavra grega. Segundo um, a palavra vem do grego χημεία, derramar, infusão, usada em conexão com o estudo dos sucos das plantas, e daí estendida às manipulações químicas em geral; esta derivação explica as grafias antiquadas "chymist" e "chymistry". A outra visão o rastreia até khem ou khame , hieróglifo khmi , que denota terra negra em oposição a areia estéril, e ocorre em Plutarco como χημεία; nesta derivação, a alquimia é explicada como significando a "arte egípcia". Diz-se que a primeira ocorrência da palavra está em um tratado de Julius Firmicus, um escritor astrológico do século IV, mas o prefixo al deve ser adicionado por um copista árabe posterior.[9] Em inglês, Piers Plowman (1362) contém a frase "experimentis of alconomye", com variantes "alkenemye" e "alknamye". O prefixo “al” começou a ser descartado em meados do século XVI.[14]
O árabe al-kīmiyaʾ ou al-khīmiyaʾ ( الكيمياء ou الخيمياء ), segundo alguns, deriva da palavra grega koiné khymeia (χυμεία) que significa "a arte de ligar metais, alquimia";[10] nos manuscritos, esta palavra também é escrita khēmeia ( χημεία ) ou kheimeia ( χειμεία ), que é a provável base da forma árabe.[10] De acordo com Mahn, a palavra grega χυμεία khumeia originalmente significava "fundido", "fundido", "solda", "liga", etc. (cf. Gk.( χέειν ) "derramar"; khuma ( χύμα ), "aquilo que é derramado, um lingote").[12][15]
Assumindo uma origem grega, a química é definida da seguinte forma[16]:
| “ | “Química, da palavra grega χημεία ( khēmeia ) que significa ‘juntar’ ou ‘derramar’, é a ciência da matéria na escala atômica e molecular , lidando principalmente com coleções de átomos, como moléculas , cristais e metais.” | ” |
— Definição de Quimica segundo os gregos | ||
De acordo com o egiptólogo Wallis Budge , a palavra árabe al-kīmiyaʾ na verdade significa "a (ciência) egípcia", emprestada da palavra copta para "Egito", kēme (ou seu equivalente no dialeto boárico medieval do copta, khēme). Esta palavra copta deriva do demótico kmỉ , ele próprio do antigo egípcio kmt . A antiga palavra egípcia referia-se tanto ao país quanto à cor "preto" (o Egito era a "Terra Negra", em contraste com a "Terra Vermelha", o deserto circundante); então essa etimologia também poderia explicar o apelido de "artes negras egípcias".[10] No entanto, esta teoria pode ser um exemplo de etimologia popular.[17]
Assumindo uma origem egípcia, a química é definida da seguinte forma[10]:
| “ | "Química, da antiga palavra egípcia ‘khēmia’ que significa transmutação da terra, é a ciência da matéria na escala atômica para molecular, lidando principalmente com coleções de átomos, como moléculas , cristais e metais.” | ” |
— Definição de Química, segundo os egipcíos | ||
Assim, de acordo com Budge e outros, a química deriva de uma palavra egípcia “khemein” ou “khēmia”, "preparação de pólvora negra", derivada do nome khem.[10] Um decreto do imperador romano Diocleciano, escrito por volta de 300 DC em grego, fala contra "os antigos escritos dos egípcios, que tratam da transmutação khēmia de ouro e prata".[18]
Mais tarde, o latim medieval tinha “alchimia/alchymia”, (alquimia), “alchimicus” (alquímico) e “alchimista” (alquimista).[19] O mineralogista e humanista Georg Agrícola foi o primeiro a abandonar o artigo definido árabe “al-”. Em suas obras latinas de 1530 em diante, ele escreveu exclusivamente “chymia” e “chymista” para descrever a atividade que hoje caracteriza-se como química ou alquímica. Como humanista, Agrícola pretendia purificar as palavras e devolvê-las às suas raízes clássicas. Ele não tinha intenção de fazer uma distinção semântica entre “chymia” e “alchymia”.[10]
Durante o final do século XVI, a nova cunhagem de Agrícola se propagou lentamente.[20] Parece ter sido adotado na maioria das línguas europeias vernáculas após a adoção de Conrad Gessner em sua obra pseudônima extremamente popular, Thesaurus Euonymi Philiatri De remediis secretis: Liber physicus, medicus, et partim etiam chymicus (Thesaurus Euonymus Philiatris Sobre remédios secretos: Um livro de um físico, um médico e, em parte, também um químico). A obra de Gessner foi frequentemente republicada na segunda metade do século XVI em latim e também foi publicada em várias línguas europeias vernáculas, com a palavra escrita sem o “al-”.[nota 2]
Nos séculos 16 e 17 na Europa, as formas alchimia e chimia (e chymia ) eram sinônimas e intercambiáveis. A distinção semântica entre uma ciência racional e prática da chimia é uma alchimia oculta que surgiu apenas no início do século XVIII.[10]
História
[editar | editar código-fonte]A história da química representa um período de tempo desde a história antiga até o presente. Por volta de 1000 a.C., as civilizações usavam tecnologias que eventualmente formariam a base dos vários ramos da química. Exemplos incluem a descoberta do fogo, extração de metais de minérios, fabricação de cerâmica e esmaltes, fermentação de cerveja e vinho, extração de produtos químicos de plantas para remédios e perfumes, transformação de gordura em sabão, fabricação de vidro e ligas como o bronze. Durante centenas de anos, a humanidade acumulou conhecimento empírico sobre o comportamento da matéria e tentou organizar essas informações em um corpo doutrinário.
Nos Primórdios da Humanidade
[editar | editar código-fonte]Durante um longo período da trajetória humana, o poder de manipulação da matéria e meios naturais pelo homem se resumiu à mera modelação de materiais, como a pedra, o osso e a madeira, a fim de transformá-los em utensílios. Tardiamente, com a invenção das rudimentares e pioneiras técnicas de metalurgia, se fez presente uma genuína revolução em todos os aspectos das sociedades primitivas.
Uma oficina de processamento de ocre [nota 3] de 100.000 anos foi encontrada na Caverna de Blombos, na África do Sul.[22] Isso indica que os primeiros humanos tinham um conhecimento elementar de química. Pinturas desenhadas por humanos primitivos consistindo em humanos primitivos misturando sangue animal com outros líquidos encontrados nas paredes das cavernas também indicam um pequeno conhecimento de química.
Indiscutivelmente, a primeira reação química usada de maneira controlada foi o fogo.[23] No entanto, por milênios, o fogo foi visto simplesmente como uma força mística que poderia transformar uma substância em outra (madeira queimada ou água fervente) enquanto produzia calor e luz.[24] O fogo afetou muitos aspectos das primeiras sociedades.[25] Estes variam desde as facetas mais simples da vida cotidiana, como cozinhar e aquecer e iluminar o habitat, até usos mais avançados, como fazer cerâmica e tijolos e derreter metais para fazer ferramentas. Foi o fogo que levou à descoberta do vidro e à purificação dos metais; isto foi seguido pela ascensão da metalurgia.[26] Durante os primeiros estágios da metalurgia, buscaram-se métodos de purificação de metais, e o ouro, conhecido no antigo Egito já em 2900 a. C., tornou-se um metal precioso.[27]
A química na antiguidade existia na forma de arte experimental prática (como conhecimento aplicado de habilidades e técnicas químicas), por um lado, e como um corpo filosófico-natural de pensamento e teoria com um caráter cada vez mais alquímico (alquimia do "conhecimento secreto"[28]), por outro. Teoria e prática só foram combinadas no início dos tempos modernos, quando ambas foram colocadas na base do trabalho científico.[29]
O ofício de ferreiro, pioneiro das primeiras transformações químicas controladas pelo homem na história, adquiriu um valor predominante nestas comunidades. Este trabalho - como sugerem fartos estudos antropológicos sobre os povos primitivos - relacionava-se com aspectos da divindade e imbuia-se de conotação mágica e religiosa. Desde de tempos remotos se conhecem os metais ouro, prata, cobre, estanho e chumbo. Além, a obtenção de mercúrio a partir do mineral cinábrio[nota 4] , descrita por Teofrasto por volta do ano 300 A.C., teve notável importância no evolução da metalurgia, devido a sua propriedade de conceder coesão às ligas metálicas e coincide com os mais antigos registros da alquimia.
Tentativas filosóficas de racionalizar por que diferentes substâncias têm propriedades diferentes (cor, densidade, cheiro), existem em diferentes estados (gasoso, líquido e sólido) e reagem de maneira diferente quando expostas a ambientes, por exemplo, água, fogo ou temperatura variadas, levaram os filósofos antigos a postular as primeiras teorias sobre a natureza e a química. A história de tais teorias filosóficas relacionadas à química provavelmente pode ser rastreada até cada civilização antiga. O aspecto comum em todas essas teorias foi a tentativa de identificar um pequeno número de elementos clássicos primários que compõem todas as várias substâncias da natureza. Substâncias como ar, água e solo/terra, formas de energia, como fogo e luz, e conceitos mais abstratos, como pensamentos, éter, e céu, eram comuns em civilizações antigas, mesmo na ausência de qualquer fertilização cruzada: por exemplo, filosofias gregas antigas, indianas, maias e chinesas, todas consideravam ar, água, terra e fogo como elementos primários.
Uma hipótese química básica surgiu pela primeira vez na Grécia Clássica com a teoria dos quatro elementos , proposta definitivamente por Aristóteles , afirmando que fogo , ar, terra e água eram os elementos fundamentais dos quais tudo é formado como uma combinação.[32] O atomismo grego remonta a 440 aC, surgindo em obras de filósofos como Demócrito e Epicuro. Em 50 aC, o filósofo romano Lucrécio expandiu a teoria em seu livro De rerum natura (Sobre a natureza das coisas).[33] Ao contrário dos conceitos modernos de ciência, o atomismo grego era puramente filosófico por natureza, com pouca preocupação com observações empíricas e nenhuma preocupação com experimentos químicos.[34]
Uma forma inicial da ideia de conservação de massa é a noção de que "nada vem do nada" na filosofia grega antiga, que pode ser encontrada em Empédocles (aproximadamente século IV aC): "Pois é impossível que qualquer coisa venha a ser do que não é, e não se pode produzir ou ouvir que o que é deve ser totalmente destruído”;[35] e Epicuro (século III aC), que, descrevendo a natureza do Universo, escreveu que "a totalidade das coisas sempre foi como é agora e sempre será".[36]
A Alquimia
[editar | editar código-fonte]
A alquimia foi uma atividade pré-científica que visava alcançar uma evoluída compreensão do cosmo, da matéria e do homem. Em particular, através do conhecimento da natureza da matéria, os alquimistas visavam transformá-la e transmutar metais de baixo valor em prata ou ouro puro. A prática da alquimia teve origem em tempos remotos na índia, na China e na Europa. Certas características comuns parecem apontar uma mistura mútua influência entre antigos alquimistas chineses e hindus. Em ambas as culturas, o objetivo central da alquimia não era a obtenção de ouro, mas o prolongamento da vida. Por consequência, nas civilizações orientais, a alquimia estava muito mais próxima da medicina que da química.
Segundo os alquimistas, através de certas técnicas, que envolvem arte, ciência e religião, seria possível transformar uma substância em outra.[14] Por terem desenvolvido a utilização de diversos procedimentos de laboratório, a alquimia foi uma atividade ancestral da química, a qual se deve a descoberta de inúmeras substâncias e a invenção de grande variedade de instrumentos, que mais tarde desempenharam papel de destaque no domínio da metodologia científica.[14] Vários foram os experimentos realizados pelos alquimistas, mas a principal empreitada era a transmutação, esta se baseava na interpretação dada pela filosofia clássica grega à composição da matéria.[40] Na época, Aristóteles acreditava que todas as substâncias eram compostas de diferentes porções de quatro elementos fundamentais: terra, ar, fogo e água. Partindo deste princípio, os alquimistas desenvolveram seu postulado fundamental: "a matéria é a única que pode sofrer transmutação mediante a variação de proporções entre seus componentes".[14] Os alquimistas também acreditavam na existência de uma lendária substância capaz de realizar esta transmutação, denominada elixir, ou Pedra Filosofal.[41][42] A essa substância também eram atribuídas outras propriedades, como o poder curativo, rejuvenescente e de imortalidade.[43][44] Entretanto, os alquimistas medievais tinham mais interesse nos poderes da transmutação da matéria atribuídos à Pedra Filosofal, uma vez que se alcançassem este conhecimento poderiam acumular grande quantidade de riqueza.[44]
No mundo islâmico, os muçulmanos traduziam as obras dos antigos filósofos gregos e helenísticos para o árabe e faziam experiências com ideias científicas.[45] As obras árabes atribuídas ao alquimista do século VIII, Jābir ibn Hayyān, introduziram uma classificação sistemática de substâncias químicas e forneceram instruções para derivar um composto inorgânico (sal amoníaco ou cloreto de amônio) de substâncias orgânicas (como plantas, sangue e cabelo) por meios químicos.[46] Algumas obras jabirianas árabes (por exemplo, o "Livro da Misericórdia" e o "Livro dos Setenta") foram posteriormente traduzidas para o latim sob o nome latinizado de "Geber" e, na Europa do século XIII, um escritor anônimo, geralmente referido como pseudo-Geber, começou a produzir escritos alquímicos e metalúrgicos sob este nome.[45] Os alquimistas árabes fizeram grandes descobertas químicas; Abu Musa Jabir Hayyan, por exemplo, descobriu o ácido nítrico.[47] Muito além, muitas palavras usadas na química, como álcool (do árabe al-kohul),[48] Alcalino (do árabe al-qaly),[49] Alquimia (do árabe al-kīmiyā),[50] foram introduzidas pelos alquimistas árabes.[51]
Existia um lado fraudulento da alquimia, especialmente a fabricação de ouro falsificado a partir de substâncias baratas.[52] Menos de um século antes, Dante Alighieri também demonstrou consciência dessa fraude, levando-o a consignar todos os alquimistas ao Inferno em seus escritos.[53] Logo depois, em 1317, o Papa João XXII[54] ordenou que todos os alquimistas deixassem a França por fazerem dinheiro falso.[53] Uma lei foi aprovada na Inglaterra em 1403, tornando a "multiplicação de metais" punível com a morte.[53] Apesar dessas e de outras medidas aparentemente extremas, a alquimia não morreu.[12] A realeza e as classes privilegiadas ainda buscavam descobrir por si mesmas a pedra filosofal e o elixir da vida.[14]
Da Alquimia Nasce a Química
[editar | editar código-fonte]
A protociência da química, a alquimia, não conseguiu explicar a natureza da matéria e suas transformações. No entanto, realizando experimentos e registrando os resultados, os alquimistas prepararam o terreno para a química moderna. Embora tanto a alquimia quanto a química se preocupem com a matéria e suas transformações, a diferença crucial foi dada pelo método científico que os químicos empregavam em seu trabalho. A química, como um corpo de conhecimento distinto da alquimia, tornou-se uma ciência estabelecida com o trabalho de Antoine Lavoisier, que desenvolveu uma lei de conservação de massa que exigia medições cuidadosas e observações quantitativas de fenômenos químicos. A química foi precedida por sua protociência, a alquimia , que operou uma abordagem não científica para entender os constituintes da matéria e suas interações. Apesar de não conseguirem explicar a natureza da matéria e suas transformações, os alquimistas prepararam o terreno para a química moderna realizando experimentos e registrando os resultados. Robert Boyle, embora cético em relação aos elementos e convencido da alquimia, desempenhou um papel fundamental na elevação da "arte sagrada" como uma disciplina independente, fundamental e filosófica em sua obra The Skeptical Chymist (1661).[55]
Entre os séculos III a.C. e o século XVI d.C., a química estava dominada pela alquimia. O objetivo de investigação mais conhecido da alquimia era a procura da pedra filosofal, um método hipotético capaz de transformar os metais em ouro, e o elixir da longa vida. Na investigação química desenvolveram-se novos produtos químicos, instrumentos e métodos para a separação de elementos químicos - dentre os quais a destilação, o banho Maria, os cadinhos e as balanças. Deste modo foram-se assentando os pilares básicos para o desenvolvimento de uma futura química experimental. Foram os aspectos pré-científicos e esotéricos da alquimia que contribuíram fortemente para a evolução da química no Egito greco-romano, na Idade de Ouro Islâmica e depois na Europa. A alquimia e a química compartilham um interesse na composição e nas propriedades da matéria e, até o século XVIII, não eram disciplinas separadas. O termo química tem sido usado para descrever a mistura de alquimia e química que existia antes dessa época.
Nos séculos 16 e 17 , muitos conceitos que mais tarde se tornaram óbvios, como pressão , temperatura ou fases da matéria , não eram totalmente compreendidos, muito menos os de átomos ou moléculas . Ainda que o conceito de átomo tenha sido postulado pelo grego Demócrito, o processo de transição entre a alquimia e a química ocorreu assim de forma bastante gradual. Apesar do trabalho de numerosos estudiosos eméritos, ainda no final do século XVIII alguns conceitos completamente incorretos ainda eram considerados válidos, como por exemplo a teoria do flogisto, na qual postulava a existência de um elemento semelhante ao fogo assim chamado.
A química dos séculos XVII e XVIII alcançou um estado de desenvolvimento inferior ao das demais disciplinas científicas. Durante este tempo, a fonte de referência primordial do campo foi a Obra de Isaac Newton Opticks (Óptica, 1704),[56] em cujos apêndices finais o físico britânico postulava um conjunto de hipóteses quanto à natureza da matéria.[57]
As descobertas realizadas no fim do Século XVIII por Georg e Joseph Black (o dióxido de carbono) e Joseph Priestley (o oxigênio) representaram um prelúdio ao surgimento da primeira doutrina metodológica da química, iniciada com o francês Antoine-Laurent Lavoisier. Os esforços de Lavoisier para explicar a reação de combustão, a formulação da lei da conservação da matéria ("Na natureza nada se perde e nada se cria, tudo se transforma"), além de empreender uma nomenclatura química geral e racional assinalaram o início de uma nova etapa no desenvolvimento desta ciência.
Antoine Lavoisier, "O Pai da Química Moderna" | ||||
 Antoine-Laurent Lavoisier nasceu em Paris, em 1743. Dedicou-se ao mesmo tempo à política e às ciências. Suas primeiras pesquisas científicas ficaram na determinação das variações de peso sofridas por materiais após a combustão. Descobriu que essas variações eram responsabilidade de um gás semelhante ao ar atmosférico, que batizou com o nome de Oxigênio. Mais tarde conseguiu decompor o ar em oxigênio e nitrogênio e depois recompô-lo a partir destes elementos.[58] Apoiado no trabalho experimental, definiu a matéria por sua propriedade de ter uma massa determinada e enunciou a lei de conservação da massa nas reações, fundamental na história da química, expresso na máxima “Na natureza nada se cria e nada se perde, tudo se transforma”. Também identificou a noção de elemento químico como aquela substância que não pode ser decomposta por processos químicos e estudou as primeiras medições calorimétricas. Em seu Magnus Opus, Tratado Elementar da Química (1789), Lavoisier construiu os pilares da química contemporânea.[58] Suplente e deputado nos Estados Gerais de 1789, em plena Revolução Francesa, depois foi nomeado membro da comissão incumbida de estabelecer o novo sistema de pesos e medidas, além de ter sido secretário do tesouro. Em 1793, o governo revolucionário decretou a prisão de todos os coletores de impostos, dentre os quais se encontrava Lavoisier. Condenado à morte, foi guilhotinado em Paris, em 8 de maio de 1794.[58] No dia seguinte à sua execução, Joseph-Louis de Lagrange, um importante matemático e contemporâneo de Lavoisier disse: “Não bastará um século para produzir uma cabeça igual à que se fez cair num segundo”.[59] |
Revolução Química
[editar | editar código-fonte]A revolução química , também chamada de primeira revolução química, foi a reformulação moderna da química que culminou na lei da conservação da massa e na teoria da combustão do oxigênio . Durante os séculos XIX e XX, essa transformação foi creditada ao trabalho do químico francês Antoine Lavoisier (o " pai da química moderna "). No entanto, trabalhos recentes sobre a história do início da química moderna consideram que a revolução química consiste em mudanças graduais na teoria e prática química que surgiram ao longo de um período de dois séculos. A chamada revolução científica ocorreu durante os séculos XVI e XVII, enquanto a revolução química ocorreu durante os séculos XVII e XVIII.
450 A.C. - Empédocles afirma que todas as coisas são compostas de quatro elementos primários: terra, ar, fogo e água, pelas quais duas forças ativas e opostas, amor e ódio, afinidade e antipatia, atuam sobre estes combinando e separando em uma variedade infinita de formas. Um século mais tarde, Aristóteles, expandindo as ideias de Empédocles e propôs a ideia de substância como uma combinação de matéria e forma. Ele descreveu a teoria dos cinco elementos (fogo, água, terra, ar e éter) que foi amplamente aceita pelo mundo ocidental por quase mil anos.
440 A.C. - Leucipo e Demócrito propuseram a ideia do átomo, uma partícula invisível e indivisível da qual a matéria seria feita. A ideia é amplamente rejeitada pelos filósofos em detrimento da visão aristotélica.
770 D.C - O alquimista árabe-persa Geber, que é considerado por muitos como o “pai da química", desenvolve um método experimental para a alquimia, e isola vários ácidos incluindo o ácido clorídrico, ácido nítrico, ácido cítrico, ácido acético, ácido tartárico e água régia.
1661 - Robert Boyle publica The Sceptical Chymist, um tratado que faz a distinção entre a química e a alquimia. Contém algumas das primeiras ideias modernas de átomos, moléculas e reação química e marca o início da história da química moderna.
1773-1774 - Carl Wilhelm Scheele e Joseph Priestly, de forma independente, isolam o oxigênio, chamado de "ar deflogisticado" por Priestley e "ar fogo" por Scheele.
1789 - Antoine Lavoisier publica o Traité Élémentaire de Chimie, o primeiro livro-texto de química moderna. Para a época, foi um exame completo da química moderna, incluindo a primeira definição concisa da Lei da conservação da massa. Representa também um marco na fundação da disciplina de estequiometria ou análise química quantitativa.
1805 - O químico e farmacêutico Friedrich Serturner isolou a Morfina do ópio, sendo um marco na medicina e Anestesiologia.
1808 - John Dalton publica New System of Chemical Philosophy, que contém a primeira definição científica moderna da teoria atômica e uma clara descrição da Lei das proporções múltiplas.
1828 - Friedrich Wöhler sintetizou acidentalmente a ureia, assim estabelecendo que compostos orgânicos podem ser produzidos a partir de materiais inorgânicos e refutando a teoria do vitalismo. Estava fundada a Química Orgânica.
1839 - Charles Goodyear usa enxofre e desenvolve a vulcanização da borracha, inaugurando uma nova Era na Indústria Química e revolucionando bens manufaturados.
1848 - Lord Kelvin estabelece o conceito do zero absoluto, a temperatura na qual todo o movimento molecular cessa.
1867 - O químico e engenheiro suíço Alfred Nobel patenteia a dinamite, o primeiro explosivo químico a ser comercializado. Em 1900 é fundada a Fundação Nobel e em 1901 é atribuído o Primeiro Prêmio Nobel de Química.
1869 - Dmitri Mendeleev publica a primeira tabela periódica moderna, com os 66 elementos conhecidos organizados por massa atômica. O diferencial de sua tabela foi a habilidade de prever com precisão as propriedades dos elementos ainda não conhecidos.
1898 - Maria Sklodowska-Curie e Pierre Curie isolam o Rádio e o Polônio do minério pechblenda. Dois anos mais tarde, Ernest Rutherford descobre a fonte da radioatividade como átomos decaindo e cunha vários termos para os variados tipos de radiação.
1907 - Leo Hendrik Baekeland inventa a baquelite, um dos primeiros plásticos com sucesso comercial. Foi inaugurada a Era dos Plásticos.
1913 - Niels Bohr introduz o conceito de mecânica quântica na estrutura atômica ao propor o que atualmente é conhecido como o modelo atômico de Bohr, em que os elétrons só existem em órbitas estritamente definidas.
1918 - No contexto da Primeira Guerra Mundial, o químico alemão Fritz Haber ganhou o Prêmio Nobel de Química por ter sintetizado a amônia a partir de seus elementos constituintes. O prêmio foi entregue sob forte protesto da comunidade científica internacional pelo envolvimento de Haber no uso de armas químicas pela Alemanha.
1938 - Otto Hahn descobre o processo de fissão nuclear em urânio e tório.
1962 - Rachel Carson publica seu livro Primavera Silenciosa denunciando os efeitos malignos do pesticida DDT no meio ambiente e saúde humana, sendo um marco na luta pela preservação do meio ambiente da química ambiental e química verde.
1985 - Harold Kroto, Robert Curl e Richard Smalley descobrem os fulerenos, uma classe de grandes moléculas de carbono que se assemelham superficialmente à cúpula geodésica projetada pelo arquiteto R. Buckminster Fuller.
2003 - Na Rússia, químicos americanos e russos conseguem isolar o Moscóvio, elemento radioativo artificial com meia-vida de apenas 16 milissegundos.
Em 1700 surgiu a necessidade de uma teoria que reunisse as diversas descobertas no campo dos gases. O homem que fez este trabalho foi Antoine Lavoisier, que refutou a teoria do flogisto com sua lei de conservação da massa em 1789. É considerado o pai da química moderna: entre seus méritos estão, além da já citada lei de conservação, o método de trabalho (com atenção à pureza dos reagentes, e o uso de balança de precisão), o trabalho de nomenclatura de binários compostos, a determinação correta da composição do ar , a análise da composição de gorduras, óleos e açúcares, descobrindo a presença constante de hidrogênio , oxigênio e carbono (os "tijolos" básicos de todas as substâncias orgânicas). Além disso, até então a química não tinha um estatuto académico autónomo, mas ainda fazia parte do currículo médico.
O cientista irlandês Robert Boyle é tido por muitos como o iniciador da Química moderna, já que, em meados do século XVII, ele executou experimentos planejados, estabelecendo através deles generalizações. Apesar dos méritos de Boyle, muitos consideram o francês Antoine Laurent-Lavoisier, que viveu no século XVIII, o pai da química, especialmente devido ao seu trabalho sobre o conceito de conservação da massa, sendo este considerado o marco do estabelecimento da química moderna, ocasionando a chamada Revolução Química.[58] Os estudos de Lavoisier foram referência para que fosse proposto por John Dalton, no início do século XIX, o primeiro modelo atômico.[60] A química experimentou grande desenvolvimento teórico e metodológico durante o século XX, especialmente pelo estabelecimento da mecânica quântica, métodos espectroscópicos e metodologias de síntese orgânica, que impulsionaram o descobrimento de novos fármacos, determinação da estrutura química de moléculas, como o ácido desoxirribonucleico e sofisticação das teorias já existentes.
Durante o século XVIII dedicou-se grande atenção à questão da afinidade, nome que se dava para a força que mantinha unidos os compostos químicos: acreditava-se que o grau de afinidade de um dado grupo de elementos podia ser capaz de tomar o lugar de outro num determinado composto.
Em 1808, aceitava-se a ideia de que os compostos possuíam composições fixadas. Uma explicação para tal fato foi proporcionada pela primeira teoria atômica verdadeiramente química, a de John Dalton.[61][62] John Dalton foi um químico inglês que desenvolveu a ideia da teoria atômica dos elementos químicos.[62] A teoria atômica de elementos químicos de Dalton assumiu que cada elemento tinha átomos únicos associados e específicos para aquele átomo.[62] Isso estava em oposição à definição de elementos de Lavoisier, que dizia que os elementos são substâncias que os químicos não podem decompor em partes mais simples.[58][62] A ideia de Dalton também difere da ideia da teoria corpuscular da matéria, que acreditava que todos os átomos eram iguais, e tinha sido uma teoria apoiada desde o século XVII. Para ajudar a apoiar sua ideia, Dalton trabalhou na definição dos pesos relativos dos átomos em produtos químicos em seu trabalho “Novo Sistema de Filosofia Química”, publicado em 1808.[63] Afirmava ele que cada elemento tinha o seu próprio tipo de átomos, cada qual com tamanho e peso característicos.[63] Entrava em cena ideia de peso atômico, embora Dalton não dispusesse de meios necessários para calcular os pesos atômicos ou o número de átomos presentes num composto.[63] Contudo, supunha-se que a composição constante dos compostos fosse devida à combinação de um número constante de átomos.[63] Seu texto mostrava cálculos para determinar os pesos atômicos relativos dos diferentes elementos de Lavoisier com base em dados experimentais pertencentes às quantidades relativas de diferentes elementos em combinações químicas. Dalton argumentou que os elementos se combinaram da forma mais simples possível.[63] A água era conhecida por ser uma combinação de hidrogênio e oxigênio, assim Dalton acreditava que a água era um composto binário contendo um hidrogênio e um oxigênio.[63] Dalton foi capaz de calcular com precisão a quantidade relativa de gases no ar atmosférico.[64] Ele usou a gravidade específica de azótico (nitrogênio), oxigenado, ácido carbônico (dióxido de carbono) e gases hidrogenados, bem como vapor aquoso determinado por Lavoisier e Davy para determinar os pesos proporcionais de cada um como uma porcentagem de um volume total de ar atmosférico.[64]
As limitações impostas à generalização da teoria de Dalton por seus postulados rígidos foram em grande parte removidas pelas investigações de Joseph-Louis Gay-Lussac, segundo o qual quantidades equivalentes de elementos diferentes podem combinar-se entre si, mas não fez distinção entre átomos e moléculas.[65] Em 1811 Amedeo Avogadro propôs para a controvérsia uma solução que obteve o reconhecimento geral depois de transcorridas várias décadas: a unidade de matéria é o átomo, mas a célula básica das reações químicas é a molécula - os agrupamento de átomos que define a natureza dos diferentes compostos -, de maneira que os mesmos átomos podem formar moléculas diferentes em função de diferentes proporções ou estruturas de combinação.[66] Entretanto, o trabalho de Avogadro foi desprezado durante quase meio século.[67]
Entretanto, o sueco Jöns Jacob Berzelius[68] realizava estudos analíticos de minerais e, com base na lei Dulong-Petit, preparava uma tabela de pesos atômicos, de modo geral exatos.[69] Berzelius contribuiu também com a descrição dos fenômenos da catálise e isomeria, com a invenção do moderno sistema de símbolos químicos. Sua principal contribuição teórica foi a teoria dualista ou eletroquímica da combinação atômica, no qual buscou solucionar o velho problema da natureza da afinidade. Acreditava que todos os átomos apresentavam o velho problema da natureza da afinidade.[70] Era consenso que todos os átomos apresentam carga elétrica, tanto positiva como negativa, mas que a positiva predomina em alguns e a negativa em outros. Os átomos de carga negativa mantidos ligados aos de carga positiva mediante forças eletrostáticas.[2]
O florescimento de maior conhecimento do elemento carbono e o nascimento da química orgânica, no decorrer do século XIX, acabaram desmentindo essa teoria dualista.[71] Os químicos passaram então a conjecturar quanto à existência de radicais, isto é, grupos de átomos que atuariam como uma unidade nas reações químicas julgava-se que dois radicais ligados a um átomo de oxigênio (para formar um éter) pertences son ao tipo água, e que très radicais ligados a um átomo de nitrogênio (para formar uma amina) pertencem ao tipo amónia. A polémica quanto ao uso de pesos moleculares, atômicos ou de equivalentes na notação de fórmulas aumentava a confusão criada pelas tentativas de enquadrar todos os compostos orgânicos em alguns poucos tipos rígidos. A teoria tipológica pelo menos sugeria que um átomo individual só é capaz de prender um número limitado de átomos de outros elementos ou radicais. O conceito de "unidades de afinidade" transformou-se gradualmente no moderno conceito de valência, passo importante para a elucidação da natureza dos compostos orgânicos.
Em 1858, August Kekulé e Archibald Scott Couper propuseram a tetravalência do carbono e sua propriedade de unir-se a outros átomos de carbono, formando longas cadeias, o que abriu caminho para o desenvolvimento da teoria estrutural dos compostos orgânicos.[72] Nesse desenvolvimento destacou-se o químico Aleksandr Butlerov.[73] Na década de 1870, Jacobus Henricus van't Hoff e Joseph-Achille Le Bel praticamente inauguraram o campo da estereoquímica, postulando um átomo de carbono tetraédrico.[74]
Em 1860, realizou-se em Karlsruhe, Alemanha, o primeiro congresso químico internacional, numa tentativa de solucionar a confusão dominante na teoria química, especialmente com relação aos pesos químicos.[75] O italiano Stanislao Cannizzaro postulou a hipótese de Avogadro e demonstrou como os átomos e moléculas podiam distinguir-se entre si.[76] A verificação dos verdadeiros pesos atómicos e moleculares possibilitou a complementação de estudos anteriores para classificação das propriedades dos elementos em termos de seus pesos atômicos. Dmitri Mendeleev e Lothar Meyer propuseram versões de tabelas periódicas, e Mendeleev previu a existència e propriedades de très elementos até então desconhecidos[nota 6] . A descoberta posterior desses elementos, de acordo com previsões de Mendeleev, fez com que as leis de periodicidade passassem a ser universalmente aceitas e deu aos químicos uma base sistemática para basear sua ciência.[78]
O Século XX
[editar | editar código-fonte]O desenvolvimento da química ao longo do século XX apoiou-se na confirmação experimental da teoria atômica, em estreita conexão com os avanços da física. Comprovou-se a existência de partículas subatômicas - partículas subatômicas são partículas muito menores que os átomos -, Ernest Rutherford[79] e Niels Bohr[80] elaboraram modelos atómicos, e Max Planck lançou os fundamentos da mecânica quântica.[81][82]
A explosão tecnológica e industrial do século XX, como consequência de avanços científicos acelerados, deu origem ao nascimento das grandes indústrias químicas. A química médica e farmacêutica e a química de polímeros (plásticos, fibras, derivados do petróleo etc.) experimentaram um desenvolvimento espetacular na segunda metade do século, acabando por influenciar diretamente sobre os hábitos sociais, com o lançamento no mercado de consumo de inovadores utensílios fabricados com diversos materiais. Além disso, a universalização da distribuição de medicamentos e outros produtos terapêuticos. Por fim, outros numerosos aspectos da vida cotidiana, como a alimentação, a agricultura e o tratamento de combustíveis ganharam novos enfoques paralelamente às descobertas de uma ciência em contínua evolução.
Princípios Fundamentais
[editar | editar código-fonte]Desde a revolução experimentada pelas ciências químicas no princípio do século XIX, um dos principais objetivos almejados pelos especialistas foi o estabelecimento de postulados metodológicos em grande parte inspirados nos modelos preexistentes da física e da matemática.
Os enunciados modernos da filosofia da ciência argumentam que o progresso científico resulta da confrontação entre dois pontos de vista complementares: as concepções teóricas dos fenômenos, que analisam e sintetizam os dados experimentais e conformam conjuntos de hipóteses destinados a explicar os fatos e prever as situações futuras; e as comprovações empíricas, que julgam a validez e a oportunidade de sua aplicação.[83] São os seguintes os princípios gerais mais comumente aceitos para a abordagem teórica dos sistemas químicos:
(1) Utilidade dos modelos teóricos, entendidos como conjuntos de premissas expressas de forma matemática constituem o núcleo básico de partida para a análise de um problema e seus desdobramentos. O uso de modelos, como o do gás ideal, por exemplo, que sustentou a enunciação de leis dos gases perfeitos durante os séculos XVII e XVIII, assim como os avançados sistemas configurados pelos computadores a partir de extensas enumerações de dados, se fundamentam na restrição das particularidades conhecidas do fenômeno até conseguir uma teoria completa e situações absolutamente previsíveis dentro de seus postulados.[84]
(2) Estrutura atômica, segundo a qual a matéria se compõe fundamentalmente de átomos - a partícula elementar da matéria -, internamente formados de um pequeno núcleo que consiste na aglomeração de partículas elementares positivas (prótons) e neutras (nêutrons) unidas entre si por forças de coesão nuclear, e um conjunto de elétrons ou unidades elementares de carga elétrica negativa distribuídos em distintos níveis de energia e ligados ao núcleo por atração eletromagnética.[2] A união de átomos gera moléculas, e as reações químicas se devem ao intercâmbio de elétrons entre moléculas.[85]
(3) Equilíbrios energéticos de acordo com a mecânica quântica, especialidade científica que postula a existência de regiões do espaço do átomo, chamadas orbitais e distribuídas em níveis, nas quais se organizam seus elétrons em pares ou isoladamente.[86] O movimento de elétrons entre os diferentes níveis de orbitais explica não só os fenômenos energéticos do átomo, expressos sob formulações quânticas de alta complexidade matemática, como também o estabelecimento de ligações químicas.[87]
(4) Validade do conceito de valência química, número inteiro com sinal positivo ou negativo que quantifica a natureza da participação dos átomos de um elemento em sua combinação com outros.[88] Esse conceito, manejado desde a antiguidade, se manteve nas explicações atuais como a quantidade de elétrons que intervém numa reação química por cada classe de elementos participantes, e se complementa adequadamente com a teoria de orbitais atômicos.
(5) Validade da lei de preservação da matéria, segundo o qual em uma reação química nada é criado ou destruído, apenas transformado - seja perdendo ou adquirindo energia - de acordo com os postulados de Lavoisier.[58] Segundo este conceito, em uma equação química, a massa dos produtos deve ser igual a massa dos reagentes.
Tradicionalmente, os princípios da Química se iniciam com o estudo das partículas elementares, átomos, moléculas,[61] substâncias e outros agregados da matéria. Matéria é tudo aquilo que ocupa espaço e possui massa de repouso. É um termo geral para a substância da qual todos os objetos físicos consistem.[89][90] Tipicamente, a matéria inclui átomos e outras partículas que possuem massa. A massa é dita por alguns como sendo a quantidade de matéria em um objeto e volume é a quantidade de espaço ocupado por um objeto, mas esta definição confunde massa com matéria, que não são a mesma coisa.[91] Diferentes campos usam o termo de maneiras diferentes e algumas vezes incompatíveis; não há um único significado científico que seja consenso para a palavra "matéria", apesar do termo "massa" ser bem definido. A matéria pode ser encontrada principalmente nos estados sólido, líquido e gasoso, em forma isolada ou em combinação. Reações químicas[92] e outras transformações como as mudanças de fase envolvem o rearranjo de ligações químicas e outras interações entre as moléculas. Estas transformações envolvem invariavelmente diversos conceitos importantes como energia, equilíbrio químico entre outros.
Espécies químicas
[editar | editar código-fonte]O quark, na física de partículas, é uma partícula elementar e um dos dois constituintes fundamentais da matéria (o outro é o lépton). Quarks se combinam para formar partículas compostas chamadas hádrons das quais as mais estáveis desse tipo são os prótons e os nêutrons, que são os principais componentes dos núcleos atômicos. Devido a um fenômeno conhecido como confinamento de cor, os quarks nunca são diretamente observados ou encontrados de forma isolada; eles podem ser encontrados apenas nos hádrons, como os bárions (categoria a que pertencem os prótons e os nêutrons), e os mésons. Por essa razão, muito do que se sabe sobre os quarks advém da observação dos hádrons.
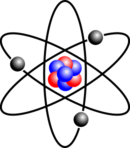
O átomo é a unidade básica de matéria que consiste de um núcleo denso central rodeado por uma nuvem de elétrons de carga negativa. O núcleo atômico contem prótons carregados positivamente e nêutrons eletricamente neutros (exceto o hidrogênio-1, que é o nuclídeo estável sem nêutrons). Os elétrons de um átomo interagem com o núcleo por força eletromagnética, e do mesmo modo, um grupo de átomos permanecem ligados uns aos outros por ligações químicas baseadas nesta mesma força, formando uma molécula. Um átomo que contém o mesmo número de prótons e elétrons é eletricamente neutro, caso contrário é carregado positivamente ou negativamente e é chamado de íon. Um átomo é classificado de acordo com o número de prótons e nêutrons no seu núcleo: o número de prótons determina o elemento químico e o número de nêutrons determina o isótopo do elemento.[nota 7] O modelo atualmente aceito para explicar a estrutura atômica é o modelo da mecânica quântica.[94]
Antiátomos constituem a antimatéria, possuindo cargas elétricas inversas às dos átomos. São compostos por antipartículas denominadas pósitrons, antiprótons e antinêutrons.
Elemento químico é o termo coletivo para todos os tipos de átomos com o mesmo número atômico. Assim, todos os átomos de um elemento químico possuem necessariamente o mesmo número de prótons no núcleo. Um elemento é identificado por um símbolo, uma abreviatura que é na maioria dos casos derivada do nome em latim do elemento [por exemplo, Pb (plumbum), Fe (ferrum). Os elementos estão dispostos na tabela periódica em ordem crescente do número atômico. Um total de 118 elementos são conhecidos até esta data (2018).
Um composto químico é uma substância química pura composta por dois ou mais elementos químicos diferentes.[95][96][97] Os compostos químicos têm uma estrutura química única e definida e consistem em uma razão fixa de átomos, que são mantidos juntos num arranjo espacial definido por ligações químicas. Os átomos de um composto químico podem ser unidos por ligações covalentes, ligações iônicas, ligações metálicas ou por ligações covalentes coordenadas. Os elementos químicos não são considerados compostos químicos, mesmo que consistam em moléculas que contenham múltiplos átomos de um único elemento (como H2, S8, etc.), sendo estas chamadas moléculas diatômicas ou moléculas poliatômicas.[98] A nomenclatura de compostos químicos é uma parte crucial da linguagem química. No início da história, estes eram batizados com o nome de seu descobridor. No entanto hoje, a nomenclatura padrão é definida pela União Internacional de Química Pura e Aplicada (IUPAC). O sistema IUPAC de nomenclatura permite a distinção dos compostos por nomes específicos.
Uma substância química é um tipo de matéria com composição e conjunto de propriedades definidos.[99] Estritamente falando, uma mistura de compostos, elementos e compostos ou elementos não é uma substância química, mas pode ser chamado de produto químico. A maioria das substâncias que encontramos em nossa vida diária são misturas, como por exemplo o ar e a biomassa.

Uma molécula é uma entidade eletricamente neutra formada de dois ou mais átomos unidos por ligações covalentes.[100][101][102][103][104][105] As moléculas são distinguidas dos íons pela ausência de carga elétrica. No entanto, em Física Quântica, Química Orgânica e Bioquímica, o termo molécula é usado frequentemente com menor rigor, sendo aplicado também aos íons poliatômicos. Na teoria cinética dos gases, o termo molécula é frequentemente utilizado para qualquer partícula gasosa, independentemente da sua composição. De acordo com essa definição, átomos de gases nobres são considerados moléculas, apesar do fato de que elas são compostas por um único átomo sem ligação química.[106] Uma molécula pode ser constituída por átomos de um único elemento químico, tal como com o oxigênio gasoso (O2), ou de diferentes elementos, como acontece com a água (H2O). Átomos e complexos ligados por ligações covalentes, como pontes de hidrogênio ou ligações iônicas geralmente não são considerados moléculas individuais.[107]
O íon (português brasileiro) ou ião (português europeu) é uma partícula eletricamente carregada, ou seja, é um átomo ou uma molécula que perdeu ou ganhou elétrons. Um íon é chamado cátion quando perde um ou mais elétrons, que são negativos, ficando carregado positivamente (por exemplo, o cátion sódio: Na+). Por outro lado, os ânions são os íons carregados negativamente, ou seja, ganharam eletróns (por exemplo, ânion cloreto: Cl−). Como exemplos de íons poliatômicas podem ser citados os íon hidróxido (OH−) ou o íon fosfato (PO43−). Os íons no estado gasoso são frequentemente chamados de plasma.
Conceitos envolvidos na transformação da matéria
[editar | editar código-fonte]Acidez e basicidade
Substâncias possuem propriedades ácidas e/ou básicas. Existem diferentes teorias que explicam o comportamento ácido-base. A mais simples é a teoria de Arrhenius, que diz que um ácido é uma substância que produz íons hidrônio, quando dissolvida em água; e uma base é uma substância que produz íons hidroxila, quando dissolvida em água. De acordo com a teoria ácido-base de Brønsted-Lowry, ácidos são substâncias que doam um cátion hidrogênio a outra substância em uma reação química; por extensão, uma base é a substância que recebe estes íons hidrogênio. A terceira teoria é teoria ácido-base de Lewis, o qual é baseado na formação de ligações químicas. A teoria de Lewis explica que um ácido é uma substância que é capaz de aceitar um par de elétrons de uma outra substância durante o processo de formação da ligação química, enquanto que a base é uma substância que cede um par de elétrons para formar uma nova ligação.[108] Existem várias outras maneiras em que uma substância pode ser classificada como um ácido ou de uma base, como é evidente na história deste conceito.[109]
A acidez pode ser mensurada especialmente por dois métodos. Uma delas, com base na definição de Arrhenius de acidez, é o potencial hidrogeniônico (pH). O pH é definido como o logaritmo decimal do inverso da atividade de íons hidrogênio, aH+, em uma solução.[110] Assim, as soluções que têm um baixo pH tem alta concentração de íons hidrônio, e pode-se dizer que são mais ácidas.
Outra maneira, que tem como base a definição de Bronsted-Lowry, é a constante de dissociação de um ácido (Ka), que medem a capacidade relativa de uma substância para agir como um ácido sob a definição de Bronsted-Lowry. Isto é, as substâncias com um Ka maior são mais propensas a doar íons hidrogênio em reações químicas do que aquelas com menores valores de Ka.
Fase

Em ciências físicas, fase é uma região do espaço (um sistema termodinâmico), no qual todas as propriedades físicas são essencialmente uniformes.[111] Exemplos de propriedades físicas incluem a densidade, índice de refração, magnetização e composição química. Uma descrição mais simples é que uma fase é uma região de um material que é quimicamente uniforme, fisicamente distinta e (frequentemente) mecanicamente separáveis. Num sistema composto por gelo e água num frasco de vidro, os cubos de gelo são uma fase, a água é uma segunda fase e o ar úmido sobre a água é uma terceira fase.
A termo fase é usado às vezes como sinônimo de estado da matéria. Além disso, por vezes é utilizado para se referir a um conjunto de estados de equilíbrio demarcados em termos de variáveis de estado, tais como pressão e temperatura por um limite de fase em um diagrama de fases. Como os limites de fase se relacionam às alterações na organização da matéria, tais como a mudança do estado líquido para o estado sólido ou de uma alteração mais sutil de uma estrutura de cristal para o outro, este último uso é semelhante à utilização de fase como sinônimo de estado da matéria. No entanto, o uso dos termos estado da matéria e diagrama de fase não são compatíveis com a definição formal citada acima e o significado pretendido deve ser determinado a partir do contexto em que o termo é utilizado. Diferentes tipos de estados ou fases são considerados com o sólido, líquido e gasoso, o condensado de Bose-Einstein e o plasma, sendo que estes dois últimos são estudados em níveis avançados da física.
Ligação
Uma ligação química ocorre quando uma interação entre os átomos permite a formação de substâncias químicas que contêm dois ou mais átomos. A ligação é provocada por força de atração eletrostática entre as cargas opostas, quer entre elétrons e os núcleos, ou como o resultado de uma atração dipolar. A força das ligações químicas varia consideravelmente em termos energéticos; existem "ligações fortes", como as ligações covalentes ou iônicas e "ligações fracas", tais como interações dipolo-dipolo, a força dispersão de London e ligações de hidrogênio. A muitos compostos, a teoria da ligação de valência, o modelo de repulsão dos pares eletrônicos (VSEPR) e o conceito do número de oxidação são usados para explicar a estrutura molecular e formação das ligações químicas. Outras teorias de ligação, como a teoria do orbital molecular também são muito utilizadas.
Reação
Uma reação química é um processo que leva a transformação de uma substâncias a outra.[112] Classicamente, as reações químicas compreendem alterações que envolvem o movimento dos elétrons na formação e quebra de ligações químicas entre os átomos. A substância (ou substâncias) inicialmente envolvida numa reação química é chamada de reagente. As reações químicas produzem um ou mais produtos, que em geral têm propriedades diferentes das dos reagentes. Reações muitas vezes consistem de uma sequência de subetapas e as descrição exata sobre o curso destas reações ilustram um mecanismo de reação. As reações químicas são descritas com equações químicas que apresentam graficamente os materiais de partida, os produtos finais e os intermediários, por vezes, as condições de reação.
Reações químicas acontecem a uma taxa reacional característica a uma dada concentração e temperatura. Reações que ocorrem rapidamente são descritas como espontâneas, que não exigem o fornecimento de energia extra. As reações não espontâneas ocorrem tão lentamente que exigem a introdução de algum tipo de energia adicional (tal como o calor, luz ou de eletricidade), a fim de se completar ou atingir o equilíbrio químico.
Diferentes reações químicas são combinadas durante a síntese química, de modo a obter um produto desejado. Em bioquímica, uma série de reações químicas formam as vias metabólicas. Essas reações são geralmente mediadas por enzimas. Essas enzimas catalisam muitas reações que não ocorreriam sob condições presentes no interior de uma célula.
O conceito geral de reação química foi estendido para entidades menores do que os átomos, incluindo as reações nucleares, decaimentos radioativos e reações entre partículas elementares, como descrito pela teoria quântica de campos.
Mol
O mol é o nome da unidade de base do Sistema Internacional de Unidades (SI) para a grandeza quantidade de matéria.[113][114] É uma das sete unidades de base do Sistema Internacional de Unidades.[115] O seu uso é comum para simplificar representações de proporções químicas e no cálculo de concentração de substâncias. O Escritório Internacional de Pesos e Medidas define: "Um mol contém exatamente 6,022 140 76 x 1023 entidades elementares".[116]
Redox
Reações redox (redução-oxidação) incluem todas as reações químicas em que átomos têm o seu estado de oxidação alterado por transferência de elétrons, seja pelo ganho (redução) ou perda de elétrons (oxidação). As substâncias que possuem a capacidade de oxidar outras substâncias são chamadas de oxidantes (agentes oxidantes). Do mesmo modo, as substâncias que tem a capacidade de reduzir outras substâncias são ditas redutoras e são conhecidos como agentes redutores. Um redutor transfere elétrons a outra substância, então ele sofre oxidação. A oxidação e redução refletem a alteração no número de oxidação — a transferência efectiva de electrões nunca pode ocorrer. Assim, a oxidação é melhor definida como um aumento no número de oxidação, de redução e como uma diminuição no número de oxidação.
Equilíbrio
Em uma reação química, o equilíbrio químico é o estado em que ambos os reagentes e produtos estão presentes em concentrações e estas não tendem a se alterar com o tempo.[117] Geralmente, este estado resulta quando a reação (produtos para reagentes) prossegue à mesma taxa que a reação inversa (produtos para reagentes). As taxas reacionais de ambas não são iguais a zero, mas sendo iguais, não existem alterações líquidas das concentrações tanto dos reagentes quanto dos produtos. Esse processo é chamado de equilíbrio dinâmico.[118][119]
Energia
No contexto de Química, a energia é um atributo de uma substância como uma consequência da agregação de sua estrutura atômica ou molecular. Uma vez que uma transformação química gera mudanças na estrutura de uma substância, o processo é invariavelmente acompanhado por um aumento ou diminuição de energia nas substâncias envolvidas. Parte da energia é transferida entre o ambiente e os reagentes sob a forma de calor ou de luz; assim, os produtos de uma reação podem ser mais ou menos energéticos do que os reagentes.
A reação é dita ser exergônica a variação da energia livre de Gibbs tem valor negativo, indicando a possibilidade de uma reação espontânea. No caso de endergônicas a situação é inversa. A reação é dito ser exotérmica se liberta calor para o ambiente e as reações exotérmicas absorvem o calor do meio.
As reações químicas são invariavelmente impossível, a menos que os reagentes superem uma barreira de energia conhecida como energia de ativação. A velocidade de uma reação química (em dada temperatura T) está relacionada com a energia de ativação E pelo Fator de Boltzmann, — que expressa a possibilidade de uma molécula ter uma energia maior ou igual a E em dada temperatura T. Esta dependência exponencial da taxa de reação em dada temperatura é conhecida como equação de Arrhenius. A energia de ativação necessária para que uma reação química ocorra pode ser na forma de calor, luz, eletricidade ou força mecânica sob a forma de ultra-som.[120]
O conceito de energia livre, que também incorpora considerações sobre entropia, é um meio muito útil para prever a possibilidade de ocorrência de uma reação química e determinar o estado de equilíbrio de uma reação em termodinâmica química. A reacção só é possível se a mudança total na energia livre de Gibbs negativa, , e, se for igual a zero, a reação química está em equilíbrio.
Existem apenas limitados possíveis estados de energia para elétrons, átomos e moléculas. Estas são determinadas pelas regras da mecânica quântica, que exigem quantização da energia. Os átomos e moléculas em um estado energético estão em estado excitado. Moléculas e átomos que substância neste estado energético são frequentemente muito mais reativos, isto é, mais passíveis de reações químicas.
A fase de uma substância é determinada pela sua energia própria e a energia do ambiente. Quando as forças intermoleculares de uma substância é tal que a energia do ambiente não é suficiente para superá-las, ocorrem então as fases mais ordenada, como líquido e sólido, como é o caso com a água (H2O), um líquido à temperatura ambiente porque as suas moléculas interagem por ligações de hidrogênio.[121] O sulfeto de hidrogênio (H2S) é um gás a temperatura e pressão padrão porque as suas moléculas interagem por interações dipolo-dipolo, que são mais fracas.
A transferência de energia a partir de uma substância química para outra depende do tamanho dos quanta de energia emitidos a partir de uma substância. No entanto, a energia térmica é frequentemente transferida mais facilmente de qualquer substância para outra porque os fônons responsáveis pelos níveis de energia vibracional e rotacional em uma substância têm muito menos energia do que os fótons invocados para a transferência de energia eletrônica. Assim, devido aos níveis de energia vibracional e rotacional serem mais próximos espacialmente mais espaçados do que os níveis eletrônicos de energia, o calor é mais facilmente transferido entre substâncias em relação à luz ou de outras formas de energia eletrônica. Por exemplo, a radiação eletromagnética ultravioleta não é transferida com o máximo de eficiência de uma substância a outra como a energia térmica ou elétrica.
A existência de níveis de energia característicos para as diferentes substâncias químicas é útil para a sua identificação por meio da análise de linhas espectrais. Diferentes tipos de espectros são frequentemente utilizados em espectroscopia, por exemplo, o infravermelho e microondas. A espectroscopia também é utilizada para identificar a composição de objetos remotos — como estrelas e galáxias distantes — analisando os seus espectros de radiação.

Ramos
[editar | editar código-fonte]Química inorgânica
[editar | editar código-fonte]
Química Inorgânica é o campo da química que estuda a estrutura, reatividade e preparação dos compostos inorgânicos e organometálicos. Este domínio abrange todos os compostos químicos, com exceção dos compostos orgânicos, que são temas de estudo da Química Orgânica. A distinção entre as duas disciplinas está longe de ser absoluta e há muita sobreposição, especialmente na disciplina Química Organometálica. A Química Inorgânica tem aplicações em todos os aspectos da indústria química, incluindo catálise, ciência dos materiais, pigmentos, surfactantes, revestimentos, medicamentos, combustíveis e agricultura.[122]
Classificação dos compostos inorgânicos
[editar | editar código-fonte]
Os compostos inorgânicos são classificados em quatro grandes grupos: os sais, os óxidos, os ácidos e as bases. Os sais são constituídos de um cátion e um ânion unidos por uma ligação iônica, como por exemplo o brometo de sódio NaBr, que é constituído de um cátion Na+ e um ânion de brometo Br−. Os sais são caracterizados por um alto ponto de fusão e são maus condutores de eletricidade no estado sólido. Outras características importantes são a solubilidade em água e a facilidade de cristalização. Alguns sais (por exemplo NaCl) são muito solúveis em água e outros (por exemplo BaSO4) não o são.
Um óxido é um composto químico que contém pelo menos um átomo de oxigênio e um outro elemento químico em sua fórmula química. Óxidos de metais contêm tipicamente um ânion de oxigênio no estado de oxidação de -2. A maior parte da crosta terrestre é constituída de óxidos sólidos, resultado de elementos que são oxidados pelo oxigênio no ar ou dissolvido na água. A combustão de hidrocarbonetos produz os dois principais óxidos de carbono: monóxido de carbono e dióxido de carbono.
A teoria de Brønsted-Lowry define como bases como aceitadores de íons de hidrogênio, enquanto a teoria de Lewis define bases como doadores de par de elétrons. A teoria mais antiga é a de Arrhenius, que define bases como espécies que liberam ânion hidróxido quando em solução e é estritamente aplicável aos compostos alcalinos.
A definição para ácidos segue o raciocínio contrário da definição de base. A teoria de Brønsted-Lowry define como ácidos substâncias que doam íons hidrogênio, enquanto a teoria mais geral de Lewis define ácidos como aceitadores de par de elétrons. A teoria de Arrhenius define como ácidos espécies que liberam íons hidrogênio em solução aquosa.
Química de Coordenação
[editar | editar código-fonte]
Os compostos de coordenação tradicionais apresentam metais ligados a pares de elétrons que se encontram nos átomos dos grupos ligantes, tais como H2O, NH3, Cl− e CN−. Em compostos de coordenação modernos quase todos os compostos orgânicos e inorgânicos podem ser utilizados como ligantes. O metal é geralmente um metal dos grupos 3-13, assim como os trans-lantanídeos e trans-actinídeos. A estereoquímica dos complexos de coordenação pode ser muito rica, como sugerido por Alfred Werner após a separação de dois enantiômeros de [Co((OH)2Co(NH3)4)3]6+, uma manifestação precoce de que a quiralidade não é inerente aos compostos orgânicos. Um tema dentro deste tópico é a química supramolecular de coordenação.[123]
Exemplos de compostos de coordenação: [Co(EDTA)]−, [Co(NH3)6]3+, TiCl4(THF)2.
Os principais elementos da tabela periódica estão nos grupos da 1, 2 e 13-18 (excluindo o hidrogênio), mas devido à sua reatividade, os elementos do grupo 3 (Sc, Y, La) e do grupo 12 (Zn, Cd e Hg) são também geralmente incluídos entre os principais.
Principais compostos de grupo
Compostos do grupo principal são conhecidos desde os primórdios da química como o enxofre elementar e o fósforo branco. Experimentos com oxigênio, O2, realizados por Lavoisier e Priestley não só identificou um gás diatômico importante, mas abriu o caminho para descrever compostos e reações de acordo com razões estequiométricas. A descoberta de uma síntese da amônia bastante prática usando catalisadores de ferro por Carl Bosch e Fritz Haber no início de 1900 impactou a humanidade profundamente, demonstrando a importância da síntese inorgânica. Típicos compostos do grupo principal são SiO2, SnCl4, e N2O. Muitos compostos do grupo principal pode também ser classificados como "organometálicos", uma vez que contêm grupos orgânicos, por exemplo, B(CH3)3). Os compostos do grupo principal também ocorrem na natureza, por exemplo, fosfato de DNA e, portanto, podem ser classificados como bioinorgânicos. Por outro lado, os compostos orgânicos que não estão ligados a hidrogênio são classificados como compostos inorgânicos, tais como os fulerenos e os óxidos de carbono.
Os compostos que contêm metais do grupo 4 a 11 são considerados compostos de metais de transição. Alguns compostos de um metal do grupo 3 ou 12 são, por vezes, também incorporadas neste grupo, mas também muitas vezes classificados como compostos do grupo principal. Compostos de metais de transição mostram uma química de coordenação rica, variando de tetraedros de titânio (por exemplo, TiCl4) à geometria quadrado planar de alguns complexos de níquel e complexos de coordenação octaédrica para compostos de cobalto. Uma gama de metais de transição podem ser encontrados em compostos biologicamente importantes, tais como o ferro na hemoglobina.
Exemplos de composto contendo metais de transição: pentacarbonil de ferro e cisplatina.
Química analítica
[editar | editar código-fonte]Química analítica é um ramo da química que visa estudar a composição química de um material ou de uma amostra, usando métodos laboratoriais. É dividida em Química Analítica Quantitativa e Química Analítica Qualitativa. A busca por métodos de análise mais rápidos, seletivos e sensíveis também é um dos objetivos essenciais da Química Analítica. Na prática, é difícil encontrar um método de análise que combinem essas três características e, em geral, qualquer uma delas pode ser suprimida em benefício de outra.
Química Analítica Quantitativa
[editar | editar código-fonte]
Em Química, análise quantitativa é a determinação da abundância relativa ou absoluta (muitas vezes expressa como uma concentração) de uma, várias ou todas as substâncias presentes em uma amostra. Vários métodos foram desenvolvidos para este tipo de análise, dentre elas a análise gravimétrica e a análise volumétrica. A análise gravimétrica descreve um conjunto de métodos para a determinação da quantidade de um analito com base na massa sólida. Um exemplo simples é a determinação da quantidade de sólidos em suspensão em uma amostra de água: um volume conhecido de água é filtrado e os sólidos recolhidos no filtro são então pesados.[124][125] A análise gravimétrica fornece dados precisos sobre a composição de uma amostra e seu tempo de execução pode ser elevado. Já a análise volumétrica, por outro lado, é rápida e os resultados são na maioria dos casos satisfatórios: essas análises consistem basicamente em processos de titulação, também conhecido como titulometria, onde são monitorados os volumes usados nestas etapas. Um reagente, chamado o titulante é preparado como uma solução padrão. Uma concentração conhecida e volume de titulante reage com uma solução de analito ou de titulante, para determinar a concentração. Análise volumétrica pode ser simplesmente uma titulação com base numa reação de neutralização, mas também pode ser uma precipitação ou uma reação de formação de um complexo, bem como a titulação com base em uma reação redox. No entanto, cada método de análise quantitativa tem uma especificação geral, em neutralização, por exemplo, a reação que ocorre é entre um ácido e uma base, a qual produz um sal e água, daí o nome de neutralização. Nas reações de precipitação, a solução padrão é na maioria dos casos de nitrato de prata, que é usada para reagir com os íons presentes na amostra no intuito de formar um precipitado insolúvel. Métodos de precipitação são muitas vezes chamado simplesmente de argentometria. Nos dois outros métodos, a situação é a mesma. A titulação de formação de um complexo é uma reação que ocorre entre os íons de um metal e uma solução padrão que contem na maioria dos casos, o EDTA (ácido etilenodiaminotetra-acético). Em uma titulação redox, a reação é ocorre entre um agente oxidante e um agente redutor.
Química Analítica Qualitativa
[editar | editar código-fonte]
Enquanto a análise quantitativa se preocupa em determinar a quantidade de determinada(s) substância(s) em uma amostra, a análise qualitativa usa diversas metodologias clássicas que visam especificar a composição elementar de compostos inorgânicos. É focada principalmente em detectar íons em uma solução aquosa: então para que materiais sólidos sejam analisados, estes devem preferencialmente serem convertidos em soluções, geralmente por um processo denominado digestão. A solução é então tratada com diversos reagentes para testar a reações características de determinados íons, que podem causar mudança da cor da solução em análise, formação de precipitado ou outras mudanças visíveis.[126] De acordo com as suas propriedades, os cátions são classificados em seis grupos. Cada grupo possui um reagente de comum que pode ser utilizado para separá-los a partir da solução. Para se obter resultados significativos, a separação segue uma sequência específica chamada marcha analítica. Outra importante técnica usada para identificar cátions metálicos é o teste da chama: esse procedimento se baseia no espectro de emissão característico para cada elemento, quando em contato com chama. O teste envolve a introdução da amostra em chama e a observação da cor resultante. As amostras geralmente são manuseadas com um fio de platina previamente limpo com ácido clorídrico para retirar resíduos de analitos anteriores. O teste de chama é baseado no fato de que quando uma certa quantidade de energia é fornecida a um determinado elemento químico (no caso da chama, energia em forma de calor), alguns elétrons da última camada de valência absorvem esta energia passando para um nível de energia mais elevado, produzindo o que chamamos de estado excitado. Quando um desses elétrons excitados retorna ao estado fundamental, ele libera a energia recebida anteriormente em forma de radiação. Cada elemento libera a radiação em um comprimento de onda característico, pois a quantidade de energia necessária para excitar um elétron é única para cada elemento. A radiação liberada por alguns elementos possui comprimento de onda na faixa do espectro visível, ou seja, o olho humano é capaz de enxergá-los através de cores. Assim, é possível identificar a presença de certos elementos devido à cor característica que eles emitem quando aquecidos numa chama.
Físico-química
[editar | editar código-fonte]Físico-química é o estudo das propriedades físicas e químicas da matéria, incluindo fenômenos macroscópicos, atômicos e subatômicos, sob a ótica das leis e conceitos da física. A Físico-Química aplica os princípios, práticas e conceitos da física como movimento, energia, força, tempo, termodinâmica, mecânica quântica, mecânica estatística e dinâmica para explicar fenômenos químicos.
Disciplinas da físico-química
[editar | editar código-fonte]Pode ser subdividida em diversas disciplinas. Dentre estas, podem ser citadas a química quântica (estuda e estrutura da matéria em escala atômico-molecular e a interação da luz eletromagnética com a matéria), a termodinâmica química (estuda em escala macroscópica o ganho e perda de energia em transformações da matéria, bem como a relação com espontaneidade de processos e equilíbrio de sistemas), a cinética química (estuda a velocidade de processos, físicos ou químicos), e a mecânica estatística (estuda a relação entre quantização de energia e propriedades macroscópicas de sistemas e processos através de distribuição estatística). Subdisciplinas como eletroquímica, química de superfícies, termoquímica, e química de sistemas coloidais podem ser enquadradas dentro da termodinâmica, enquanto a espectroscopia dentro da química quântica.

A química quântica é um ramo da físico-química cujo foco principal é a aplicação dos conceitos da mecânica quântica a modelos físicos e experimentais de sistemas químicos. Uma das ferramentas mais usadas nestes estudos é a espectroscopia, por meio do qual a informação sobre a quantização de energia em escala molecular pode ser obtida. Os métodos espectroscópicos mais comuns são a espectroscopia de infravermelho (IV) e de ressonância magnética nuclear (RMN). Os estudos em Química Quântica são bastante teóricos e os trabalhos possuem grande interface com a Química Computacional, visando a calcular as previsões da teoria quântica às espécies poliatômicas. Esses cálculos são realizados em computadores. Com estes meios, os químicos quânticos investigam aspectos envolvidos em reações química como o estado fundamental e excitado de átomos em moléculas e o estado de transição que ocorre durante as reações químicas. Os objetivos principais de Química Quântica incluem o aumento da exatidão dos resultados para pequenos sistemas moleculares e o processamento de moléculas de maiores dimensões, o qual é limitado por um motivo: o tempo de cálculo aumenta quanto maior for o número de átomos de uma molécula.
Outro conjunto de questões importantes giram em torno da espontaneidade das reações químicas e e quais as propriedades de uma mistura de compostos químicos. Esses aspectos são estudados pela Termodinâmica Química, que prevê a possibilidade de uma reação prosseguir, a quantidade de energia que pode ser convertida em trabalho e o estudo de propriedades tais como o coeficiente de dilatação térmica, a variação de taxa de entropia de um gás ou de um líquido.[127] A Termodinâmica clássica está mais preocupada com os sistemas em equilíbrio e as mudanças reversíveis.
A ideia fundamental da cinética química é a existência de um estado de transição de energia elevada quando reagentes são convertidos em produtos, ou seja uma barreira energética.[128] De um modo geral, quanto maior for esta barreira energética, mais lenta será a reação. A segunda ideia fundamental é de que a maioria das reações químicas ocorrem como uma sequência de reações elementares,[129] cada uma com seu próprio estado transição. As questões principais da cinética química incluem como a velocidade de uma reação depende da temperatura e das concentrações dos reagentes e de catalisadores na mistura reacional, bem como a forma como os catalisadores e condições de reação podem ser manipuladas para otimizar a taxa de reação.

A medida de quão rápida uma reação pode ocorrer pode ser especificada com apenas poucas amostragens da concentrações e pelo monitoramento da temperatura, ao invés de medir todas as posições e velocidades de cada molécula em uma mistura. Esse é um caso especial de um outro conceito fundamental em Físico-Química: a Mecânica Estatística.[130] A Mecânica Estatística estuda o comportamento de sistemas com elevado número de entidades constituintes a partir do comportamento destas entidades. Os constituintes podem ser átomos, moléculas, íons, entre outros.
A Eletroquímica é um ramo da Termodinâmica Química que estuda reações químicas que ocorrem em uma solução envolvendo um eletrodo (um metal ou um semicondutor) e um condutor iônico (em geral uma solução eletrolítica), envolvendo trocas de elétrons entre o eletrodo e o eletrólito. Esse campo científico abrange todos os processos químicos que envolvam transferência de elétrons entre substâncias, logo, a transformação de energia química em energia elétrica. Quando tal processo ocorre, produzindo transferência de elétrons, produzindo espontaneamente corrente elétrica quando ligado a um circuito elétrico, ou produzindo diferença de potencial entre dois pólos, é chamado de pilha ou bateria (que muitas vezes é formada de diversas células). Quando tal processo é proporcionado, induzido, pela ação de uma corrente elétrica de uma fonte externa, este processo é denominado de eletrólise.
Química orgânica
[editar | editar código-fonte]A Química Orgânica é uma especialidade dentro da química que envolve o estudo científico da estrutura, propriedades, composição, reações e preparação (por síntese ou por outros meios) de compostos contendo carbono e seus derivados. Estes compostos podem conter átomos outros elementos, incluindo o hidrogênio, nitrogênio, oxigênio, além de halogênios, fósforo, silício e enxofre.[131][132][133] Compostos orgânicos formam a base de toda a vida terrena e são estruturalmente bastante diversificados. A gama de aplicação de compostos orgânicos é enorme, sendo os principais componentes de muitos produtos, como plásticos, medicamentos, produtos petroquímicos, alimentos, materiais explosivos e tintas.
Cromatografia e identificação estrutural
[editar | editar código-fonte]
Os compostos orgânicos naturais ou mesmo produtos sintéticos estão muitas vezes em misturas e uma variedade de técnicas foram desenvolvidas para avaliar a pureza e separar uma substância da outra. As técnicas mais modernas para separação e análise de amostras orgânicas são a cromatografia líquida de alta eficiência e cromatografia gasosa. Os métodos tradicionais de separação incluem a cristalização, destilação, extração com solvente e por cromatografia em coluna. A espectroscopia de ressonância magnética nuclear (RMN) é a técnica mais habitualmente utilizada para a determinação da estrutura de compostos orgânicos e permite a atribuição completa da conectividade dos átomos e mesmo a estereoquímica. Outros métodos bastante usados para a análise de compostos orgânico são a espectrometria de massa e a cristalografia. Técnicas como a análise elementar,a espectroscopia de infravermelho, rotação óptica e a espectroscopia UV/visível fornecem dados complementares, não sendo usadas isoladamente para determinação estrutural.
Propriedades físicas
[editar | editar código-fonte]As propriedades físicas dos compostos orgânicos incluem tanto aspectos quantitativos quanto qualitativos. Informação quantitativas incluem o ponto de fusão, ponto de ebulição e índice de refração. As propriedades qualitativas incluem odor, solubilidade, consistência e cor. Os compostos orgânicos, quando comparados aos inorgânicos, possuem baixo ponto de fusão e ebulição, sendo estes valores correlacionados diretamente à polaridade das moléculas e ao seu peso molecular. Alguns compostos orgânicos, especialmente os simétricos, sublimam, isto é eles evaporam sem passar pelo estágio de fusão. Um exemplo bem conhecido de um composto orgânico sublimável é para-diclorobenzeno. Compostos orgânicos não são geralmente muito estáveis a temperaturas acima de 300 °C, apesar de algumas exceções existirem. Os compostos orgânicos tendem a ser hidrofóbicos, isso é, elas são menos solúveis em água do que em solventes orgânicos. As exceções incluem compostos orgânicos que contêm grupos ionizáveis, bem como álcoois de baixo peso molecular, aminas e ácidos carboxílicos em que ocorrem a ligação de hidrogênio.
Nomenclatura e estrutura
[editar | editar código-fonte]
A nomenclatura destes compostos seguem a sistemática estipulada pelas especificações da IUPAC. Para utilizar a nomenclatura sistemática, deve-se reconhecer a estrutura principal e os substituintes. Nomes não sistemáticos são comuns para moléculas complexas, especialmente para produtos naturais. Assim, a dietilamida do ácido lisérgico ou LSD, desta modo informalmente chamado, é sistematicamente denominado (6aR,9R)-N,N-dietil-7-metil-4,6,6a,7,8,9-hexahidroindolo-[4,3-fg]-quinolina-9-carboxamida. As moléculas orgânicas são descritas por fórmulas estruturais, combinações de desenhos e símbolos químicos. A fórmula de linha é bastante utilizada para representar as molecular orgânicas por ser simples e não ambígua. Neste sistema, os pontos de extremidade e os cruzamentos de cada linha representa um átomo de carbono e os átomos de hidrogênio podem ser notados ou explicitamente assumida para estar presente como implícito no carbono tetravalente.
O conceito de grupos funcionais é central na química orgânica, tanto como um meio para classificar estruturas e como para a previsão de suas propriedades físico-químicas. Um grupo funcional é um módulo molecular, e a reatividade de um determinado grupo funcional, dentro de certos limites, é semelhante em diferentes moléculas. As moléculas são classificadas com base em seus grupos funcionais. Álcoois, por exemplo, possuem sempre a subunidade C-OH. Os hidrocarbonetos alifáticos são subdivididos em três grupos de séries homólogas de acordo com seu estado de saturação: parafinas ou alcanos, não possuem quaisquer ligações duplas ou triplas; olefinas ou alcenos, contêm uma ou mais ligações duplas e os alcinos têm uma ou mais ligações triplas. As outras moléculas são classificadas de acordo com os grupos funcionais presentes: álcool, ácido carboxílico, éter, éster, aminas, amida entre outros. Compostos saturados e insaturados existem também como estruturas cíclicas. Os anéis mais estáveis contêm cinco ou seis átomos de carbono. Outra importante classe de compostos orgânicos são os aromáticos: o benzeno é a substância mais conhecida, simples e estável. Estes hidrocarbonetos aromáticos contém diversas ligações duplas conjugadas e que obedecem ao modelo postulado por Kekulé. Outra importante propriedade do carbono é que formam cadeias, ou redes, que são ligados por ligações carbono-carbono. Esse processo de ligação é chamado de polimerização, ao passo que as cadeias ou redes, são chamadas polímeros. O composto de origem é chamado um monómero. Dois grupos principais de polímeros existem: polímeros sintéticos e biopolímeros. Os polímeros sintéticos são artificialmente produzido e são comumente referidos como polímeros industriais.[134]
Reações na química orgânica
[editar | editar código-fonte]Reações orgânicas são reações químicas envolvendo compostos orgânicos. A teoria geral dessas reações envolve conceitos de afinidade eletrônica do átomo-chave, impedimento estérico, ácido-base e intermediários reativos. Os tipos de reação básicos são: reações de adição, reações de eliminação, reações de substituição, reações pericíclicas, reações de rearranjo e reações redox. Cada reação possui um mecanismo de reação passo a passo que explica como acontece a sequência reacional, embora a descrição detalhada de alguns passos nem sempre é clara a partir de uma lista de reagentes isolados. O curso passo a passo de qualquer mecanismo de reação pode ser representado usando setas curvas, que indicam a movimentação de elétrons entre os reagentes, intermediários e produtos finais.

A Química Orgânica aplicada é chamada de Química Orgânica sintética. A síntese de um novo composto é normalmente uma tarefa de resolução de problemas. Os compostos são sintetizados seguindo uma rota sintética, onde a molécula ganha forma depois de várias etapas de conexão de moléculas menores. A prática de criar novas vias sintéticas para moléculas complexas é chamada de síntese total. Devido a complexidade e a utilização de reagente muitas vezes caros, é necessário um adequado planeamento de cada etapa reacional, sempre visando o máximo rendimento possível.
Bioquímica
[editar | editar código-fonte]Bioquímica é a ciência que estuda os processos químicos que ocorrem nos organismos vivos. De maneira geral, ela consiste do estudo da estrutura e função metabólica de componentes celulares e virais, como proteínas, enzimas, carboidratos, lipídios, ácidos nucléicos entre outros.[135][136][137]
Bioquímica estrutural
[editar | editar código-fonte] |
 |
Esse ramo da bioquímica preocupa-se em estudar os aspectos estruturais das biomoléculas. As quatro principais classes de biomoléculas são os carboidratos, os lípidos, as proteínas e os ácidos nucleicos. Muitas moléculas biológicas são polímeros: neste terminologia, os monômeros são micromoléculas relativamente pequenas que estão ligadas em conjunto para gerar estas grandes macromoléculas. Diferentes macromoléculas podem reunir-se em complexos maiores, muitas vezes necessários para a atividade biológica. Os carboidratos, por exemplo, são constituídos de diversos monômeros chamados monossacarídeos. Alguns destes monossacáridos incluem a glicose (C6H12O6), a frutose (C6H12O6) e a desoxirribose (C5H10O4). Os lipídeos são biossintetizados a partir de uma molécula de glicerol combinado com outras moléculas. Os triglicerídeos, a principal classe de lipídeos, são constituídos por uma molécula de glicerol e três moléculas de ácidos graxos. Os ácidos graxos, também considerados monômeros, podem ser saturados ou insaturados. As proteínas são biomoléculas muito grandes — macro-biopolímeros — sintetizadas a partir de monômeros chamados aminoácidos. Existem 20 aminoácidos essenciais, cada um contendo um grupo carboxilo, um grupo amino e uma cadeia lateral, chamada de grupo "R". O grupo "R" varia entre os aminoácidos, o que faz com que cada um destes aminoácido seja diferente um do outro. Estas diferenças e as propriedades destas cadeias laterais influenciam imensamente a conformação tridimensional de uma proteína. Quando os aminoácidos se combinam, formam uma ligação especial chamada ligação peptídica. Estas são reações de desidratação e os produtos podem ser um peptídeo ou uma proteína. Por fim, os ácidos nucleicos são as biomoléculas envolvidas no armazenamento, transferência e tradução da informação genética: o DNA e os RNAs. Estes ácidos nucleicos possuem elevada massa molecular, e contêm em sua estrutura molecular ácido fosfórico, pentoses (monossacarídeo) e bases purínicas e pirimidínicas. São portanto macromoléculas formadas por nucleotídeos.[138] Os nucleotideos são a adenina, citosina, guanina, timina e uracila, sendo que timina é presente somente no DNA e a uracila somente no RNA. A adenina liga-se com a timina e a uracila; a guanina e citosina pode ligar apenas uma com a outra.
Bioquímica metabólica
[editar | editar código-fonte]A bioquímica metabólica estuda os processos de anabolismo e catabolismo de biomoléculas, as vias metabólicas e os processos energéticos envolvidos nestas reações químicas. Os carboidratos têm como uma de suas funções o armazenamento de energia. A glicose, dentre as biomoléculas, possui papel central como fonte de energia para a maioria das formas de vida. Os polissacarídeos de reserva são decompostos em seus monómeros: em animais, o glicogênio é degradado enzimaticamente em resíduos de glicose). A glicose é metabolizada principalmente por uma via muito importante de 10 etapas chamada glicólise ou via glicolítica. O resultado líquido desta sequencia de reações para quebrar uma molécula de glicose em duas moléculas de piruvato, é a produção de duas moléculas de ATP (adenosina trifosfato), a fonte de energia das células, juntamente com dois equivalentes reduzidos sob a forma de NADH. Energia também pode ser obtida por meio de processos anaeróbicos, quando as células não contam com a presença de oxigênio suficiente. Estes processos são denominados fermentação. Outras vias importantes são as de biossíntese e degradação de lipídeos. A síntese de ácidos graxos envolve moléculas de acetil-CoA e subsequentemente a esterificação para a produção de triglicerídeos, em um processo chamado de lipogênese.[139] Os ácidos graxos são sintetizados pela ação da enzima ácido graxo sintase, que polimerizam e reduzem as unidades acetil-CoA. As cadeias acílicas são estendidos por um ciclo de reações que adicionam o grupo acetila, reduzem-na a um álcool e desidratam-lo a um grupo alceno e depois reduzi-la novamente a um grupo alcano. Os ácidos graxos podem ser subsequentemente convertidos em triglicerídeos, que serão armazenados no fígado e no tecido adiposo. Já a degradação de lipídeos é realizada pelo processo de betaoxidação e ocorre nas mitocôndrias e/ou em peroxissomos para gerar acetil-CoA. Para a maior parte, os ácidos graxos são oxidados por um mecanismo que é similar, mas não idêntico, a reação inversa de síntese de ácidos graxos. Ou seja, dois fragmentos de carbono são removidos sequencialmente da extremidade do ácido, após as etapas de desidrogenação, hidratação e oxidação, para formar um cetoácido, que será então fragmentado em uma reação de tiólise. A acetil-CoA é então convertido em ATP, em última análise, CO2, H2O, utilizando o ciclo do ácido cítrico e a cadeia transportadora de elétrons. É interessante notar que por este fato, o Ciclo de Krebs pode começar em acetil-CoA, quando a gordura está sendo usado como fonte de energia quando há pouca ou nenhuma disponível. O rendimento energético da oxidação completa de uma molécula de ácido palmítico, por exemplo, é de 106 moléculas de ATP.[140] Ácidos graxos insaturados e com número ímpar de átomos de carbono requerem passos adicionais para a degradação enzimática.

Sonoquímica
[editar | editar código-fonte]Sonoquímica é o ramo da química que estuda o uso de ondas sonoras de alta frequência (ultrassons) para a promoção de reações químicas.[141] A cavitação acústica gerada por métodos sonoquímicos[142] possibilita a produção de compostos como TiO2 (dióxido de titânio),[143] H2O2 (peróxido de hidrogênio), radicais livres e outros.[141]
Química e sociedade
[editar | editar código-fonte]
A aplicação da Química aos processos industriais e o desenvolvimento de novos produtos trouxe, sem dúvida, inestimáveis benefícios a toda a humanidade. O descobrimento de medicamentos — como exemplo a penicilina[144] e o taxol — provenientes de fontes naturais e a possibilidade de obter substâncias sintéticas em laboratório — como a dipirona e o omeprazol — proporcionou alívio e a cura de diversas doenças. Consequentemente, a expectativa de vida população aumentou. Além de medicamentos, a pesquisa na área química gerou o desenvolvimento de novos combustíveis, materiais como o polietileno e o náilon, produtos cosméticos e de higiene pessoal, alimentos, petroquímicos, tintas e vernizes entre outros[145][146]
Acompanhando o desenvolvimento dos processos químicos industriais, problemas gerados pelo descarte inadequando de substâncias e produtos químicos acarretaram novos problemas, como a poluição ambiental. Diante dessas consequências indesejáveis, coube aos profissionais químicos não somente o desenvolvimento novos produtos e processos químicos eficientes, mas planejar que estes não fossem poluentes, evitando os danos causados por algumas substâncias químicas. Propostas e ações de remediação ambiental, visando a correção de áreas afetadas bem como o aproveitamento racional dos recursos naturais são preocupações inerentes a estes profissionais. A profissão de químico é regulamentada e a ele são atribuídos o magistério, a atuação em ambientes industriais e de pesquisa. A gama de atividades ainda envolvem o projeto, planejamento e controle de produção; desenvolvimento de produtos; operações e controle de processos químicos; saneamento básico; química forense; tratamento de resíduos industriais; segurança; gestão de meio ambiente e, em alguns casos específicos, vendas, assistência técnica, planejamento industrial e direção de empresas.[147] O primeiro laboratório para ensino de Química em Portugal foi o Laboratório Chimico instalado na Universidade de Coimbra. Foi edificado em 1772 a mando do Marquês de Pombal e hoje abriga o Museu da Ciência da Universidade de Coimbra.[148]
No Brasil, a Química se tornou uma disciplina em uma série de instituições após a chegada da corte portuguesa ao país em 1808. A primeira dessas disciplinas foi ministradas em cursos existentes na Real Academia Militar, fundada em 1810 no Rio de Janeiro pelo príncipe regente João VI de Portugal. Devido à falta de pessoal local para o cargo de professor de Química, o químico britânico Daniel Gardner foi contratado para exercer essa função. Ele ocupou a cadeira até a sua aposentadoria, em 1825.[149]

Os cursos de Química são generalistas — privilegiando a Química Orgânica, Química Inorgânica, Química Analítica, Físico-Química e Bioquímica -, com aulas teóricas e experimentais. A primeira metade do curso contempla também disciplinas como Cálculo Diferencial e Integral e Física, fundamentais para aprofundamento em determinados assuntos. Muitos faculdades permitem a escolha de opções no decorrer da graduação: formação de professores de Química (com disciplinas pedagógicas e estágio em estabelecimentos de ensino); Química Básica (para os alunos que possuem interesse em pesquisa básica e/ou desejam seguir os estudos na pós-graduação e a Química Industrial (o aluno cursa um rol de disciplinas que permitem uma visão sobre operações industriais, além do estágio em indústrias). Outras faculdades oferecem a habilitação já na matrícula, como Química Industrial, Tecnológica, Ambiental, de Alimentos, Petróleo ou Têxtil.[150] Dentre as importantes sociedades científicas nas comunidades lusófonas, podem ser citadas a Sociedade Brasileira de Química[151] e a Sociedade Portuguesa de Química.[152] Essas instituições são destinadas a cuidar de assuntos de mérito da Química, em seus aspectos científicos, epistemológicos, metodológicos e pragmáticos. Essas sociedades são abertas a participação de profissionais em Química e áreas afins e atuam no desenvolvimento e consolidação da comunidade, na divulgação da Química e de suas relações, aplicações e consequências para o desenvolvimento do país e para a melhoria da qualidade de vida dos cidadãos.

Diversas competições científicas, nacionais e internacionais, foram criadas para estimular o interesse pela química no meio estudantil. Desde 1986, o Brasil promove a Olimpíada Brasileira de Química. A primeira Olimpíada Iberoamericana de Química foi realizada no ano de 1995, em Mendoza (Argentina). Em 1968, a cidade de Praga, na então República Tcheca, sediou a primeira Olimpíada Internacional de Química.
O ano de 2011 foi considerado o Ano Internacional da Química, em resultado da reunião da Assembleia Geral das Nações Unidas (AGNU), que decorreu em 31 de julho a 6 de agosto de 2009, em Glasgow, na Escócia. A agenda de comemorações foi organizada pela União Internacional de Química Pura e Aplicada (IUPAC) e pela Organização das Nações Unidas para a Educação, a Ciência e a Cultura (UNESCO). O objetivo do Ano Internacional da Química foi celebrar as contribuições da química para o bem-estar da humanidade, com ênfase à importância da química para os recursos naturais sustentáveis. Em 2011 também foi comemorado o centenário da primeira vez que o Prêmio Nobel de Química foi entregue a uma mulher, Marie Curie, por suas pesquisas com radioisótopos. Foi a primeira vez também que uma mulher ganhava uma das cinco modalidades do prêmio. Este fato motivou diversas celebração pela contribuição das mulheres à ciência durante a Ano da Química.
O Prêmio Nobel é atribuído anualmente pela Academia Real das Ciências da Suécia a diversos cientistas de diferentes campos, entre eles a química. A premiação foi criada a partir do desejo de Alfred Nobel de galardoar personalidades que contribuíssem para o bem-estar da humanidade. Este prêmio é administrado pela Fundação Nobel, adjudicado por um comité constituído por cinco membros eleitos pela Academia Real das Ciências da Suécia. O primeiro Nobel de Química foi atribuído em 1901 a Jacobus Henricus van' t Hoff, dos Países Baixos, por sua descoberta das leis da dinâmica da Química e pressão osmótica em soluções.[153]
Profissionais da Química
[editar | editar código-fonte]
No Brasil, atualmente são considerados profissionais afins da ciências químicas, com registro nos Conselhos Federais e Regionais de Química:
- Engenharia Química e semelhantes (Engenharia de alimentos, por exemplo);
- Bacharel em Química;
- Bacharel em Química Industrial ou Química tecnológica;
- Bacharel em Bioquímica;
- Licenciado em Química;
- Técnicos em modalidades da química;
- Tecnólogos em modalidades da química, tais como Processos Químicos.[154]
Ver também
[editar | editar código-fonte]- Alquimia
- Ano Internacional da Química
- Associações de Química
- Chemical Abstracts
- Engenharia Química
- Indústrias químicas
- Instituições de Química
- Nobel de Química
- Periódicos de química
- Tabela periódica
Notas
- ↑ De acordo com o Oxford English Dictionary , al-kīmiyāʾ pode ser derivado do grego "χημία" , que é derivado do antigo nome egípcio do Egito, khem ou khm , khame , ou khmi , que significa "escuridão", ou seja, o rico solo escuro do Vale do rio Nilo. Portanto, a alquimia pode ser vista como a “arte egípcia” ou a “arte negra”. No entanto, também é possível que al-kīmiyāʾ tenha derivado de χημεία , que significa "fundido junto".[10]
- ↑ No inglês dos séculos 16, 17 e início do século 18, as grafias - tanto com quanto sem o "al" - eram geralmente com um “i” ou “y” como em chimic / chymic / alchimic / alchymic . Durante o final do século 18, a ortografia foi reformulada para usar uma letra "e" , como em chemic em inglês. Em inglês, depois que a ortografia mudou de "quimical" para químico , houve uma mudança correspondente de "alquemico" para "alquímico" , o que ocorreu no início do século XIX. Em francês, italiano, espanhol e russo hoje continua a ser escrito com um “i” como, por exemplo, italiano “química”.[10]
- ↑ Ocre é um pigmento natural de terra argilosa , uma mistura de óxido férrico e várias quantidades de argila e areia. Na África, as evidências do processamento e uso de pigmentos ocres vermelhos foram datadas por arqueólogos em cerca de 300.000 anos atrás, o clímax da prática coincidindo amplamente com o surgimento do Homo sapiens.[21][22]
- ↑ Por volta de 500 aC, o mercúrio era usado para fazer amálgamas (latim medieval amálgama , "liga de mercúrio") com outros metais. Também foi objeto de atenção de alquimistas chineses por suas supostas propriedades de conceder a imortalidade, mas os experimentos tiveram resultados fatais por envenenamento agudo.[30] Dentre as vitimas estava Qin Shihuang,o primeiro imperador da China que, segundo a lenda, morreu após tomar uma poção que acreditava o tornaria imortal, mas continha altas concentrações de mercúrio.[31]
- ↑ O alquimista descobrindo o fósforo ou ainda O alquimista, em busca da pedra filosofal, descobre o fósforo e reza pela conclusão bem-sucedida de sua operação, como era o costume dos Antigos Astrólogos Químicos é uma pintura de Joseph Wright of Derby originalmente concluída em 1771 e retrabalhada em 1795. Desde sua exibição em 1771, a imagem provocou muitas interpretações contraditórias. Seu mistério obviamente perturbou os espectadores do século 18 e, embora Wright fosse um artista reconhecido internacionalmente, a pintura não foi vendida quando ele a exibiu pela primeira vez.[38]
- ↑ Pouco depois da publicação da Tabela Periódica de Dmitri Mendeleev, os elementos químicos germânio, gálio e escândio foram descobertos e preencheram alguns dos espaços vazios da tabela e apresentavam propriedades previstas pelo químico russo.[77]
- ↑ Um átomo é a menor unidade que representa um elemento químico, sozinho ou em combinação com outros átomos do mesmo ou de outros elementos[93]
Referências
- ↑ «Chemistry Definition & Meaning». Britannica Dictionary (em inglês). Consultado em 9 de abril de 2023
- ↑ a b c «Atom Definition & Meaning». Britannica Dictionary (em inglês). Consultado em 9 de abril de 2023
- ↑ «Molecule Definition & Meaning». Britannica Dictionary (em inglês). Consultado em 9 de abril de 2023
- ↑ Theodore L. Brown and H. Eugene LeMay Chemistry: The Central Science. Prentice Hall, 1977. ISBN 0-13-128769-9.
- ↑ Malin, John M. «International Year of Chemistry - 2011: Chemistry – our life, our future» [Ano Internacional da Química - 2011: Química – nossa vida, nosso futuro] (PDF) (em inglês). Consultado em 13 de outubro de 2023. Arquivado do original (PDF) em 23 de março de 2012
- ↑ «Robert Boyle, o primeiro químico moderno». www.nationalgeographic.pt. 28 de fevereiro de 2022. Consultado em 28 de agosto de 2023
- ↑ Enciclopedia Barsa. Rio de Janeiro. Enciclopédia Britânica do Brasil Publicações LTDA. Vol. XII - 14 Vol
- ↑ Outras definições incluem:
- Segundo o dicionário Oxford, química é "a ciência que trata das substâncias, sua composição, propriedades e reações";
- De acordo com a Enciclopédia Britânica, a química é "o ramo da ciência que lida com as propriedades e comportamento da matéria e as transformações que ela sofre";
- Já o dicionário Merriam-Webster define química como "uma ciência que trata da composição, estrutura e propriedades da matéria, das mudanças que ela sofre durante as reações químicas e das leis que regem essas mudanças":
- A Enciclopédia da Ciência define a química como "a ciência que estuda as substâncias, sua composição e propriedades, bem como as reações químicas e suas aplicações".
- Por fim, o dicionário Priberam define química como "a ciência que estuda a natureza, composição e propriedades das substâncias, bem como as suas transformações e aplicações".
- ↑ a b «History of Alchemy from Ancient Egypt to Modern Times». AlchemyLab.com (em inglês). Consultado em 10 de abril de 2023
- ↑ a b c d e f g h i j k «Chemistry_(etymology)». www.chemeurope.com (em inglês). Consultado em 10 de abril de 2023
- ↑ p. 854, "Arabic alchemy", Georges C. Anawati, pp. 853-885 in Encyclopedia of the history of Arabic science, eds. Roshdi Rashed and Régis Morelon, London: Routledge, 1996, vol. 3, ISBN 0-415-12412-3.
- ↑ a b c «alchemy | Etymology, origin and meaning of alchemy by etymonline». www.etymonline.com (em inglês). Consultado em 10 de abril de 2023
- ↑ "alchemy", entry in The Oxford English Dictionary, J. A. Simpson and E. S. C. Weiner, vol. 1, 2nd ed., 1989, ISBN 0-19-861213-3.
- ↑ a b c d e «Alchemy». 1911 Encyclopædia Britannica. Consultado em 10 de abril de 2023
- ↑ «Alquimia». Michaelis On-Line. Consultado em 10 de abril de 2023
- ↑ «Origem da palavra QUíMICA - Etimologia». Dicionário Etimológico. Consultado em 10 de abril de 2023
- ↑ Weekley, Ernest (1967). Etymological Dictionary of Modern English. New York: Dover Publications. ISBN 0-486-21873-2
- ↑ Oxford English Dictionary Online , sv alquimia
- ↑ James A. H. Murray (1893). A New English Dictionary on Historical Principles: Founded Mainly on the Materials Collected by the Philological Society. Kragen Sitaker. [S.l.]: Clarendon Press at Oxford
- ↑ "Foi o famoso mineralogista e humanista Georg Agricola quem primeiro abandonou o artigo definido árabe e começou, em suas obras latinas a partir de 1530, a escrever "chymia" e "chymista" em vez dos anteriores "alchymia" e "alchymista". Como humanista, Agricola pretendia purificar as palavras e devolvê-las às suas raízes clássicas. Ele não tinha intenção de fazer uma distinção entre uma ciência racional e prática de "quimia" e a "alquimia" oculta, pois usou a primeira dessas palavras para aplicar a ambos os tipos de atividades. A distinção denotacional moderna surgiu apenas no início do século XVIII." «Chemistry (etymology)». chemeurope.com
- ↑ Henshilwood, Christopher S.; d’Errico, Francesco; van Niekerk, Karen L.; Coquinot, Yvan; Jacobs, Zenobia; Lauritzen, Stein-Erik; Menu, Michel; García-Moreno, Renata (14 de outubro de 2011). «A 100,000-Year-Old Ochre-Processing Workshop at Blombos Cave, South Africa». Science (em inglês) (6053): 219–222. ISSN 0036-8075. doi:10.1126/science.1211535. Consultado em 10 de abril de 2023
- ↑ a b Corbyn, Zoë (13 de outubro de 2011). «African cave's ancient ochre lab». Nature (em inglês). ISSN 1476-4687. doi:10.1038/news.2011.590. Consultado em 10 de abril de 2023
- ↑ Ver:
- «O homem e o fogo». Invivo. Consultado em 10 de abril de 2023
- «Fire | combustion | Britannica». www.britannica.com (em inglês). Consultado em 10 de abril de 2023
- «Wayback Machine» (PDF). web.archive.org. 17 de outubro de 2015. Consultado em 10 de abril de 2023
- Gowlett, J. A. J. (5 de junho de 2016). «The discovery of fire by humans: a long and convoluted process». Philosophical Transactions of the Royal Society B: Biological Sciences (em inglês) (1696). 20150164 páginas. ISSN 0962-8436. PMC PMC4874402
 Verifique
Verifique |pmc=(ajuda). PMID 27216521. doi:10.1098/rstb.2015.0164. Consultado em 10 de abril de 2023 - News, A. B. C. «Were Early Humans Cooking Their Food a Million Years Ago?». ABC News (em inglês). Consultado em 10 de abril de 2023
- ↑ Gibbons, Ann (7 de junho de 2017). «World's oldest Homo sapiens fossils found in Morocco». Science. ISSN 0036-8075. doi:10.1126/science.aan6934. Consultado em 10 de abril de 2023
- ↑ Ehrenreich, Barbara (12 de dezembro de 2019). «'Humans were not centre stage': how ancient cave art puts us in our place». The Guardian (em inglês). ISSN 0261-3077. Consultado em 10 de abril de 2023
- ↑ Muhly, J. D. (1973). «Tin Trade Routes of the Bronze Age: New evidence and new techniques aid in the study of metal sources of the ancient world». American Scientist (4): 404–413. ISSN 0003-0996. Consultado em 10 de abril de 2023
- ↑ Karin Sowada and Peter Grave. Egypt in the Eastern Mediterranean during the Old Kingdom.
- ↑ «Alquimia: a ciência e a magia na Idade Média». Super. Consultado em 11 de abril de 2023
- ↑ Alfonso-Goldfarb, Ana Maria; Ferraz, Márcia H. M. (2011). «A passagem da alquimia à química: uma história lenta e sem rufar de tambores». ComCiência (130): 0–0. ISSN 1519-7654. Consultado em 11 de abril de 2023
- ↑ «Alquimia - História da Química». Só Química - Portal de Química. Consultado em 10 de abril de 2023
- ↑ «Como fracasso na busca de imperador chinês por 'elixir da vida' deu origem ao Exército de Terracota». BBC News Brasil. Consultado em 10 de abril de 2023
- ↑ "(denominamos essa ciência "metafísica" e Aristóteles a estuda em sua "Metafísica". Mas ele nunca usa o termo "metafísica", tendo o ´titulo "Metafísica" o sentido literal de 'aquilo que vem depois da física ou ciência natural. Aristóteles (em inglês). [S.l.]: Edicoes Loyola. p. 47. ISBN 978-85-15-02214-4
- ↑ «IntraText Digital Library: Author Card: Titus Lucretius Carus». www.intratext.com. Consultado em 11 de abril de 2023
- ↑ Porto, C. M. (dezembro de 2013). «O atomismo grego e a formação do pensamento físico moderno». Revista Brasileira de Ensino de Física: 1–11. ISSN 1806-1117. doi:10.1590/S1806-11172013000400016. Consultado em 11 de abril de 2023
- ↑ Rede, Netmundi org-Filosofia na (17 de agosto de 2020). «Empédocles e a teoria dos quatro elementos». netmundi.org. Consultado em 11 de abril de 2023
- ↑ AQUINO, Jefferson Alves de (2019). «Espinosa e Epicuro: imanência e felicidade». Revista Conatus -. Filosofia de Spinoza. 11 (21). Consultado em 11 de abril de 2023
- ↑ Weeks, Mary Elvira (janeiro de 1932). «The discovery of the elements. II. Elements known to the alchemists». Journal of Chemical Education (em inglês) (1). 11 páginas. ISSN 0021-9584. doi:10.1021/ed009p11. Consultado em 10 de abril de 2023
- ↑ Vertesi, Janet (10 de abril de 2010). «Light and Enlightenment in Joseph Wright of Derby's The Alchymist». web.archive.org. Consultado em 12 de abril de 2023. Cópia arquivada em 4 de outubro de 2012
- ↑ Schmundt, Hilmar (21 de abril de 2010). «Essential Element Becoming Scarce: Experts Warn of Impending Phosphorus Crisis». Der Spiegel (em inglês). ISSN 2195-1349. Consultado em 10 de abril de 2023
- ↑ Quimica, Grupo de Pesquisa em Educacao (2002). Interações e Transformações: Professor - A Química e a Sobrevivência - Atmosfera/Fonte de Materiais Vol. 3. [S.l.]: EdUSP
- ↑ «British Library». www.bl.uk. Consultado em 11 de abril de 2023
- ↑ «Freemasonry and Catholicism, by Max Heindel, Part I through VI». www.rosicrucian.com. Consultado em 11 de abril de 2023
- ↑ «The Stone of the Philosophers by Edward Kelly». www.levity.com. Consultado em 11 de abril de 2023
- ↑ a b «Philosopher's stone | History & Facts | Britannica». www.britannica.com (em inglês). Consultado em 11 de abril de 2023
- ↑ a b Norris, John A. (1 de março de 2006). «The Mineral Exhalation Theory of Metallogenesis in Pre-Modern Mineral Science». Ambix (1): 43–65. ISSN 0002-6980. doi:10.1179/174582306X93183. Consultado em 11 de abril de 2023
- ↑ «History Of Science And Technology In Islam». www.history-science-technology.com. Consultado em 11 de abril de 2023
- ↑ «Abū Mūsā Jābir ibn Ḥayyān | Muslim alchemist | Britannica». www.britannica.com (em inglês). Consultado em 11 de abril de 2023
- ↑ «alcohol | Search Online Etymology Dictionary». www.etymonline.com. Consultado em 11 de abril de 2023
- ↑ Chambers's encyclopaedia: a dictionary of universal knowledge, Volume 1. J.B. Lippincott & Co. 1888. p. 148.
- ↑ «Oxford Languages | The Home of Language Data». languages.oup.com (em inglês). Consultado em 11 de abril de 2023
- ↑ Capezzone, Leonardo (1997). «ǦĀBIR IBN ḤAYYĀN NELLA CITTÀ CORTESE: Materiali eterodossi per una storia del pensiero della scienza nell'Islam medievale». Rivista degli studi orientali (1/4): 99–146. ISSN 0392-4866. Consultado em 11 de abril de 2023
- ↑ Tara E. Nummedal. Alchemy and authority in the Holy Roman Empire. p.171
- ↑ a b c Brock, William H. (1992). The Fontana history of chemistry. Internet Archive. [S.l.]: London : Fontana Press
- ↑ Spondent quas non exhibent (às vezes referido como Spondent pariter) foi um decreto papal promulgado em 1317 pelo Papa João XXII proibindo a prática da alquimia. A justificativa fornecida para a proibição no decreto não é especificamente teológica, mas sim uma condenação moral, com o Papa expondo como os alquimistas fraudulentos exploravam os pobres e acusando-os de se envolverem conscientemente na falsidade. Chamando-o de "O Crime de Falsificação", o Papa especificou que qualquer pessoa que produzisse, ordenasse com sucesso a produção, ajudasse na produção ou vendesse conscientemente metais alquímicos falsos na tentativa de saldar dívidas deveria ser condenada a pagar uma multa ; a multa deveria ser calculada pesando-se o metal alquímico e cobrando-se quanto custaria o peso de prata ou ouro verdadeiro. Aqueles que passaram a usar metais alquímicos para a forja de moedas também foram condenados, mas a punição mais severa foi reservada aos clérigos , que se considerados culpados, seriam submetidos à perda de todos os seus benefícios clericais e negados a chance de recuperá-los no futuro, além da punição normal detalhada acima. Como resultado do decreto, os alquimistas foram forçados a conduzir sua prática em segredo. As fontes incluem, mas não se limetam em:
- «CATHOLIC ENCYCLOPEDIA: Alchemy». www.newadvent.org. Consultado em 12 de abril de 2023
- Walsh, J. J. (outubro de 1905). «Pope John XXII and the Supposed Bull Forbidding Chemistry». Medical Library and Historical Journal (4): 248–263. ISSN 0898-1868. PMC 1692365
 . PMID 18340886. Consultado em 12 de abril de 2023
. PMID 18340886. Consultado em 12 de abril de 2023 - Maxwell-Stuart, P. G. (1 de março de 2012). The Chemical Choir: A History of Alchemy (em inglês). [S.l.]: A&C Black
- «Pope John XXII's decree against alchemy». www.levity.com. Consultado em 12 de abril de 2023
- Corporation, Bonnier (janeiro de 1893). Popular Science (em inglês). [S.l.]: Bonnier Corporation
- Walsh, James Joseph (1908). The popes and science; the history of the papal relations to science during the middle ages and down to our own time. University of California Libraries. [S.l.]: New York : Fordham University Press
- «CATHOLIC ENCYCLOPEDIA: Pope John XXII». www.newadvent.org. Consultado em 12 de abril de 2023
- White, Andrew Dickson (1893). New chapters in the warfare of science, XVIII: From magic to chemistry and physics. New York: Appleton
- ↑ Boyle, Robert (1661). The Sceptical Chymist. New York: Dover Publications, Inc. (reprint). ISBN 978-0-486-42825-3.
- ↑ «Newton Papers : Hydrostatics, Optics, Sound and Heat». Cambridge Digital Library. Consultado em 12 de abril de 2023
- ↑ Isaac Newton (1730). Opticks:: Or, A Treatise of the Reflections, Refractions, Inflections and Colours of Light (em inglês). Oxford University. [S.l.]: Printed for W. Innys
- ↑ a b c d e f g «Antoine Lavoisier | Biography, Discoveries, & Facts | Britannica». www.britannica.com (em inglês). Consultado em 9 de abril de 2023
- ↑ Guerlac, Henry (1973). Antoine-Laurent Lavoisier – Chemist and Revolutionary. New York: Charles Scribner's Sons. p. 130.
- ↑ «Biografia John Dalton». www.explicatorium.com. Consultado em 12 de abril de 2023
- ↑ a b «Matter: Atoms from Democritus to Dalton» by Anthony Carpi, Ph.D.
- ↑ a b c d «John Dalton». Science History Institute (em inglês). 1 de junho de 2016. Consultado em 12 de abril de 2023
- ↑ a b c d e f Dalton, John (1808–1827). A new system of chemical philosophy. Gerstein - University of Toronto. [S.l.]: London
- ↑ a b Society, Manchester Literary and Philosophical (1805). Memoirs and Proceedings of the Manchester Literary & Philosophical Society (em inglês). [S.l.: s.n.]
- ↑ Dalton, John (1893). Foundations of the molecular theory. Col: Alembic club reprints ;no. 4. Edinburgh, London: William F. Clay; Simpkin, Marshall, Hamilton, Kent & co.
- ↑ «Biography of Amedeo Avogadro, Influential Italian Scientist». ThoughtCo (em inglês). Consultado em 12 de abril de 2023
- ↑ Chemistry (IUPAC), The International Union of Pure and Applied. «IUPAC - Avogadro constant (A00543)». goldbook.iupac.org. Consultado em 12 de abril de 2023
- ↑ «Jöns Jacob Berzelius | Karolinska Institutet». ki.se (em sueco). Consultado em 12 de abril de 2023
- ↑ Jöns Jakob Berzelius, Friedrich Wöhler (1825). Lehrbuch der Chemie (em alemão). New York Public Library. [S.l.]: Arnold
- ↑ Williams, Andrew (novembro de 2007). «Origin of the Formulas of Dihydrogen and Other Simple Molecules». Journal of Chemical Education (em inglês) (11). 1779 páginas. ISSN 0021-9584. doi:10.1021/ed084p1779. Consultado em 12 de abril de 2023
- ↑ Evieux, E. A. (junho de 1954). «The Geneva Congress on Organic Nomenclature, 1892». Journal of Chemical Education (em inglês) (6). 326 páginas. ISSN 0021-9584. doi:10.1021/ed031p326. Consultado em 12 de abril de 2023
- ↑ «Definition of Kekulé's formula | Dictionary.com». www.dictionary.com (em inglês). Consultado em 12 de abril de 2023
- ↑ Camel, Tânia de Oliveira; Koehler, Carlos B. G.; Filgueiras, Carlos A. L. (2009). «A química orgânica na consolidação dos conceitos de átomo e molécula». Química Nova: 543–553. ISSN 0100-4042. doi:10.1590/S0100-40422009000200045. Consultado em 12 de abril de 2023
- ↑ Baumhauer, Eduard Hendrik; Bosscha, Johannes; Lotsy, Johannes Paulus (1874). Archives néerlandaises des sciences exactes et naturelles (em francês). [S.l.]: Société hollandaise des sciences à Harlem
- ↑ de Milt, Clara (agosto de 1951). «The Congress at Karlsruhe». Journal of Chemical Education (em inglês) (8). 421 páginas. ISSN 0021-9584. doi:10.1021/ed028p421. Consultado em 12 de abril de 2023
- ↑ «JCE Online: JCE Index: Record Detail». web.archive.org. 28 de setembro de 2007. Consultado em 12 de abril de 2023
- ↑ Campos, Aurora Vasco (8 de fevereiro de 2016). «Las siete curiosidades que esconde la Tabla Periódica de Dmitri Mendeléyev». elconfidencial.com (em espanhol). Consultado em 12 de abril de 2023
- ↑ Rouvray, Dennis H. (1 de junho de 2004). «Elements in the history of the Periodic Table». Endeavour (em inglês) (2): 69–74. ISSN 0160-9327. doi:10.1016/j.endeavour.2004.04.006. Consultado em 12 de abril de 2023
- ↑ Lakhtakia, Akhlesh; Salpeter, Edwin E. (1 de setembro de 1997). «Models and Modelers of Hydrogen». American Journal of Physics (9): 933–934. ISSN 0002-9505. doi:10.1119/1.18691. Consultado em 13 de abril de 2023
- ↑ Bohr, Niels (1 de janeiro de 1913). «On the Constitution of Atoms and Molecules, Part I». ISSN 1941-5982. doi:10.1080/14786441308634955. Consultado em 13 de abril de 2023
- ↑ «How to pronounce Planck's constant in English». web.archive.org. 15 de dezembro de 2018. Consultado em 13 de abril de 2023
- ↑ «KNAW Historisch Ledenbestand | Digitaal Wetenschapshistorisch Centrum» (em neerlandês). Consultado em 13 de abril de 2023
- ↑ «Diretório Acadêmico do Curso de Química Industrial - Universidade Federal de Santa Maria». coral.ufsm.br. Consultado em 19 de abril de 2023
- ↑ «Texto-base - Modelos Teóricos para a compreensão da estrutura da matéria | Wagner B. de Almeida e Hélio F. dos Santos». integra.univesp.br. Consultado em 19 de abril de 2023
- ↑ Peduzzi, Luiz OQ. "Do átomo grego ao átomo de Bohr." Florianópolis: Departamento de Física/UFSC (2005).
- ↑ Pleitez, V. (junho de 2003). «Bohr: O arquiteto do átomo». Revista Brasileira de Ensino de Física: 250–255. ISSN 1806-1117. doi:10.1590/S1806-11172003000200012. Consultado em 19 de abril de 2023
- ↑ Núñez, Isauro Beltrán, L. S. Neves, and Betânia Leite Ramalho. "Uma reflexão em relação ao estudo da mecânica quântica: o caso do principio da incerteza." OEI-Revista Iberoamericana de Educación (ISSN: 1681-5653) Espanha (2003): 1.
- ↑ Nogueira, Helena; Porto, Paulo (2018). «O CONCEITO DE VALÊNCIA EM LIVROS DIDÁTICOS DE QUÍMICA GERAL ENTRE AS DÉCADAS DE 1890 E 1940». Química Nova. ISSN 0100-4042. doi:10.21577/0100-4042.20170310. Consultado em 19 de abril de 2023
- ↑ R. Penrose (1991). «The mass of the classical vacuum». In: S. Saunders, H.R. Brown. The Philosophy of Vacuum. [S.l.]: Oxford University Press. p. 21. ISBN 0-19-824449-5
- ↑ «Matter (physics)». McGraw-Hill's Access Science: Encyclopedia of Science and Technology Online. Consultado em 24 de maio de 2009. Arquivado do original em 17 de junho de 2011
- ↑ J. Mongillo (2007). Nanotechnology 101. [S.l.]: Greenwood Publishing. p. 30. ISBN 0-313-33880-9
- ↑ IUPAC Gold Book Definition Arquivado em 30 de setembro de 2009, no Wayback Machine.
- ↑ Leigh 1990, p. 35.
- ↑ «chemical bonding». Britannica. Encyclopædia Britannica. Consultado em 1 de novembro de 2012
- ↑ Brown 2009, p. 5-6.
- ↑ Hill 2005, p. 6.
- ↑ Whitten 2000, p. 15.
- ↑ Halal 2008, p. 96-98.
- ↑ Hill 2005, p. 37.
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "molecule" (1994) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ Pauling 1970.
- ↑ Ebbin 1990.
- ↑ Brown 2003.
- ↑ Chang 1998.
- ↑ Zumdahl 1997.
- ↑ Chandra 2005.
- ↑ «Molecule» (em inglês). Encyclopædia Britannica on-line. Consultado em 14 de janeiro de 2013
- ↑ «The Lewis Acid-Base Concept». Apsidium (em inglês). Consultado em 14 de janeiro de 2013. Arquivado do original em 27 de maio de 2008
- ↑ «History of Acidity» (em inglês). Bbc.co.uk. Consultado em 14 de janeiro de 2013
- ↑ Covington, A. K.; Bates, R. G.; Durst, R. A. (1985). «Definitions of pH scales, standard reference values, measurement of pH, and related terminology» (PDF). Pure Appl. Chem. 57 (3): 531–542. doi:10.1351/pac198557030531
- ↑ Modell 1974.
- ↑ Nic, M; Jirat, J.; Kosata, B. (2006). «IUPAC Compendium of Chemical Terminology» (em inglês). IUPAC. doi:10.1351/goldbook.C01033. Consultado em 13 de janeiro de 2013
- ↑ SILVA, R. R.; ROCHA-FILHO, R. C. (maio de 1995). «Mol: uma nova terminologia» (PDF). São Paulo. Quím. Nova Esc. (1): 12-14
- ↑ «INMETRO Unidades legais de medida». Consultado em 27 de agosto de 2010
- ↑ Mills 1993, p. 4.
- ↑ «Current definitions of the SI base units». National Institute of Standards and Technology. 2019. Consultado em 3 de janeiro de 2022
- ↑ Atkins 2006, p. 200-202.
- ↑ Atkins 2008.
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "chemical equilibrium" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ Reilly, Michael. (2007). Mechanical force induces chemical reaction, NewScientist.com news service, Reilly Arquivado em 25 de março de 2007, no Wayback Machine.
- ↑ «Changing States of Matter» - Chemforkids.com
- ↑ «Careers in Chemistry: Inorganic Chemistry» (em inglês). American Chemical Society. Consultado em 14 de janeiro de 2013. Arquivado do original em 29 de outubro de 2012
- ↑ Lehn 1995.
- ↑ Holler, F. James; Skoog, Douglas A.; West, Donald M. (1996). Fundamentals of analytical chemistry. Philadelphia: Saunders College Pub. ISBN 0-03-005938-0
- ↑ Hulanicki A. (1987). Reactions of Acids and Bases in Analytical Chemistry. [S.l.]: Horwood. ISBN 0-85312-330-6
- ↑ E. J. King "Qualitative Analysis and Electrolytic Solutions" 1959, Harcourt, Brace, and World, New York.
- ↑ Landau 1980, p. 52.
- ↑ Schmidt 2005, p. 30.
- ↑ Schmidt 2005, p. 25; 32.
- ↑ Chandler 1987, p. 54.
- ↑ Morrison 1992.
- ↑ Morrison 1964.
- ↑ Richard F. and Sally J. Daley, Organic Chemistry, Online organic chemistry textbook. Ochem4free.info
- ↑ "chemistry of industrial polymers", Encyclopædia Britannica (2006)
- ↑ Lehninger, A.L.; Nelson, D.L.; Cox, M.M. (2007) Lehninger: Princípios de Bioquímica, 4a. Edição, Editora Sarvier.
- ↑ Voet, D.; Voet, J.G. (2008) Fundamentos de Bioquímica - A Vida em Nível Molecular, 2a. Edição, Editora Artmed.
- ↑ Stryer 2004.
- ↑ Krukemberghe Fonseca. «Ácidos Nucleicos». R7. Brasil Escola. Consultado em 3 de novembro de 2012
- ↑ Stryer et al., p. 634.
- ↑ Stryer et al., pp. 625–26.
- ↑ a b Sociedade Brasileira de Química. AVALIAÇÃO DO ESTADO DE OXIDAÇÃO DO NÍQUEL NO SISTEMA Ni-DMG EM PRESENÇA DE ESPÉCIES OXIDANTES. - Clarivaldo Santos de Sousa, Zênis Novais da Rocha, Mauro Korn. Visitado em 1 de Setembro de 2015.
- ↑ «YouTube» - Vídeo: Sonochemistry & Cavitation. (em inglês) Visitado em 4 de Julho de 2018.
- ↑ «YouTube» - Vídeo: Síntesis de Nanopartículas de TiO2 por Sonoquímica, Parte 1. (em castelhano) Visitado em 4 de Julho de 2018.
- ↑ Carlos Dias (1999). «65 anos. Em cada perna». Revista Superinteressante. Consultado em 10 de fevereiro de 2013
- ↑ Torresi; et al. (2009). «Química é uma ciência em expansão». Química Nova. 32 (8). ISSN 0100-4042. Consultado em 10 de fevereiro de 2013
- ↑ Lúcia Helena de Oliveira (1991). «A química presente nas atividade do dia-a-dia». Revista Superinteressante. Consultado em 10 de fevereiro de 2013
- ↑ Conselho Regional de Química - O que faz um químico?
- ↑ Teresa Firmino (5 de dezembro de 2006). «Laboratório Chimico abre hoje como museu de ciência». Público. Consultado em 10 de fevereiro de 2013
- ↑ Santos; et al. (2011). «O primeiro curso regular de química no Brasil». Química Nova. 34 (2). ISSN 0100-4042. doi:10.1590/S0100-40422011000200034. Consultado em 10 de fevereiro de 2013
- ↑ «Guia Abril de Estudante - Química». Consultado em 10 de fevereiro de 2013
- ↑ Bechara & Vietler; et al. (1997). «Criação e consolidação da Sociedade Brasileira de Química (SBQ)». Química Nova. 20 (especial). ISSN 0100-4042. doi:10.1590/S0100-40422011000200034. Consultado em 10 de fevereiro de 2013
- ↑ «Cem anos de Sociedade Portuguesa de Química». Ciência Hoje. 27 de dezembro de 2010. Consultado em 10 de fevereiro de 2013
- ↑ «Robert J. Lefkowitz e Brian K. Kobilka ganham o prêmio Nobel da Química». Ciência Hoje. 27 de dezembro de 2010. Consultado em 10 de fevereiro de 2013
- ↑ «Tecnologia em Processos Químicos». Universidade Tecnológica Federal do Paraná UTFPR. Consultado em 19 de maio de 2020
Bibliografia
[editar | editar código-fonte]- Atkins, Peter William; Paula, Julio de (2006). Atkins' Physical Chemistry (em inglês) 8 ed. [S.l.]: Oxford University Press. p. 1053. ISBN 9780716771111. Consultado em 14 de janeiro de 2013
- Atkins, Peter William; Jones, Loretta (2008). Chemical Principles: The Quest for Insight (em inglês) 4 ed. [S.l.]: W.H. Freeman. p. 787. ISBN 9780716799030
- Brown, Theodore L; Lemay, H. Eugene; Bursten, Bruce Edward; Lemay, H (1999). Chemistry: The Central Science (em inglês) 8 ed. [S.l.]: Prentice Hall. ISBN 0-13-010310-1
- Brown, Theodore L; Bursten, Bruce Edward; Kemp, Kenneth C; LeMay, Harold Eugene; Nelson, John H (2003). Chemistry – the Central Science (em inglês) 9 ed. Nova Jérsei: Prentice Hall. p. 592. ISBN 9780130669971. Consultado em 14 de janeiro de 2013
- Brown, Theodore L; Bursten, Bruce Edward; LeMay, Harold Eugene; Murphy, Catherine J; Woodward, Patrick (2009). Chemistry – the Central Science (em inglês) 11 ed. Nova Jérsei: Prentice Hall. p. 592. ISBN 0-13-236489-1. Consultado em 14 de janeiro de 2013
- Chandler, David (1987). Introduction to Modern Statistical Mechanics (em inglês). Nova Iorque: Oxford University Press. p. 274. ISBN 9780195042771. Consultado em 14 de janeiro de 2013
- Chandra, Sulekh (2005). Comprehensive Inorganic Chemistry (em inglês). Nova Déli: New Age Publishers. p. 324. ISBN 9788122415124. Consultado em 14 de janeiro de 2013
- Chang, Raymond (1998). Chemistry (em inglês) 6 ed. Nova Iorque: McGraw Hill. ISBN 0-07-115221-0
- Ebbin, Darrell, D (1990). General Chemistry (em inglês) 3 ed. Boston: Houghton Mifflin. ISBN 0-395-43302-9
- Gibbs, Josiah Willard (1876). On the Equilibrium of Heterogeneous Substances (em inglês). [S.l.]: American Journal of Science and Arts. p. 458. Consultado em 14 de janeiro de 2013
- Halal, John (2008). «Chapter 8: General Chemistry». Milady's Hair Structure and Chemistry Simplified (PDF) 5 ed. [S.l.]: Milady Publishing. ISBN 1-4283-3558-7. Consultado em 14 de janeiro de 2013
- Hill, John W.; Petrucci, Ralph H.; McCreary, Terry W.; Perry, Scott S (2005). General Chemistry (em inglês) 4 ed. Upper Saddle River: Prentice Hall. p. 1200. ISBN 9780131402836. Consultado em 14 de janeiro de 2013
- Laidler, Keith James (1993). The World of Physical Chemistry (em inglês). Oxford: Oxford University Press. p. 476. ISBN 9780198555971. Consultado em 14 de janeiro de 2013
- Landau, Lev Davidovich; Lifshitz, E. M.; Pitaevskii, L. P (1980). Statistical Physics (em inglês) 3 ed. Nova Iorque: Elsevier Butterworth Heinemann. p. 387. ISBN 9780750626361. Consultado em 14 de janeiro de 2013
- Lehn, Jean-Marie (1995). Supramolecular Chemistry: Concepts and Perspectives (em inglês). Weinheim: Wiley. p. 281. ISBN 9783527293117. Consultado em 14 de janeiro de 2013
- Leigh, G. J; International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry (1990). Nomenclature of Organic Chemistry – Recommendations 1990 (em inglês). Oxford: Blackwell Scientific Publications. ISBN 0-08-022369-9
- Mills, Ian; Cvitaš, Tomislav; Kallay, Nicola; Klaus, Homann; Kuchitsu, Kozo (1993). Quantities, units and symbols in physical chemistry (em inglês) 2 ed. Oxford: John Wiley & Sons. p. 166. ISBN 9780632035830. Consultado em 14 de janeiro de 2013. Arquivado do original em 18 de fevereiro de 2008
- Modell, Michael; Reid, Robert C (1974). Thermodynamics and Its Applications (em inglês) 0-13-914861-2 ed. Englewood Cliffs: Prentice-Hall
- Morrison, Robert T; Boyd, Robert N; Boyd, Robert K (1992). Organic Chemistry (em inglês) 6 ed. [S.l.]: Benjamin Cummings. ISBN 0-13-643669-2
- Pauling, Linus (1970). General Chemistry (em inglês). Nova Iorque: Dover Publications. ISBN 0-486-65622-5
- Reinhardt, Carsten (2001). Chemical Sciences in the 20th Century: Bridging Boundaries (em inglês). [S.l.]: Wiley-VCH
- Roberts, John D; Caserio, Marjorie C (1964). Basic Principles of Organic Chemistry (em inglês). [S.l.]: W. A. Benjamin
- Schmidt, Lanny D (2005). The Engineering of Chemical Reactions (em inglês) 2 ed. Nova Iorque: Oxford University Press. ISBN 0-19-516925-5
- Stryer, L; Tymoczko, J. L.; Berg, J. M (2004). Bioquímica 5 ed. [S.l.]: Guanabara
- Vucinich, Alexander (1963). Science in Russian culture (em inglês). [S.l.]: Stanford University Press. ISBN 0-8047-0738-3. Consultado em 14 de janeiro de 2013
- Whitten, Kenneth W; Davis, Raymond E; Peck, M. Larry (2000). General Chemistry (em inglês) 6 ed. Fort Worth: Saunders College Publishing/Harcourt College Publishers. ISBN 978-0-03-072373-5
- Zumdahl, Steven S (1997). Chemistry (em inglês) 4 ed. Boston: Houghton Mifflin.

