Varidnaviria
 Из Википедии, бесплатной энциклопедии
Из Википедии, бесплатной энциклопедии
| Varidnaviria | ||||||
|---|---|---|---|---|---|---|
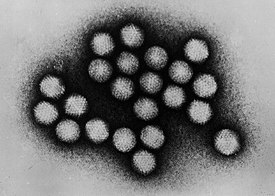 Электронная микрофотография частиц аденовируса | ||||||
| Научная классификация | ||||||
| Международное научное название | ||||||
| Varidnaviria | ||||||
| Группа по Балтимору | ||||||
| I: дцДНК-вирусы | ||||||
| ||||||
Varidnaviria (лат.) — реалм[Ком. 1] ДНК-содержащих вирусов. Общей чертой, объединяющей представителей реалма, является присутствие структурного мотива (укладки), известного как вертикальный jelly roll, в составе мажорного капсидного белка. Молекулы мажорного капсидного белка формируют псевдогексамерные капсомеры. Также вирусы из реалма Varidnaviria обладают такими белками, как минорный капсидный белок с мотивом вертикальный jelly roll, АТФазой, упаковывающей вирусный ДНК-геном в капсид, и собственной ДНК-полимеразой, реплицирующий вирусные геномы.
В состав реалма Varidnaviria входит большинство ДНК-содержащих вирусов эукариот, например, морские вирусы, многие вирусы, патогенные для человека (например, аденовирусы и поксвирусы), вирус африканской чумы свиней, а также гигантские вирусы, инфицирующие амёб и обладающие огромными вирионами и геномами по меркам вирусов.
Этимология[править | править код]
Название таксона состоит из частей английских слов «Various DNA viruses», буквально — «различные ДНК-вирусы», и стандартного для всех реалмов суффикса -viria[2][3].
Строение[править | править код]

Капсид вирусов, входящих в состав реалма Varidnaviria, состоит из молекул мажорного капсидного белка (англ. major capsid protein, MCP), который содержит вертикальный единичный (SJR) или двойной (DJR) структурный мотив jelly roll. Мотив jelly roll состоит из восьми антипараллельных бета-листов, организованных в четыре антипараллельных бета-слоя таким образом, что внешний вид структуры напоминает рулет (англ. roll). Мотив DJR состоит из двух SJR в составе одного белка. Вертикальными эти укладки называют из-за того, что они ориентированы перпендикулярно поверхности капсида, в отличие от горизонтальных укладок, которые параллельны поверхности капсида[3][4][5].
У большинства членов Varidnaviria капсид имеет икосаэдрическую форму и включает 20 треугольных граней и 12 вершин. Некоторые члены реалма, например, члены семейств Ascoviridae и Poxviridae, утратили предковые икосаэдрические капсиды и имеют капсиды, напоминающие по форме яйцо или кирпич[6]. В процессе сборки вирусного капсида молекулы MCP самоорганизуются в шестиугольные структуры, называемые гексонами. Гексоны взаимодействуют друг с другом, образуя относительно плоские треугольные грани икосаэдрического капсида. У всех представителей Varidnaviria с MCP, содержащими DJR, строение вирионов которых было проанализировано с помощью микроскопии высокого разрешения, был обнаружен минорный капсидный белок (англ. minor capsid protein, mCP), который содержит укладку SJR. mCP собираются в пятиугольные структуры, известные как пентоны, которые располагаются в вершинах икосаэдрического капсида, в которых сходятся пять граней[4][5][6][7].
Большинство членов реалма также кодируют АТФазу из суперсемейства FtsK-HerA, которая необходима для упаковки вирусного генома в капсид[3]. Белки семейства FtsK имеют на N-конце четыре α-спирали, заякоривающие белок в мембране, а на C-конце содержат АТФазный домен, в состав которого входит укладка, известная как P-петля (англ. P loop). Белки семейства HerA гомологичны членам семейства FtsK[8]. У некоторых представителей Varidnaviria функциональное предназначение АТФазы до конца неясно. Например, у вируса Corticovirus, обладающего кольцевым сверхспирализованным геномом, транслокация генома в капсид с помощью АТФазы затруднена[5]. Иногда АТФазы суперсемейства FtsK-HerA, принадлежащие вирусам из Varidnaviria, называют кладой A32 по названию гена, кодирующего АТФазу у вируса Vaccinia virus (англ. Vaccinia virus) — A32(R)[8].
Помимо наличия MCP, mCP и АТФазы, членов реалма Varidnaviria объединяют некоторые другие черты. Так, многие представители реалма кодируют ДНК-полимеразу типа B, которая реплицирует вирусный геном, а иногда и дополнительные компоненты комплекса ДНК-полимеразы, такие как хеликазы суперсемейства 3. Представители семейства Corticoviridae кодируют особые белки инициации репликации. Исключением является порядок Halopanivirales, члены которого не кодируют никаких определяемых репликативных ферментов[3][6]. Иногда представители Varidnaviria кодируют особую протеазу, участвующую в созревании капсидов[6]. Некоторые члены реалма имеют интегразу, позволяющую им встраиваться в геном организма-хозяина[6][9]. Поксвирусы кодируют специальный белок-скэффолд, который направляет сборку капсида[5]. У некоторых членов реалма одна из вершин икосаэдрического капсида служит для выхода вирусного генома в цитоплазму инфицированной клетки, где далее образуется вирусная фабрика[7]. Иногда геном внутри икосаэдрических капсидов покрыт липидной мембраной. Наконец, практически все представители Varidnaviria имеют геномы, представленные двуцепочечной ДНК. Исключение составляют члены семейства Finnlakeviridae, геномы которых представлены одноцепочечной ДНК[3]. Представители этого семейства, а также вирусы, входящие в так называемую группу Одина (англ. Odin group) и предположительно входящие в состав Varidnaviria, не имеют АТФаз из суперсемейства FtsK-HerA[5][10].
Филогенетика[править | править код]
Была высказана гипотеза, что представители Varidnaviria инфицировали ещё последнего универсального общего предка (LUCA)[11]. Вертикальные мотивы SJR-MCP вирусов порядка Halopanivirales из царства Helvetiavirae родственны к группе белков, включающей суперсемейство купина и нуклеоплазмины, поэтому, возможно, MCP Varidnaviria впервые появились у вирусов этой группы[12]. Вирусы, имеющие DJR-MCP, относятся к царству Bamfordvirae, и предполагается, что их DJR-MCP произошёл в результате слияния двух генов, кодирующих SJR-MCP. Это предположение подкрепляется тем фактом, что два мотива SJR-MCP в капсиде формируют структуру, близкую к структуре капсидного DJR-MCP[3]. Вирусы архей семейства Portogloboviridae имеют только один вертикальный SJR-MCP, который, возможно, подвергся дупликации у Halopanivirales, поэтому самый древний вариант MCP, возможно, встречается именно у членов семейства Portogloboviridae[11].
Вирусы царства Bamfordvirae, возможно, переключились с заражения прокариот на эукариот в начале эукариогенеза. Вероятно, это произошло при заражении вирусом из семейства Tectiviridae или другого близкого семейства бактерии, которая впоследствии стала внутриклеточным эндосимбионтом первых эукариот[5]. Анализ вирусных ДНК-полимераз и некоторые другие свойства свидетельствуют, что поражающие эукариот вирусы из царства Bamfordvirae вступали в сложные взаимоотношения с некоторыми эгоистичными генетическими элементами, такими как полинтоны и некоторые виды плазмид[6][9][13].
Первый бактериальный эндосимбионт эукариотической клетки стал митохондрией, причем линейные митохондриальные плазмиды, происходящие от вирусов семейства Tectiviridae, сохранились и по сей день[5]. Вероятно, первым вирусом эукариот стал вирус из царства Bamfordvirae, причём некоторые вирусы эукариот достигли ядра и вступили в рекомбинацию с транспозонами, став полинтонами[6][13][14]. От полинтонов затем произошли многие другие вирусы эукариот, включая аденовирусы и гигантские вирусы, а также цитоплазматические линейные плазмиды, вирофаги, трансповироны и вирусы семейства Bidnaviridae, которые появились в результате рекомбинации с парвовирусами[6][9]. И Bidnaviridae, и Parvoviridae сейчас включены в состав реалма Monodnaviria[15].
Хотя мотив jelly roll встречается у вирусов и за пределами реалма Varidnaviria, например, у членов семейства Microviridae из реалма Monodnaviria и различных вирусов из реалма Riboviria, геномы которых представлены одноцепочечной РНК, только у Varidnaviria этот структурный элемент ориентирован вертикально. В целом, между вирусами из Varidnaviria и других реалмов не прослеживается явных родственных связей[3].
Классификация[править | править код]
Все члены реалма Varidnaviria входят в состав группы I классификации вирусов по Балтимору (вирусы, геном которых представлен двуцепочечной ДНК). Исключение составляет вероятный член Varidnaviria — семейство Finnlakeviridae, которое относится к группе II (вирусы, геном которых представлен одноцепочечной ДНК)[3]. Большинство известных ДНК-содержащих вирусов эукариот входят в состав Varidnaviria. Заметными исключениями являются вирусы порядка Herpesvirales, заражающие животных и относящиеся к реалму Duplodnaviria[16], а также вирусы класса Papovaviricetes, которые также инфицируют животных и входят в состав реалма Monodnaviria[17].
По состоянию на 2020 год к реалму относили следующие таксоны до класса включительно[15]:
- Царство Bamfordvirae
- Тип Nucleocytoviricota
- Класс Megaviricetes
- Класс Pokkesviricetes
- Тип Preplasmiviricota
- Класс Maveriviricetes
- Класс Tectiliviricetes
- Тип Nucleocytoviricota
- Царство Helvetiavirae
- Тип Dividoviricota
- Класс Laserviricetes
- Тип Dividoviricota
Упоминавшееся выше семейство вирусов архей Portogloboviridae, вероятно, можно отнести к реалму Varidnaviria на основании сходства структуры белков капсида[11]. Также к Varidnaviria могут относиться вирусы класса Naldaviricetes (семейство Polydnaviridae), поражающие членистоногих. Эти вирусы по последовательностям коровых генов близки к вирусам типа Nucleocytoviricota и могут являться высоко специализированной группой, произошедшей от вирусов, имеющих DJR-MCP, хотя как таковых DJR-MCP они не имеют и формируют не икосаэдрические вирионы, а вирионы неправильной формы. Предварительный филогенетический анализ генов, являющихся общими для Naldaviricetes и Nucleocytoviricota — генов, кодирующих ДНК-полимеразу типа B, субъединицы РНК-полимеразы, хеликазу, праймазу и тиолоксидоредуктазу — показал, что, действительно, Naldaviricetes могут являться высоко специализированной группой Nucleocytoviricota[18][19].
Взаимодействие с хозяевами[править | править код]
Бактериофаги, входящие в состав реалма Varidnaviria, являются одной из основных причин гибели морских прокариот. Вирусы водорослей, входящие в состав семейства Phycodnaviridae, играют важную роль в контроле цветения водоёмов. Наряду с морскими вирусами они образуют так называемый «вирусный шунт» (англ. viral shunt), благодаря которому органический материал, образовавшийся в результате гибели инфицированных микроорганизмов, «шунтируется» вирусами с высших трофических уровней на более низкие, где разлагается и поглощается другими организмами[20]. В число представителей Varidnaviria входят многие патогены человека и животных, такие как аденовирусы, поксвирусы и вирус африканской чумы свиней[21][22][23].
Многие члены Varidnaviria кодируют интегразу и способны к эндогенизации, то есть встраиванию в геном клетки-хозяина. После эндогенизации они ведут себя как транспозоны. Интеграция вирусного генома в геном клетки-хозяина является одним из механизмов горизонтального переноса генов между неродственными организмами[9][24][25]. Интересным примером вирусов из реалма Varidnaviria, подвергшихся эндогенизации, являются вирофаги. Жизненный цикл вирофагов требует присутствия вируса-хозяина, от которого зависит их репликация и для которого они выступают как вирусы-сателлиты. Как правило, вирусами-хозяевами вирофагов являются гигантские вирусы. Некоторые вирофаги способны встраиваться в клеточный геном, и это обеспечивает адаптивный иммунитет клетки-хозяина против гигантских вирусов[9][24][25].
История изучения[править | править код]
Инфекции, вызываемые отдельными представителями реалма Varidnaviria, в частности, поксвирусами и аденовирусами, были известны давно. Характерная структура MCP была впервые описана у человеческих аденовирусов, когда было показано, что в их случае укладка jelly roll ориентирована перпендикулярно, а не параллельно. В 1999 году была получена структура MCP вируса Pseudomonas virus PRD1, и тогда стало ясно, что структура DJR-MCP встречается как у вирусов эукариот, так и у вирусов прокариот[5]. В 2003 году на примере вируса Haloarcula hispanica virus SH1 было показано, что MCP может содержать и SJR[26]. Бурное развитие метагеномики позволило описать множество ранее не известных членов Varidnaviria[10][14]. Благодаря этому в 2019 году группа исследователей во главе с Евгением Куниным предложила выделение реалма Varidnaviria на основании ряда общих признаков[3].
На данный момент выделяется несколько близких к Varidnaviria групп вирусов, которые пока не были официально включены в состав реалма. К ним относятся уже упоминавшееся семейство Finnlakeviridae, семейство Autolykiviridae, члены которых, вероятно, являются одной из основных причин гибели морских бактерий, а также вирусы группы Одина, у которых отсутствует АТФаза из суперсемейства FtsK-HerA, однако имеется белок, гомологов для которого за пределами группы пока не известно[3][5][10].
Примечания[править | править код]
Комментарии
Источники
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Kauffman K. M., Hussain F. A., Yang J., Arevalo P., Brown J. M., Chang W. K., VanInsberghe D., Elsherbini J., Sharma R. S., Cutler M. B., Kelly L., Polz M. F. A major lineage of non-tailed dsDNA viruses as unrecognized killers of marine bacteria. (англ.) // Nature. — 2018. — 1 February (vol. 554, no. 7690). — P. 118—122. — doi:10.1038/nature25474. — PMID 29364876.
- ↑ 1 2 3 4 5 6 7 8 9 10 Koonin EV, Dolja VV, Krupovic M, Varsani A, Wolf YI, Yutin N, Zerbini M, Kuhn JH. Create a megataxonomic framework, filling all principal taxonomic ranks, for DNA viruses encoding vertical jelly roll-type major capsid proteins (англ.) (docx). International Committee on Taxonomy of Viruses (18 октября 2019). Дата обращения: 10 июня 2020. Архивировано 4 января 2022 года.
- ↑ 1 2 Klose T., Rossmann M. G. Structure of large dsDNA viruses. (англ.) // Biological Chemistry. — 2014. — July (vol. 395, no. 7-8). — P. 711—719. — doi:10.1515/hsz-2014-0145. — PMID 25003382.
- ↑ 1 2 3 4 5 6 7 8 9 San Martín C., van Raaij M. J. The so far farthest reaches of the double jelly roll capsid protein fold. (англ.) // Virology Journal. — 2018. — 23 November (vol. 15, no. 1). — P. 181—181. — doi:10.1186/s12985-018-1097-1. — PMID 30470230.
- ↑ 1 2 3 4 5 6 7 8 Krupovic M., Koonin E. V. Polintons: a hotbed of eukaryotic virus, transposon and plasmid evolution. (англ.) // Nature reviews. Microbiology. — 2015. — Vol. 13, no. 2. — P. 105—115. — doi:10.1038/nrmicro3389. — PMID 25534808.
- ↑ 1 2 Xiao C., Rossmann M. G. Structures of giant icosahedral eukaryotic dsDNA viruses. (англ.) // Current Opinion In Virology. — 2011. — August (vol. 1, no. 2). — P. 101—109. — doi:10.1016/j.coviro.2011.06.005. — PMID 21909343.
- ↑ 1 2 Iyer L. M., Makarova K. S., Koonin E. V., Aravind L. Comparative genomics of the FtsK-HerA superfamily of pumping ATPases: implications for the origins of chromosome segregation, cell division and viral capsid packaging. (англ.) // Nucleic Acids Research. — 2004. — Vol. 32, no. 17. — P. 5260—5279. — doi:10.1093/nar/gkh828. — PMID 15466593.
- ↑ 1 2 3 4 5 Koonin E. V., Krupovic M. Polintons, Virophages and Transpovirons: a Tangled Web Linking Viruses, Transposons and Immunity // Current Opinion in Virology. — 2017. — Vol. 25. — P. 7—15. — doi:10.1016/j.coviro.2017.06.008. — PMID 28672161.
- ↑ 1 2 3 Yutin N., Bäckström D., Ettema TJG, Krupovic M., Koonin E. V. Vast diversity of prokaryotic virus genomes encoding double jelly-roll major capsid proteins uncovered by genomic and metagenomic sequence analysis. (англ.) // Virology Journal. — 2018. — 10 April (vol. 15, no. 1). — P. 67—67. — doi:10.1186/s12985-018-0974-y. — PMID 29636073.
- ↑ 1 2 3 Krupovic M., Dolja V. V., Koonin E. V. The LUCA and its complex virome. (англ.) // Nature Reviews. Microbiology. — 2020. — 14 July. — doi:10.1038/s41579-020-0408-x. — PMID 32665595.
- ↑ Krupovic M., Koonin E. V. Multiple origins of viral capsid proteins from cellular ancestors. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2017. — 21 March (vol. 114, no. 12). — P. 2401—2410. — doi:10.1073/pnas.1621061114. — PMID 28265094.
- ↑ 1 2 Krupovic M., Bamford D. H., Koonin E. V. Conservation of major and minor jelly-roll capsid proteins in Polinton (Maverick) transposons suggests that they are bona fide viruses. (англ.) // Biology direct. — 2014. — Vol. 9. — P. 6. — doi:10.1186/1745-6150-9-6. — PMID 24773695.
- ↑ 1 2 Yutin N., Shevchenko S., Kapitonov V., Krupovic M., Koonin E. V. A novel group of diverse Polinton-like viruses discovered by metagenome analysis. (англ.) // BMC biology. — 2015. — Vol. 13. — P. 95. — doi:10.1186/s12915-015-0207-4. — PMID 26560305.
- ↑ 1 2 Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV). (Дата обращения: 26 апреля 2020).
- ↑ Koonin EV, Dolja VV, Krupovic M, Varsani A, Wolf YI, Yutin N, Zerbini M, Kuhn JH. Create a megataxonomic framework, filling all principal/primary taxonomic ranks, for dsDNA viruses encoding HK97-type major capsid proteins (англ.) (docx). International Committee on Taxonomy of Viruses (18 октября 2019). Дата обращения: 10 июня 2020. Архивировано 1 марта 2021 года.
- ↑ Koonin EV, Dolja VV, Krupovic M, Varsani A, Wolf YI, Yutin N, Zerbini M, Kuhn JH. Create a megataxonomic framework, filling all principal taxonomic ranks, for ssDNA viruses (англ.) (docx). International Committee on Taxonomy of Viruses (18 октября 2019). Дата обращения: 10 июня 2020. Архивировано 4 января 2022 года.
- ↑ Koonin Eugene V., Dolja Valerian V., Krupovic Mart, Varsani Arvind, Wolf Yuri I., Yutin Natalya, Zerbini F. Murilo, Kuhn Jens H. Global Organization and Proposed Megataxonomy of the Virus World (англ.) // Microbiology and Molecular Biology Reviews. — 2020. — 20 May (vol. 84, no. 2). — ISSN 1092-2172. — doi:10.1128/MMBR.00061-19.
- ↑ Koonin Eugene V., Dolja Valerian V., Krupovic Mart. Origins and evolution of viruses of eukaryotes: The ultimate modularity (англ.) // Virology. — 2015. — May (vol. 479-480). — P. 2—25. — ISSN 0042-6822. — doi:10.1016/j.virol.2015.02.039.
- ↑ Van Etten J. L., Dunigan D. D. Giant Chloroviruses: Five Easy Questions. (англ.) // PLoS Pathogens. — 2016. — August (vol. 12, no. 8). — P. e1005751—1005751. — doi:10.1371/journal.ppat.1005751. — PMID 27536965.
- ↑ Lynch JP 3rd., Kajon A. E. Adenovirus: Epidemiology, Global Spread of Novel Serotypes, and Advances in Treatment and Prevention. (англ.) // Seminars In Respiratory And Critical Care Medicine. — 2016. — August (vol. 37, no. 4). — P. 586—602. — doi:10.1055/s-0036-1584923. — PMID 27486739.
- ↑ Meyer H., Ehmann R., Smith G. L. Smallpox in the Post-Eradication Era. (англ.) // Viruses. — 2020. — 24 January (vol. 12, no. 2). — doi:10.3390/v12020138. — PMID 31991671.
- ↑ Galindo I., Alonso C. African Swine Fever Virus: A Review. (англ.) // Viruses. — 2017. — 10 May (vol. 9, no. 5). — doi:10.3390/v9050103. — PMID 28489063.
- ↑ 1 2 Mougari S., Sahmi-Bounsiar D., Levasseur A., Colson P., La Scola B. Virophages of Giant Viruses: An Update at Eleven. (англ.) // Viruses. — 2019. — 8 August (vol. 11, no. 8). — doi:10.3390/v11080733. — PMID 31398856.
- ↑ 1 2 Campbell S., Aswad A., Katzourakis A. Disentangling the Origins of Virophages and Polintons // Current Opinion in Virology. — 2017. — Vol. 25. — P. 59—65. — doi:10.1016/j.coviro.2017.07.011. — PMID 28802203.
- ↑ Pawlowski A., Rissanen I., Bamford J. K., Krupovic M., Jalasvuori M. Gammasphaerolipovirus, a newly proposed bacteriophage genus, unifies viruses of halophilic archaea and thermophilic bacteria within the novel family Sphaerolipoviridae. (англ.) // Archives Of Virology. — 2014. — June (vol. 159, no. 6). — P. 1541—1554. — doi:10.1007/s00705-013-1970-6. — PMID 24395078.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |