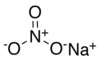
சோடியம் நைட்ரேட்டு

 | |||
| |||
| பெயர்கள் | |||
|---|---|---|---|
| ஐயூபிஏசி பெயர் சோடியம் நைட்ரேட்டு | |||
| வேறு பெயர்கள் பெரு சால்ட்பீட்டர் சோடா நைட்டர் கியூபிக் நைட்டர் | |||
| இனங்காட்டிகள் | |||
| 7631-99-4 | |||
| ChEMBL | ChEMBL1644698 | ||
| ChemSpider | 22688 | ||
| EC number | 231-554-3 | ||
| யேமல் -3D படிமங்கள் | Image | ||
| பப்கெம் | 24268 | ||
| வே.ந.வி.ப எண் | WC5600000 | ||
| |||
| UNII | 8M4L3H2ZVZ | ||
| UN number | 1498 | ||
| பண்புகள் | |||
| NaNO3 | |||
| வாய்ப்பாட்டு எடை | 84.9947 கி/மோல் | ||
| தோற்றம் | வெண்மையான தூள் அல்லது நிறமற்ற படிகங்கள் | ||
| மணம் | இனிப்பு | ||
| அடர்த்தி | 2.257 கி/செ.மீ3, திண்மம் | ||
| உருகுநிலை | 308 °C (586 °F; 581 K) | ||
| கொதிநிலை | 380 °C (716 °F; 653 K) சிதைவடையும் | ||
| 73 கி/100 மி.லி (0 °செ) 91.2 கி/100 மி.லி (25 °செ) 180 கி/100 மி.லி (100 °செ) | |||
| கரைதிறன் | அம்மோனியா மற்றும் ஐதரசினில் மிகவும் கரைகிறது.ஆல்ககாலில் கரைகிறது. பிரிடினில் சிறிதளவு கரைகிறது. அசிட்டோனில் கரைவதில்லை | ||
| −25.6·10−6 செ.மீ3/மோல் | |||
| ஒளிவிலகல் சுட்டெண் (nD) | 1.587 (முக்கோணம்) 1.336 (செஞ்சாய்சதுரம்) | ||
| பிசுக்குமை | 2.85 cP (317 °செல்சியசு) | ||
| கட்டமைப்பு | |||
| படிக அமைப்பு | முக்கோணம் மற்றும் செஞ்சாய்சதுரம் | ||
| வெப்பவேதியியல் | |||
| Std enthalpy of formation ΔfH | −467 கிலோயூல்/மோல்[1] | ||
| நியம மோலார் எந்திரோப்பி S | 116 J/(மோல் கெல்வின்)[1] | ||
| வெப்பக் கொண்மை, C | 93.05 J/(மோல் கெல்வின்) | ||
| தீங்குகள் | |||
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிகரணி, எரிச்சலூட்டி | ||
| பொருள் பாதுகாப்பு குறிப்பு தாள் | ICSC 0185 | ||
| ஈயூ வகைப்பாடு | |||
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (Median dose) | 3236 மில்லிகிராம்/கிலோகிராம் | ||
| தொடர்புடைய சேர்மங்கள் | |||
| ஏனைய எதிர் மின்னயனிகள் | சோடியம் நைட்ரைட்டு | ||
| ஏனைய நேர் மின்அயனிகள் | லித்தியம் நைட்ரேட் பொட்டாசியம் நைட்ரேட் ருபிடியம் நைட்ரேட் சீசியம் நைட்ரேட் | ||
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |||
சோடியம் நைட்ரேட்டு (Sodium nitrate) என்னும் வேதிச்சேர்மத்தின் மூலக்கூறு வாய்ப்பாடு NaNO3.ஆகும். இந்த கார உலோக நைட்ரேட்டு உப்பு சிலி சால்ட் பீட்டர் என்ற பெயராலும் அழைக்கப்படுகிறது. சிலி நாட்டில் அதிகமாக இது கிடைப்பதால் இதற்கு சிலி சால்ட் பீட்டர் என்ற பெயர் வைக்கப்பட்டுள்ளது. பொட்டாசியம் நைட்ரேட்டை பொதுவாக சால்ட் பீட்டர் என்பார்கள். சோடியம் நைட்ரேட்டை இதிலிருந்து வேறுபடுத்திக் காட்டவே சிலி சால்ட்பீட்டர் என்று இதை அழைக்கிறார்கள். இதனுடைய கனிம வடிவங்கள் நைட்ரேடின், நைட்ரேடைட் அல்லது சோடா நைட்டர் என்ற பெயர்களால் அறியப்படுகின்றன. சோடியம் நைட்ரேட்டு வெண்மை நிறத்தில் திண்மமாக காணப்படுகிறது. இது தண்ணீரில் மிகவும் நன்றாகக் கரையக்கூடியது ஆகும். நைட்ரேட்டு எதிர்மின் அயனிகளை (NO3−) உடனடியாக கொடுக்கக்கூடிய மூல உப்பாக இது காணப்படுகிறது. இது பல வேதிவினைகளில் பெரிதும் பயன்படுகிறது. உரங்கள், வானவெடிகள், புகைக் குண்டுகள், கண்ணாடி, மண்பாண்ட மிளிரிகள், உணவுபாதுகாப்புப் பொருள்கள், திண்ம ஏவுர்தி உந்திகள் போன்றவற்றை பெருமளவில் தயாரிக்க சோடியம் நைட்ரேட்டு பயன்படுகிறது. திண்ம ஏவுர்தி உந்தி என்ற பயனுக்காகவே இது முக்கியமாகத் தயாரிக்கப்படுகிறது.
வரலாறு
[தொகு]1820 அல்லது 1825 ஆம் ஆண்டில் எசுப்பானியாவிடமிருந்து சுதந்திரம் பெற்ற பிறகு, ஐரோப்பாவிற்கான பெருவின் சால்ட்பிட்டர் உப்பின் முதல் சரக்கு கப்பல் இங்கிலாந்திற்கு வந்தது, ஆனால் அதை வாங்குபவர்கள் எவரும் காணப்படாத காரணத்தால் சுங்க இழப்பைத் தவிர்ப்பதற்காக கடலில் கொட்டப்பட்டது [2][3]. ஆயினும், காலப்போக்கில் தென் அமெரிக்க சுரங்கங்களில் தோண்டி எடுக்கப்பட்ட சால்ட்பீட்டர் ஓர் இலாபகரமான வணிகமாக மாறியது. 1859 இல், இங்கிலாந்து மட்டும் 47,000 மெட்ரிக் டன் சால்ட்பீட்டரை வாங்கியது.[3]. பெரு மற்றும் பொலிவியா கூட்டணி நாடுகளுக்கு எதிராக சிலி பசிபிக் போரில் (1879-1884) போராடியதுடன் ஏராளமான சால்ட் பீட்டரை எடுத்துக்கொண்டது. 1919 ஆம் ஆண்டில், ரால்ப் வால்டர் கிரேசுடோன் வேக்ஃகோப் எக்சு-கதிர் படிக ஆய்வியல் மூலம் சால்ட்பீட்டர் உப்பின் படிக கட்டமைப்பை தீர்மானித்தார்.+
மூலங்கள்
[தொகு]சிலி மற்றும் பெரு நாடுகளில் இயற்கையாகத் தோன்றும் சோடியம் நைட்ரேட்டின் பெரும்பகுதி குவிந்துகிடக்கிறது. இங்கு நைட்ரேட்டு உப்புகள் கலீச்சு தாது எனப்படும் கனிமப் படிவுகளில் காணப்படுகின்றன. பெருங்கடல் மூடுபனி விழ்படிவாதல் மற்றும் கடல் தெளிப்பு ஆக்சிசனேற்றம் அல்லது உலர்தல் போன்ற செயல்முறைகளைத் தொடர்ந்து காற்றில் எடுத்துச் செல்லப்பட்ட சோடியம் நைட்ரேட்டு, பொட்டாசியம் நைட்ரேட்டு, சோடியம் குளோரைடு, சோடியம் சல்பேட்டு போன்றவையும் வீழ்படிவானதால் இப்பகுதிகளில் சோடியம் நைட்ரேட்டு அதிக அளவில் காணப்படுகிறது. ஒரு நூற்றாண்டு காலமாக அட்டகாமா பாலைவனத்தில் இருந்துதான் உலகின் பெரும்பகுதி சோடியம் நைட்ரேட்டு கிடைக்கிறது. செருமானிய வேதியலர்கள் பிரிட்சு ஏபர் மற்றும் காரல் போசெ இருவரும் சேர்ந்து வளிமண்டலத்தில் இருந்து பேரளவில் அமோனியம் தயாரிக்கும் செயல்முறையை உருவாக்கினர். முதலாம் உலகப் போர் தொடங்கியதும் இதிலிருந்து சால்ட்பீட்டரை செருமனி தயாரிக்கத் தொடங்கியது. 1940 களில் இம்மாற்றச் செயல்முறையினால் சோடியம் நைட்ரேட்டை இயற்கை மூலங்களின் வழியாக தயாரிப்பதை ஊக்குவித்தது. நைட்ரிக் அமிலத்தை சோடியம் கார்பனேட்டுடன் சேர்த்து நடுநிலையாக்கம் செய்தும் தொழிற்சாலைகளில் சோடியம் நைட்ரேட்டு தயாரிக்கப்படுகிறது. இதற்காக சோடியம் பைகார்பனேட்டையும் பயன்படுத்துகிறார்கள்.
- 2 HNO3 + Na2CO3 → 2 NaNO3 + H2O + CO2
- HNO3 + NaHCO3 → NaNO3 + H2O + CO2
நைட்ரிக் அமிலத்தை சோடியம் ஐதராக்சைடு கொண்டு நடுநிலையாக்கம் செய்தும் தொழிற்சாலைகளில் சோடியம் நைட்ரேட்டு தயாரிக்கப்படுகிறது. இவ்வினை ஒரு வெப்பம் உமிழ் வினையாகும்.
- HNO3 + NaOH → NaNO3 + H2O
அமோனியம் நைட்ரேட்டுடன் விகிதவியல் அளவுகளில் சோடியம் ஐதராக்சைடு, சோடியம் பைகார்பனேட்டு அல்லது சோடியம் கார்பனேட்டு சேர்த்தும் சோடியம் நைட்ரேட்டு தயாரிக்கப்படுகிறது.
- NH4NO3 + NaOH → NaNO3 + NH4OH
- NH4NO3 + NaHCO3 → NaNO3 + NH4HCO3
- 2NH4NO3 + Na2CO3 → 2NaNO3 + (NH4)2CO3
பயன்கள்
[தொகு]சோடியம் நைட்ரேட் ஒரு வெண்மை நிற திண்மம் ஆகும். நீரில் மிகவும் கரையும் தன்மை உடையது.நைட்ரேட் எதிரயனி (NO3−), உரங்கள் தயாரிப்பதற்கும், வானவேடிக்கை நிகழ்ச்சிகள் மற்றும் புகை குண்டுகள், கண்ணாடி மற்றும் மட்பாண்ட புச்சுகள், உணவு பதப்படுத்திகள் (குறிப்பாக.இறைச்சிகள்), என பல தொழில்துறை உற்பத்திகளில் பயன்படுகிறது. பொட்டாசியம் நைட்ரேட்டு மற்றும் லால்சியம் நைடரேட்டுடன் சோடியம் நைட்ரேட்டைச் சேர்த்து வெப்ப மாறற வினைகளில் பயன்படுத்துகிறார்கள். வானவெடிகளில் பொட்டாசியம் நைட்ரேட்டுக்குப் பதிலாக இதை ஆக்சிசனேற்றியாகப் பயன்படுத்துகிறர்கள். உணவுக் கூட்டுப் பொருளாகவும் இதைப் பயன்படுத்துகிறார்கள். காய்கறிகள் மற்றும் பழங்களில் இருந்து மனிதனுக்குத் தேவையான நைட்ரேட்டுகள் கிடைக்கின்றன. சில நோய்களில் நைட்ரேட்டின் அளவு அதிகரிக்கும் போது உயிருக்கு ஆபத்து ஏற்படுவதும் உண்டு.
மேலும் காண்க
[தொகு]- பசிபிக் போர், மேலும் "சால்ட்பீட்டர் போர்" என அழைக்கப்படும்.
மேற்கோள்கள்
[தொகு]- ↑ 1.0 1.1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. பன்னாட்டுத் தரப்புத்தக எண் 0-618-94690-X.
- ↑ S. H. Baekeland "Några sidor af den kemiska industrien" (1914) Svensk Kemisk Tidskrift, p. 140.
- ↑ 3.0 3.1 Friedrich Georg Wieck, Uppfinningarnas bok (1873, Swedish translation of Buch der Erfindungen), vol. 4, p. 473.
கூடுதல் வாசிப்பு
[தொகு]- Barnum, Dennis (2003). "Some History of Nitrates". Journal of Chemical Education 80 (12): 1393–. doi:10.1021/ed080p1393. Bibcode: 2003JChEd..80.1393B. https://archive.org/details/sim_journal-of-chemical-education_2003-12_80_12/page/1393.
வெளி இணைப்புகள்
[தொகு]- ATSDR – Case Studies in Environmental Medicine – Nitrate/Nitrite Toxicity U.S. Department of Health and Human Services (public domain)
- FAO/WHO report
- Calculators: surface tensions, and densities, molarities and molalities of aqueous sodium nitrate
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 | RONO2 | NO− 3 NH4NO3 | HOONO2 | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 | Co(NO3)2 Co(NO3)3 | Ni(NO3)2 | CuNO3 Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | Mo | Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2 Pd(NO3)4 | AgNO3 Ag(NO3)2 | Cd(NO3)2 | In(NO3)3 | Sn(NO3)4 | Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | Ta | W | Re | Os | Ir | Pt(NO3)2 Pt(NO3)4 | Au(NO3)3 | Hg2(NO3)2 Hg(NO3)2 | TlNO3 Tl(NO3)3 | Pb(NO3)2 | Bi(NO3)3 BiO(NO3) | Po(NO3)4 | At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 | Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)3 | Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | No | Lr | |||