Sodyum klorat
 Vikipedi, özgür ansiklopedi
Vikipedi, özgür ansiklopedi
 | |
 | |
 | |
| Adlandırmalar | |
|---|---|
Sodyum klorat | |
Diğer adlar Sodyum(V) klorat | |
| Tanımlayıcılar | |
3D model (JSmol) | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.989 |
| EC Numarası |
|
| KEGG | |
| MeSH | Sodium+chlorate |
PubChem CID | |
| RTECS numarası |
|
| UNII | |
| UN numarası | 1495, 2428 |
CompTox Bilgi Panosu (EPA) | |
| |
| |
| Özellikler | |
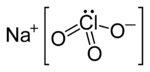
| Molekül formülü | NaClO3 |
| Molekül kütlesi | 106,44 g mol−1 |
| Görünüm | Renksiz veya beyaz katı, higroskopik |
| Koku | Kokusuz |
| Yoğunluk | 2,49 g/cm3 (15 °C)[1] 2.54 g/cm3 (20.2 °C)[2] |
| Erime noktası | 248-261 °C (478-502 °F; 521-534 K) |
| Kaynama noktası | 300-400 °C (572-752 °F; 573-673 K) bozunur[1] |
| Çözünürlük (su içinde) | 79 g/100 mL (0 °C) 89 g/100 mL (10 °C) 105,7 g/100 mL (25 °C) 125 g/100 mL (40 °C) 220,4 g/100 mL (100 °C)[3] |
| Çözünürlük | Gliserin, hidrazin, metanolde çözünür. Etanol, amonyakta az çözünür[1] |
| Çözünürlük (aseton içinde) | Az çözünür[1] |
| Çözünürlük (gliserin içinde) | 20 g/100 g (15,5 °C)[1] |
| Çözünürlük (etanol içinde) | 14,7 g/100 g[1] |
| Buhar basıncı | <0,35 mPa[2] |
| −34,7•10−6 cm3/mol | |
| Kırınım dizimi (nD) | 1,515 (20 °C)[4] |
| Yapı | |
| kübik[5] | |
| P213 | |
a = 6,57584 Å | |
Formül birimleri (Z) | 4 |
| Termokimya | |
Isı sığası (C) | 104,6 J/mol•K[1] |
Standart molar entropi (S⦵298) | 129,7 J/mol•K[1] |
Standart formasyon entalpisi (ΔfH⦵298) | -365,4 kJ/mol[1] |
Gibbs serbest enerjisi (ΔfG⦵) | -275 kJ/mol[1] |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| Piktogramlar |    [6] [6] |
| İşaret sözcüğü | Tehlike |
| Tehlike ifadeleri | H271, H302, H411[6] |
| Önlem ifadeleri | P220, P273[6] |
| NFPA 704 (yangın karosu) | |
| Parlama noktası | Yanıcı değil |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz) | 6500 mg/kg (sıçan, oral) 700 mg/kg (köpek, oral)[1] |
| Güvenlik bilgi formu (SDS) | ICSC 1117 |
| Benzeyen bileşikler | |
Diğer anyonlar | Sodyum klorür Sodyum hipoklorit Sodyum klorit Sodyum perklorat Sodyum bromat Sodyum iyodat |
Diğer katyonlar | Amonyum klorat Potasyum klorat Baryum klorat |
Benzeyen bileşikler | Klorik asit |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
| Bilgi kutusu kaynakları | |
Sodyum klorat NaClO3 kimyasal formülüne sahip bir inorganik bileşiktir. Suda kolayca çözünür, beyaz kristal bir tozdur. Higroskopiktir. Sodyum klorat 300 °C’nin üzerinde ayrışarak oksijen[4] ve sodyum klorür ortaya çıkar. Özellikle, çok parlak kâğıt imal etmek için ağartma hamurundaki uygulamalara yönelik olarak yılda birkaç yüz milyon ton üretilmektedir.[7]
Sentezi[değiştir | kaynağı değiştir]
Endüstriyel olarak sodyum klorat, sıcak bir sodyum klorür çözeltisinin elektrolizi ile üretilir:[7] NaCl + 3 H2O → NaClO3 + 3 H2
Bu reaksiyon, sıcakta (en az 70 °C) ve kontrollü pH’da ilerler. Daha düşük sıcaklıkta veya yüksek pH ile başka bir reaksiyon oluşur:
- 2 NaCl + H2O → NaClO + NaCl + H2
Sodyum klorat işlemi, sodyum hidroksit ve klor gazının elektrolitik üretimi için endüstriyel bir işlem olan kloralkali işlemi ile karıştırılmamalıdır.
Klor gazı bir sodyum hidroksit çözeltisinden geçirilerek de sentezlenebilir. Daha sonra kristalleştirme ile saflaştırılır.
Kullanımı[değiştir | kaynağı değiştir]
Sodyum kloratın ana ticari kullanımı klor dioksit (ClO2) yapımıdır. Klorat kullanımının yaklaşık % 95'ini oluşturan en büyük ClO2 uygulaması, kâğıt hamurunun ağartılmasıdır. Endüstriyel olarak tüm perklorat bileşikleri, sodyum klorat çözeltilerinin elektrolizi ile oksidasyona uğratılmak suretiyle üretilir.[7]
Herbisit olarak kullanımı[değiştir | kaynağı değiştir]
Sodyum klorat, seçici olmayan bir herbisit olarak kullanılır. Tüm yeşil bitki kısımları için fitotoksik olarak kabul edilir. Ayrıca kök emilimi yoluyla da öldürebilir.
Sodyum klorat tarla sarmaşığı, köygöçüren, kanyaş, bambu, kanarya otu ve sarı kantaron gibi çeşitli yabancı otları kontrol etmek için kullanılabilir. Herbisit esas olarak, for spot treatment ürün olmayan boş arazilerde mevki ilaçlamaları ve yol kenarları, otoyollar ve hendekler gibi alanlarda tüm bitkilerin kontrolü için total bir herbisit olarak kullanılır. Sodyum klorat ayrıca aşağıdaki kültür bitkileri için defoliant ve kurutucu madde olarak kullanılır
Atrazin ile kombinasyon halinde kullanılırsa, etkinin sürekliliğini arttırır. 2,4-D ile birlikte kullanılırsa, performans artırılır. Sodyum kloratın toprak sterilleştirici etkisi vardır. Sulu çözeltide diğer herbisitlerle karıştırılması, oksidasyona duyarlı olmadıkları sürece bir dereceye kadar mümkündür.
Ot ilacı olarak sodyum kloratın satışı, 2009 yılında Avrupa Birliği'nde sağlık tehlikeleri nedeniyle yasaklandı.[8]
Kimyasal oksijen üretimi[değiştir | kaynağı değiştir]
Ticari uçaklarda olduğu gibi kimyasal oksijen jeneratörü, kabin basıncındaki düşmelerden korunmaları için yolculara acil oksijen sağlar. Oksijen, sodyum kloratın yüksek sıcaklıkta ayrışmasıyla üretilir:[9] 2 NaClO3 → 2 NaCl + 3 O2
Bu reaksiyonu başlatmak için gereken ısı, sodyum klorat ile karıştırılmış az miktarda demir tozunun oksidasyonu ile üretilir ve reaksiyon, üretilenden daha az oksijen tüketir. Baryum peroksit (BaO2) , ayrışmada önemsiz bir ürün olan kloru absorbe etmek için kullanılır.[10] Acil durum maskesi çekildiğinde bir ateşleyici şarjı etkinleştirir. Benzer şekilde Solidox kaynak sistemi, oksijen üretmek için yanıcı liflerle karıştırılmış sodyum klorat topakları kullandı.
Oksijensiz yanma[değiştir | kaynağı değiştir]
Sodyum klorat, baruta benzer, hava geçirmez alanlarda yanan oldukça patlayıcı bir yakıt yapmak için sakkaroz şekeri ile karıştırılabilir. Bu reaksiyon şöyledir:
8 NaClO3 + C12H22O11 → 8 NaCl + 12 CO2 + 11 H2O
Bununla birlikte, sodyum klorat nem çekici olduğu için çoğunlukla potasyum klorat ile değiştirilir.
İnsanlarda zehirlilik[değiştir | kaynağı değiştir]
Oksidatif doğası nedeniyle, sodyum klorat yutulursa çok toksik olabilir. Hemoglobin üzerindeki oksidatif etki metemoglobin oluşumuna yol açar. Bunu, globin proteininin denatürasyonu ve eritrosit membran proteinlerinin membran enzimlerine zarar veren çapraz bağlanması izler. Bu durum, membranın geçirgenliğinin artmasına ve ciddi hemolize yol açar. Hemoglobinin denatürasyonu, G6PD metabolik yolunun kapasitesini aşar. Ayrıca, bu enzim, aktivitesini azaltarak klorat ile doğrudan denatüre edilir.
Askorbik asit ve metilen mavisi ile terapi methemoglobinemi tedavisinde kulanılır. Bununla birlikte, metilen mavisi, G6PD sisteminin normal işleyişini gerektiren NADPH varlığını gerektirdiğinden, hemoglobin oksidasyonu ile karakterize edilen diğer koşullardan daha az etkilidir.
DIC ve böbrek yetmezliği dahil olmak üzere çoklu organ yetmezliği ile birlikte akut ciddi hemoliz sonuçları baş gösterir. Ayrıca, proksimal renal tübüle doğrudan bir zehirlilik vardır.[11] Tedavi kan değişimi, periton diyalizi veya hemodiyalizden oluşacaktır.[12]
Formülasyonları[değiştir | kaynağı değiştir]
Sodyum klorat toz, sprey ve granül formülasyonlarında piyasaya sürülür. Kuru karışımlarda diğer madelerle, özellikle organik maddeler ve diğer herbisitler, kükürt, fosfor, metal tozları ve kuvvetli asitlerle yangın ve patlama riski vardır. Özellikle şekerle karıştırıldığında patlayıcı özelliklere sahiptir. Bu maddelerden biriyle yanlışlıkla karıştırılırma riskinden dolayı konutlarda saklanmamalıdır.[13]
Pazarlanan formülasyonlar bir yangın geciktirici içerir. Ancak, kasten tutuşturulursa bunun çok az etkisi vardır. Ticari olarak satılan klorat ot ilaçlarının çoğu, yaklaşık% 53 sodyum klorat ve geri kalanı sodyum metaborat veya amonyum fosfatlar gibi bir yangın baskılayıcı içerir.
Ticari adları[değiştir | kaynağı değiştir]
Sodyum klorat, çeşitli ticari herbisitlerde aktif maddedir. Sodyum klorat içeren ürünler için bazı ticari isimler Atlacide, Defol, De-Fol-Ate, Drop-Leaf, Fall, Harvest-Aid, Kusatol, Leafex ve Tumbleaf'dir. Bileşik, atrazin, 2,4-D, bromacil, diuron ve sodyum metaborat gibi diğer herbisitlerle kombinasyon halinde kullanılabilir.
Sodyum klorat, AB Yönetmelikleri uyarınca verilen bir karardan sonra yasaklandığı 2009 yılına kadar AB içinde yaygın olarak kullanılan bir ot ilacı idi. AB dışındaki ülkelerde bir herbisit olarak kullanımı bu durumdan etkilenmez. AB ülkelerinde ise, klor dioksit biyositlerinin üretimi ve kağıt hamuru ve kağıt ağartma gibi diğer herbisit olarak tüketilmeyen uygulamalarda kullanımı devam etmektedir.
Kültürel referanslar[değiştir | kaynağı değiştir]
Yeni Zelanda’daki Massey Üniversitesi’nden tarihçi James Watson, 1930’larda kanarya otunu kontrol etmek için herbisit olarak kullanılan sodyum klorat nedeniyle oluşan kazalar hakkında, çok ilgi gören ve konuşulan "Mr. Richard Buckley'in Patlayan Pantalonlarının Önemi"[14][15] adlı makaleyi yazdı.[16] Bu daha sonra 2005 yılında, ona Ig Nobel Ödülünü kazandırdı,[17] ve MythBusters’ın Mayıs 2006 "Patlayan Pantolonlar" bölümünün temelini oluşturdu.
Ayrıca bakınız[değiştir | kaynağı değiştir]
Kaynakça[değiştir | kaynağı değiştir]
- ^ a b c d e f g h i j k "Arşivlenmiş kopya". 25 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Haziran 2020.
- ^ a b "GPS Safety Summary of Sodium Chlorate" (PDF). arkema.com. Arkema. 25 Mayıs 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 25 Mayıs 2014.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand.
- ^ a b Şablon:PubChemLink
- ^ S. C. Abrahams, J. L. Bernstein (1977). "Remeasurement of Optically Active NaClO3 and NaBrO3". Acta Crystallographica. B33: 3601-3604. doi:10.1107/S0567740877011637
 .
. - ^ a b c Sigma-Aldrich Co., Sodium chlorate. Retrieved on 2014-05-25.
- ^ a b c Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone “Chlorine Oxides and Chlorine Oxygen Acids” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. DOI:10.1002/14356007.a06_483
- ^ "Sodium chlorate banned by EC". Horticulture Week. 28 Ağustos 2008. 20 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Haziran 2020.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. bas.). Butterworth-Heinemann. ISBN 0080379419.
- ^ Yunchang Zhang; Girish Kshirsagar; James C. Cannon (1993). "Functions of Barium Peroxide in Sodium Chlorate Chemical Oxygen". Ind. Eng. Chem. Res. 32 (5): 966-969. doi:10.1021/ie00017a028.
- ^ Oliver J.; MacDowell M., Tracy A (1951). "THE PATHOGENESIS OF ACUTE RENAL FAILURE ASSOCIATED WITH TRAUMATIC AND TOXIC INJURY. RENAL ISCHEMIA, NEPHROTOXIC DAMAGE AND THE ISCHEMURIC EPISODE". J Clin Invest. 30 (12): 1307-439. doi:10.1172/JCI102550. PMC 441312 $2. PMID 14897900.
- ^ Goldfrank's Toxicologic Emergencies, McGraw-Hill Professional; 8th edition (March 28, 2006), 978-0-07-143763-9
- ^ Beveridge, Alexander (1998). Forensic Investigation of Explosions. Taylor & Francis Ltd. ISBN 0-7484-0565-8.
- ^ "The Significance of Mr. Richard Buckley's Exploding Trousers: Reflections on an Aspect of Technological Change in New Zealand Dairy Farming between the World Wars" 23 Ekim 2013 tarihinde Wayback Machine sitesinde arşivlendi., Agricultural History magazine
- ^ "Histories: Farmer Buckley's exploding trousers" 22 Ekim 2012 tarihinde Wayback Machine sitesinde arşivlendi., New Scientist
- ^ "Trousers Explode 24 Temmuz 2020 tarihinde Wayback Machine sitesinde arşivlendi., Evening Post, 21 April 1933
- ^ James Watson for "The Significance of Mr. Richard Buckley’s Exploding Trousers." 30 Ağustos 2009 tarihinde Wayback Machine sitesinde arşivlendi., improbable.com
Daha fazla bilgi için[değiştir | kaynağı değiştir]
- "Chlorate de potassium. Sodyum klorat", Fiche toxicol. n° 217, Paris:Institut national de recherche et de sécurité, 2000. 4pp.
Dış bağlantılar[değiştir | kaynağı değiştir]
| Wikimedia Commons'ta Sodyum klorat ile ilgili ortam dosyaları bulunmaktadır. |
- Uluslararası Kimyasal Güvenlik Kartı 111731 Ocak 2018 tarihinde Wayback Machine sitesinde arşivlendi.
