Бензойная кислота

| Бензойная кислота | |||
|---|---|---|---|
 | |||
 | |||
| Общие | |||
| Систематическое наименование | Бензойная кислота | ||
| Традиционные названия | Бензойная кислота | ||
| Хим. формула | C6H5COOH | ||
| Рац. формула | C7H6O2 | ||
| Физические свойства | |||
| Состояние | Твёрдое | ||
| Молярная масса | 122.12 г/моль | ||
| Плотность | 1.32 г/см³ | ||
| Энергия ионизации | 9,47 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 122.4 °C | ||
| • кипения | 249.2 °C | ||
| • разложения | 370 °C | ||
| • вспышки | 121 °C[1] | ||
| • самовоспламенения | 570 °C[1] | ||
| Удельная теплота испарения | 527 Дж/кг | ||
| Удельная теплота плавления | 147400 Дж/кг | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 4.20 | ||
| Растворимость | |||
| • в воде | 0,29 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,504[3] | ||
| Структура | |||
| Дипольный момент | 1.72 Д | ||
| Классификация | |||
| Рег. номер CAS | 65-85-0 | ||
| PubChem | 243 и 20144841 | ||
| Рег. номер EINECS | 200-618-2 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E210 | ||
| RTECS | DG0875000 | ||
| ChEBI | 30746 | ||
| ChemSpider | 238 | ||
| Безопасность | |||
| Токсичность | LD50 500 mg·kg−1 | ||
| Пиктограммы СГС | | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бензо́йная кислота́ (химическая формула — C7H6O2 или C6H5СООН) — cлабая химическая органическая кислота, это простейшая одноосновная карбоновая кислота, относящаяся к классу карбоновых кислот ароматического ряда.
При стандартных условиях, бензойная кислота — твёрдое кристаллическое вещество белого цвета.
Соли и сложные эфиры бензойной кислоты называются бензоа́тами.
Зарегистрирована в качестве пищевой добавки и консерванта с номером Е210.
История
[править | править код]Впервые выделена возгонкой в 16 веке из бензойной смолы (росного ладана), отсюда и получила своё название. Этот процесс был описан у Нострадамуса (1556), а затем у Жироламо Рушелли (1560, под псевдонимом Alexius Pedemontanus) и у Блеза де Виженера (1596).
В 1832 году немецкий химик Юстус фон Либих определил структуру бензойной кислоты. Он также исследовал, как она связана с гиппуровой кислотой.
В 1875 немецкий физиолог Эрнст Леопольд Зальковский исследовал противогрибковые свойства бензойной кислоты, которая долгое время использовалась при консервировании фруктов.
Физические свойства
[править | править код]Бензойная кислота — белые кристаллы, плохо растворимые в воде, хорошо — в этаноле, хлороформе и диэтиловом эфире. Бензойная кислота является, подобно большинству других органических кислот, слабой кислотой (pKa 4,21).
Чистая кислота имеет температуру плавления — 122,4 °C, температуру кипения — 249 °C.
Легко возгоняется; перегоняется с водяным паром, поэтому неэффективно повышать концентрацию водных растворов бензойной кислоты упариванием раствора.
Реакционная способность
[править | править код]Реакционная способность бензойной кислоты определяется реакционной способностью карбоксильной и фенильной группы.
Реакции по фенильной группе
[править | править код]Электрофильное ароматическое замещение происходит труднее, чем в случае бензола и толуола и направляется в мета-положение из-за электроноакцепторных свойств карбоксильной группы.
Второе замещение в случае электронакцепторных заместителей происходит сложнее благодаря деактивации заместителем и направляется в незанятое мета-положение. Так, для сульфирования бензойной кислоты до 3,5-дисульфокислоты происходит в избытке олеума в течение 5 часов при 240—250 °C[4].
Наоборот, при введении электронодонорного заместителя (например, алкила), второе замещение происходит легче.
При восстановлении натрием в смеси жидкого аммиака и этанола происходит восстановление бензойной кислоты до 1,4-дигидробензойной кислоты (2,5-циклогексадиен-1-карбоновой кислоты) с выходом 89—95 %[5].
Реакции карбоксильной группы
[править | править код]Бензойная кислота является типичной карбоновой кислотой и вступает в реакции, характерные для них:
- Этерефицирует спирты с образованием сложных эфиров при катализе кислотами.
- Амиды бензойной кислоты легко доступны, используя для их синтеза активированные производные(такие как бензоилхлорид), или сочетающие реагенты используемые в пептидном синтезе такие как ДЦГК и ДМАП.
- Более активный бензойный ангидрид образуется при дегидратации уксусным ангидридом или оксидом фосфора
- Высокоактивные галогенангидриды легко получаются действием хлоридом фосфора(V) или тионилхлорида
- Ортоэфиры могут быть получены в сухих условиях реакцией бензонитрила в кислой среде со спиртами
- Восстановление до бензальдегида или бензилового спирта возможно при использовании LiAlH4 или борогидрида натрия
- Декарбоксилирование серебряной соли может быть проведено при нагревании, бензойная кислота может быть декарбоксилирована при нагревании с сухими щёлочами или гидроксидом кальция.
- Бензойная кислота образует соли
Получение
[править | править код]Промышленные методы
[править | править код]Первый производственный процесс включал в себя гидролиз бензолтрихлорида под действием гидроксида кальция в воде в присутствии железа или его солей в качестве катализатора. Образующийся бензоат кальция переводили в бензойную кислоту обработкой соляной кислотой. Продукт содержал значительное количество примесей хлорпроизводных бензойной кислоты.
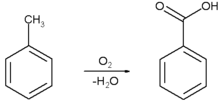
В настоящее время бензойную кислоту получают окислением толуола кислородом воздуха. Окисление толуола до бензойной кислоты для производства бензойной кислоты начало использоваться в 1940-х годах в Германии[6], в настоящее время процесс проводят в присутствии катализатора — растворимого в толуоле нафтената кобальта, реакцию проводят при 100—150 °C и давлении ~3 бар[7]:
Лабораторный синтез и очистка
[править | править код]Ввиду того, что бензойная кислота является крупнотоннажным продуктом химической промышленности, лабораторные методы её синтеза практического значения не имеют.
Очистку бензойной кислоты удобно проводить перекристаллизацией из растворителя, обычно, из воды. Другие растворители, пригодные для перекристаллизации: уксусная кислота (ледяная и водный раствор), бензол, ацетон, петролейный эфир и смесь этанола с водой.
Гидролиз
[править | править код]Бензамид и бензонитрил гидролизуются в воде в присутствии кислоты или основания до бензойной кислоты.
Бензальдегид в основной среде претерпевает преобразование по реакции Канниццаро. В итоге получается бензойная кислота и бензиловый спирт.
Из бромбензола по реакции карбоксилирования фенилмагнийбромида:
- .
Окисление
[править | править код]Толуол или бензиловый спирт могут быть окислены подкисленным раствором перманганата калия до бензойной кислоты:
- .
Применение
[править | править код]Калориметрия
[править | править код]Бензойная кислота используется как вещество в качестве теплового стандарта для калибровки калориметров по температуре и теплоёмкости, так как теплота кристаллизации и плавления хорошо известны и воспроизводимы.
Сырьё
[править | править код]Бензойная кислота служит для получения многих реактивов, наиболее значимые из них:
- Бензоилхлорид, C6H5C(O)Cl, получается обработкой бензойной кислоты тионилхлоридом, фосгеном или хлоридами фосфора PCl3 и PCl5. C6H5C(O)Cl — важное исходное вещество для некоторых производных бензойной кислоты, таких как бензилбензоат, используемый как искусственный ароматизатор и репеллент.
- Бензоатные пластификаторы, такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры, получаемые переэтерефикацией метилбензоата с соответствующим диолом. Альтернативно эти вещества получаются действием бензоилхлорида на соответствующий диол. Эти пластификаторы используются совместно с соответствующими эфирами терефталевой кислоты.
- Фенол, C6H5OH, получаемый окислительным декарбоксилированием при 300—400 °C. Необходимая температура может быть понижена до 200 °C добавлением каталитических количеств солей меди (II). Далее фенол может быть конвертирован в циклогексанол, который служит исходным веществом в синтезе нейлона.
Консервант
[править | править код]Бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213).
Бензойная кислота, блокируя ферменты, замедляет обмен веществ во многих одноклеточных микроорганизмах и грибках. Она подавляет рост плесени, дрожжей и некоторых бактерий.
В пищевые продукты её добавляют в чистом виде или в виде натриевой, калиевой или кальциевой соли.
Губительное действие на микрофлору начинается с абсорбции бензойной кислоты липидной стенкой клетки.
Поскольку через стенку клетки может проникнуть только недиссоциированная кислота, бензойная кислота проявляет антимикробное действие только в кислых пищевых продуктах.
Если внутриклеточный pH 5 или меньше, анаэробная ферментация глюкозы через фосфорфруктокиназу уменьшается на 95 %. Эффективность бензойной кислоты и бензоатов зависит от кислотности (pH) пищи.
Кислая пища, напитки, такие, как фруктовые соки, (содержащие лимонную кислоту), газированные напитки, содержащие в растворе (углекислый газ), безалкогольные напитки с (фосфорной кислотой), соленья (молочная кислота) и другие кислые пищевые продукты консервируются бензойной кислотой и её солями.
Принятые и оптимальные концентрации бензойной кислоты при консервации пищи 0,05—0,1 %.
Медицина
[править | править код]Бензойную кислоту применяют в медицине при кожных заболеваниях, как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, при трихофитиях и микозах, а её натриевую соль, — бензоат натрия — как отхаркивающее средство.
Другие применения
[править | править код]Эфиры бензойной кислоты (со спиртами от метилового до амилового) обладают сильным и приятным запахом и применяются в парфюмерной промышленности.
Некоторые другие производные бензойной кислоты, такие как, например, хлор- и нитробензойные кислоты, широко применяются для синтеза красителей.
Нахождение в природе
[править | править код]Бензойная кислота в свободном виде и виде сложных эфиров встречается в составе многих растений и животных. Значительное количество бензойной кислоты находится в ягодах (около 0,05 %). Зрелые плоды некоторых видов вакциниума содержат большое количество свободной бензойной кислоты. Например, в бруснике до 0,20 % в спелых ягодах, а в клюкве — до 0,063 %. Бензойная кислота образуется в яблоках после заражения грибком Nectria galligena. Среди животных бензойная кислота обнаружена в основном во всеядных или фитофагных видах, например, во внутренних органах и мускулах тундряной куропатки (Lagopus muta), а также в выделениях самцов овцебыка или азиатского слона.
Бензойная смола содержит до 20 % бензойной кислоты и 40 % бензойных эфиров.
Бензойная кислота присутствует наряду с гиппуровой кислотой (N-бензоилглицин) в моче млекопитающих, особенно травоядных животных.
Безопасность
[править | править код]Согласно многочисленным исследованиям, бензойная кислота, её соли и сложные эфиры признаны безопасными для человека в случае адекватного уровня потребления[8][9][10]. Бензойная кислота хорошо всасывается, через коэнзим А связывается с аминокислотой глицином в гиппуровую кислоту и в таком виде выводится через почки. Человек выделяет около 0,44 г/л гиппуровой кислоты в день в моче и больше, если находится в контакте с толуолом или бензойной кислотой. Кошки имеют гораздо более низкую толерантность к бензойной кислоте, чем мыши и крысы[11]. Летальная доза для кошек — 300 мг/кг массы тела. Оральная ЛД50 для крыс 3040 мг/кг, для мышей 1940—2260 мг/кг.
Международная программа химической безопасности, изучая вопрос токсичности бензойной кислоты и её солей, не выявила каких-либо побочных эффектов у людей в дозах 647—825 мг/кг массы тела в сутки[8]. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) считает бензойную кислоту как «общепризнанную безопасную» (GRAS) в США в качестве противомикробного средства, ароматизатора и пищевой добавки в продуктах питания с максимальным уровнем использования в 0,1 %[12]. Её также можно безопасно использовать в кормах для животных в качестве консерванта или подкислителя[13]. В 1996 году Объединённый экспертный комитет ФАО/ВОЗ по пищевым добавкам (JECFA) установил допустимое суточное потребление (ДСП) для бензойной кислоты в количестве 5 мг/кг массы тела[10]. В 2021 году, проведя переоценку безопасности, JECFA изменил это количество, повысив значение ДСП до 20 мг/кг массы тела[10]. Бензойная кислота (E210) указана в Постановлении Комиссии (ЕС) № 231/2012 в качестве разрешённой пищевой добавки и отнесена к категории «Добавки, отличные от красителей и подсластителей»[14]. В 2016 году, Европейское агентство по безопасности продуктов питания (EFSA), проводя свою переоценку безопасности, установило ДСП для Е210 в количестве 5 мг/кг массы тела[9].
Бензойная кислота может вызвать аллергические реакции: симптомы раздражения, такие как сыпь, покраснение или чувство жжения при попадании в глаза и на кожу, а также при вдыхании[15]. В отличие от бензоата натрия (Е211) и бензоата калия (Е212), бензойная кислота не упоминается FDA как вещество, которое может превращаться в бензол при определённых обстоятельствах[16]. Бензойная кислота также не подозревается в гиперактивном поведении детей, в отличие от Е211[17].
Производные
[править | править код]- 2,3-дигидроксибензойная кислота (пирокатехиновая кислота)
- 2,4-дигидроксибензойная кислота (бета-резорциловая кислота)
- 2,5-дигидроксибензойная кислота (гентизиновая кислота)
- 2,6-дигидроксибензойная кислота (гамма-резорциловая кислота)
- 3,4-дигидроксибензойная кислота (протокатехиновая кислота)
- 3,5-дигидроксибензойная кислота (альфа-резорциловая кислота)
- 3-нитробензойная кислота
- 3,5-динитробензойная кислота
- Толуиловые кислоты
Соли
[править | править код]Соли бензойной кислоты называются бензоатами, например:
- Бензоат аммония
- Бензоат лития
- Бензоат натрия
- Бензоат магния
- Бензоат марганца
- Бензоат меди(II)
- Бензоат ртути(II)
- Бензоат свинца(II)
- Бензоат серебра
Примечания
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- Бензойная кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки
[править | править код]- Елена Шаталова. "Среда обитания". "Продукты вечной молодости". — Программа Первого канала. Дата обращения: 22 ноября 2011. Архивировано из оригинала 21 ноября 2011 года.
- https://web.archive.org/web/20130423163348/http://www.nordspb.ru/benzoesaure
Примечания
[править | править код]- ↑ 1 2 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 16—18. — ISBN 978-1-4987-5428-6
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 3—40. — ISBN 978-1-4987-5428-6
- ↑ "3,5-DIHYDROXYBENZOIC ACID". Organic Syntheses. 21: 27. 1941. doi:10.15227/orgsyn.021.0027. ISSN 2333-3553. Дата обращения: 27 марта 2024.
- ↑ "1,4-DIHYDROBENZOIC ACID". Organic Syntheses. 43: 22. 1963. doi:10.15227/orgsyn.043.0022. ISSN 2333-3553. Дата обращения: 27 марта 2024.
- ↑ Ананьева Е. А., Егорова Е. В., Ларин Л. В. Современное состояние и перспективы процессов получения фенола. I. Обзор рынка и современное состояние процессов получения фенола. «Вестник МИТХТ», 2007, т. 2, № 2
- ↑ Wade, Leroy G. Organic Chemistry. — Pearson new international. — Harlow : Pearson Education Limited, 2014. — P. 985. — ISBN 978-1-292-02165-2.
- ↑ 1 2 Final Report on the Safety Assessment of Benzyl Alcohol, Benzoic Acid, and Sodium Benzoate (англ.) // International Journal of Toxicology. — 2001-01. — Vol. 20, iss. 3_suppl. — P. 23–50. — ISSN 1092-874X 1091-5818, 1092-874X. — doi:10.1080/10915810152630729. Архивировано 23 декабря 2021 года.
- ↑ 1 2 EFSA Panel on Food Additives and Nutrient Sources (ANS). Scientific Opinion on the re‐evaluation of benzoic acid (E 210), sodium benzoate (E 211), potassium benzoate (E 212) and calcium benzoate (E 213) as food additives // EFSA Journal. — 2016-03. — Т. 14, вып. 3. — doi:10.2903/j.efsa.2016.4433.
- ↑ 1 2 3 World Health Organization. 92nd JECFA - Chemical and Technical Assessment (CTA), 2021 (англ.) // Food and Agriculture Organization of the United Nations. — 2021. Архивировано 5 марта 2021 года.
- ↑ P. Bedford, E. Clarke. Experimental benzoic acid poisoning in the cat (англ.) // Veterinary Record. — 1972-01-15. — Vol. 90, iss. 3. — P. 53–58. — ISSN 2042-7670 0042-4900, 2042-7670. — doi:10.1136/vr.90.3.53.
- ↑ CFR - Code of Federal Regulations Title 21. FDA. Дата обращения: 15 октября 2022. Архивировано 15 октября 2022 года.
- ↑ CFR - Code of Federal Regulations Title 21. FDA. Дата обращения: 15 октября 2022. Архивировано 15 октября 2022 года.
- ↑ Commission Regulation (EU) No 1129/2011 of 11 November 2011 amending Annex II to Regulation (EC) No 1333/2008 of the European Parliament and of the Council by establishing a Union list of food additives (англ.). Дата обращения: 15 октября 2022. Архивировано 13 октября 2022 года.
- ↑ New Jersey Department of Health. Benzoic Acid (2009). Дата обращения: 15 октября 2022. Архивировано 4 мая 2022 года.
- ↑ Center for Food Safety and Applied Nutrition. Questions and Answers on the Occurrence of Benzene in Soft Drinks and Other Beverages (англ.) // FDA. — 2022-02-25. Архивировано 25 декабря 2021 года.
- ↑ Food Colouring Confirmed Bad for Children - Food Standards Agency Refuses to Act. www.i-sis.org.uk. Дата обращения: 25 декабря 2021. Архивировано 25 декабря 2021 года.