DNA dizileme


DNA dizilemesi, bir DNA molekülündeki nükleotit bazlarının (adenin, guanin, sitozin ve timin) sırasının belirlenmesidir.[1]
DNA dizilerinin bilinmesi temel biyoloji, biyoteknoloji, adli bilim, viroloji ve tıbbi tanı koyma gibi pek çok sahada vazgeçilmez hâle gelmiştir. DNA dizilemesi biyolojik araştırma ve keşifleri çok hızlandırmıştır. Sağlıklı ve mutasyona uğramış DNA dizilerinin karşılaştırılması, hasta tedavisine rehberlik edebilir, çeşitli kanserler dahil olmak üzere farklı hastalıkları teşhis edebilir, antikor repertuarını karakterize etmek için kullanılabilir. Modern DNA dizileme teknolojilerin mümkün kıldığı hızlı DNA dizileme sayesinde İnsan Genom Projesi'nde insan genomunun dizilenebilmiştir. Benzer projelerle pek çok hayvan, bitki ve mikrop genomunun tam dizisi üretilebilmiştir.[2]
İlk DNA dizileri 1970'lerin başlarında üniversite araştırmacıları tarafından iki-boyutlu kromatografiye dayanan zahmetli yöntemlerle elde edilmiştir. DNA dizileyici, DNA dizileme sürecini otomatikleştirmek için kullanılan bilimsel bir araçtır.[3] Bu aracı kullanılarak, floresan-tabanlı dizileme yöntemlerinin geliştirilmesinin ardından, DNA dizilemesi daha kolay ve çok daha hızlı hale gelmiştir.[4]
Uygulamalar
[değiştir | kaynağı değiştir]Moleküler biyoloji
[değiştir | kaynağı değiştir]Moleküler biyolojide dizileme, genomu ve kodladığı proteinleri incelemek için kullanılır. Araştırmacıların dizilemeyi kullanarak elde ettikleri bilgiler, genlerdeki ve kodlamayan DNA'daki değişiklikleri tanımlamalarına ve potansiyel ilaç hedeflerini belirlemelerine olanak tanır.[5]
Metagenomikler
[değiştir | kaynağı değiştir]Belirli bir ortamda bulunan organizmaları bilmek ekoloji, epidemiyoloji ve mikrobiyoloji araştırmaları için gereklidir. Bu nedenle metagenomik alanı, örneğin bir su kütlesi, atık su veya diğer kaynaklardan sürüntü numunelerinde bulunan organizmaların tanımlanmasını içerir.[6]
Adli bilim
[değiştir | kaynağı değiştir]1984'te Alec Jeffreys, ailelerdeki genetik hastalıkları incelerken, DNA'nın tekrarlayan modellerinin ve değişken sayıda ardışık tekrarların (VNTR'ler) her insanda mevcut olduğunu fark etti. Her DNA modeli her bireyde farklıydı, bu da Jeffreys'in her bir DNA varyasyonunun belirli bir bireyi tanımlamak için kullanılabileceğini fark etmesine yol açtı. DNA dizileme, DNA profilleme yöntemleri ile birlikte adli kimlik tespiti ve babalık testi için kullanılabilir.[7]
Viroloji
[değiştir | kaynağı değiştir]Çoğu virüs, ışık mikroskobuyla görülemeyecek kadar küçüktür, bu nedenle dizeleme, virüsü tanımlamak ve incelemek için virolojinin anlaşılmasına yardımcı olur. Genom dizilimi için RNA virüsleri, klinik numunelerde daha hızlı bozundukları için zamana daha duyarlıdır.[8]
Temel ve klinik virüs dizileme araştırmalarında, yeni nesil dizileme ve geleneksel Sanger dizilemenin yanı sıra viral patojenlerin moleküler epidemiyolojisinde, ilaç direnci testi ve ortaya çıkan viral enfeksiyonların teşhisi için kullanılır. GenBank'ta 2,3 milyondan fazla benzersiz viral dizi vardır.[9]
Tarih
[değiştir | kaynağı değiştir]DNA yapısı ve işlevinin keşfi
[değiştir | kaynağı değiştir]1869 yılında, deoksiribonükleik asit (DNA) Friedrich Miescher tarafından keşfedildi ve izole edilmiştir. Yaşamın genetik planını DNA'nın değil proteinlerin tuttuğu düşünülmüştür. Buna bağlı olarak daha sonra saflaştırılmış DNA'nın bir bakteri türünü diğerine dönüştürebileceğini, Oswald Avery, Colin MacLeod ve Maclyn McCarty'nin deneyleri sonucunda bu düşünceler değişmişti. İlk kez DNA'nın hücrelerin özelliklerini dönüştürebildiği gösterilmiştir.[1]
1953 yılında James Watson ve Francis Crick, Rosalind Franklin tarafından incelenen kristalize X-ışını yapılarına dayanan çift sarmallı DNA modelini önerdiler. Modele göre DNA, birbirinin etrafına dolanmış, zıt yönlerde uzanan ve hidrojen bağları ile birbirine bağlanmış iki nükleotit zincirinden oluşur. Adenin (A), sitozin (C), guanin (G) ve timin (T) olmak üzere her iplikçik dört tamamlayıcı nükleotitten oluşur. Bir iplikçikte A daima T ile eşleşir, C ise G ile eşleşir.[1][10]
RNA dizileme
[değiştir | kaynağı değiştir]RNA dizilemesi nükleotit dizilemesinin en erken biçimlerinden oldu. RNA dizilemesinin en önemli aşamaları, Gent Üniversitesi'nden (Gent, Belçika) Walter Fiers ve arkadaşlarının, 1972'de Bakteriyofaj MS2'ye ait bir genin, daha sonra 1976'da ise aynı bakteriyofajın tüm genomunun dizisi olmuştur. Geleneksel RNA dizileme yöntemleri, dizilenmesi gereken bir cDNA molekülünün oluşturulmasını gerektirir.[11]
Erken DNA dizileme yöntemleri
[değiştir | kaynağı değiştir]1970 yılında Cornell Üniversitesi'nde Ray Wu tarafından DNA dizisi belirleme için geliştirilen ilk yöntem,[12] bölgeye özgü bir primer uzatma stratejisi içeriyordu. Lambda faj DNA'sının yapışkan uçlarını sıralamak için DNA polimeraz indüksiyonu ve nükleotide özgü işaretleme kullanıldı, bunların her ikisi de mevcut dizileme şemalarında belirgin bir şekilde öne çıkmaktadır. Wu, R. Padmanabhan ve meslektaşları, 1970 ve 1973 yılları arasında, bu yöntemin, sentetik bölgeye özgü primerler kullanarak herhangi bir DNA dizisini tanımlamak için kullanılabileceğini gösterdiler.[13] MRC (Tıbbi Araştırma Konseyi merkezi), Cambridge, Birleşik Krallık'ta, Frederick Sanger daha sonra DNA dizilemesi için daha hızlı yöntemler geliştirmek üzere bu primer uzatma stratejisini benimsedi ve 1977'de "zincir sonlandırma inhibitörleri ile DNA dizilemesi" adlı bir yöntem yayınladı.[1][14] Harvard Üniversitesi'nden Walter Gilbert ve Alan Maxam, kimyasal bozunma yoluyla DNA dizilimini geliştirdiler. Dolaşan benek (wandering-spot) analizi olarak bilinen bir yöntemi kullanarak, 1973'te Gilbert ve Maxam 24 baz çiftinin dizisini bildirdiler.
İkinci nesil DNA dizileme
[değiştir | kaynağı değiştir]Mustafa Ronagi, Matthias Olin ve Paul Neon, 1996 yılında "Termal Dizileme" adı verilen ve ikinci nesil DNA dizilemenin ortaya çıkışı olarak kabul edilen yeni bir DNA dizileme tekniğini tanıttı. Bu teknik, dizileme (sentez dizileme tekniği) sırasında pirofosfat sentezinden kaynaklanan lüminesans ölçümüne dayandığından, yüksek verimli dizileme olarak sınıflandırılabilir.[4][14]
1998 yılında Solexa'yı kuran Shankar Balasubramanian ve David Kleinerman, floresan boyalar kullanan sentez yoluyla yeni bir dizileme yöntemi geliştirdiler. 2007 yılında Illumina, dünyada en yaygın kullanılan NGS teknolojisini sağlamak için yola çıkan ve bugüne kadar NGS platformlarında pazar lideri olan Solexa'yı satın aldı.
Maxam - Gilbert dizilemesi
[değiştir | kaynağı değiştir]1976-1977'de Harvard Üniversitesi'nden Allan Maxam and Walter Gilbert, DNA'nın kimyasal modifikasyonu ve ardından onun spesifik bazlarda kesilmesi esasına dayanan bir DNA dizileme yöntemi geliştirdi.[14][15] Maxam ve Gilbert kimyasal dizileme yöntemi hakkındaki makale, Sanger ve Coulson'un artı-eksi dizilemesi hakkındaki makalesinden iki yıl daha sonra yayınlamasına rağmen,[16][17] Maxam-Gilbert dizilemesi daha popüler oldu. Bunun nedeni, Maxam-Gilbert yönteminde saflaştırılmış DNA'nın doğrudan dizilenebilmesi, buna karşın ilk Sanger yönteminde tek iplikli DNA üretilebilmesi için okunacak her DNA'nın ayrıca klonlanmasının gerekmesiydi. Ancak, zincir sonlandırma yönteminin zaman içinde iyileştirilmesiyle Maxam-Gilbert dizilemesi gözden düştü, zira teknik karmaşıklığı onun standart moleküler biyoloji kitlerinde kullanılmasına olanak vermiyordu, ayrıca zararlı kimyasallara gerek gösteriyordu ve ölçeklenmesinde zordu.[18]
Bu yöntem DNA'nın 5' ucunun radyoaktif olarak işaretlenmesini (bu tipik olarak gamma-32P ATP kullanılan bir kinaz reaksiyonuydu) ve sonra dizilenecek DNA parçasının saflaştırılmasını gerektirir. Dört farklı kimyasal reaksiyonda (G, A+G, C, C+T) uygulanan kimyasal işlemlerle, moleküllerin ufak bir kısmında, DNA'yı oluşturan dört nükleotit bazdan biri veya ikisinde kesikler meydana gelir. Örneğin, pürinler formik asitle depürine edilir, guaninler (ve bir miktar adeninler de) dimetil sülfat ile metillenir, pirimidinler (C+T) hidrazin ile metillenir. Sadece-C reaksiyonunda, hidrazin reaksiyonuna tuz (sodyum klorür) eklenmesi timinin metillenmesini inhibe eder. Modifiye olmuş DNA'lar sonra sıcak piperidin ile modifiye olmuş bazların pozisyonunda kesilir. Modifikasyon yapan kimyasalların konsantrasyonu ayarlanarak DNA molekülü başına ortalama bir modifikasyon olması sağlanır. Böylece bir seri işaretlenmiş DNA parçası elde edilir, bu parçaların bir ucunda radyoaktif işaret, öbür ucunda ise ilk "kesik" yeri olur. Dört reaksiyonda meydana gelen parçalar, denatüran akrilamid jel içinde yan yana elektroforezle ayrıştırılır. Parçaları görselleştirmek için jel bir röntgen filminin üzerine konur, böylece her bir radyoaktif DNA parşasının bulunduğu yere karşılık gelen noktada fotoğraf filmi kararır. Filmde meydan gelen bant serilerinden DNA dizisi çıkarılabilir.[19]
"Kimyasal dizileme" olarak bilinen bu yöntem daha sonradan DNA'ya bağlanan proteinlerin DNA'ya bağlanma yerlerini haritalamak için kullanılan Metilasyon Enterferans Ölçümü'nün temelini oluşturmuştur.[20]
Zincir sonlandırma yöntemleri
[değiştir | kaynağı değiştir]
Zincir sonlandırma yöntemi (veya Sanger yöntemi, onu geliştiren Frederick Sanger'e atfen) Maxam ve Gilbert yöntemine kıyasla daha verimli olduğu, daha az toksik kimyasal ve radyoaktivite gerektirdiği için kısa sürede hızla yaygınlaştı. Sanger yönteminin ana ilkesi zincir sonladırıcı olarak dideoksinükleotit trifosfatlar (ddNTP'ler) kullanılmasıdır.
Klasik zincir sonlandırma yöntemi için tek iplikli bir DNA kalıp, bir DNA primeri, bir DNA polimeraz, normal deoksinükleotitfosfatlar (dNTP'ler) ve DNA zincir büyümesini sonladıran modifiye edilmiş nükleotitler (dideoksiNTP'ler veya kısaca ddNTP'ler) kullanılır. Bu ddNTP'ler otomatik dizileme makinalarında otomatik olarak tespit edilebilmek için radyokatif veya floresan olarak işaretlenir. DNA numunesi dört ayrı dizileme reaksiyonu için paylaştırılır, bunlarda ortak olarak standart deoksinükleotitler (dATP, dGTP, dCTP ve dTTP) ve DNA polimeraz bulunur. Her reaksiyona dört dideoksinükleotit'ten bir tanesi (ddATP, ddGTP, ddCTP veya ddTTP) eklenir. İki nükleotit arasında bir fosfodiester bağı oluşması için gerekli olan 3'-OH, dideoksinükleotitlerde bulunmadığı için bunları içeren bir DNA zinciri daha fazla uzayamayaz. Bu nedenle, çeşitli uzunluklarda DNA zincirlerinin oluşumuyla reaksiyon sona erer.
Yeni sentezlenen ve işaretlenen DNA parçaları ısıtılarak denatüre edilir ve jel elektroforeziyle büyüklüklerine göre ayrıştırılır. Dört reaksiyonun (A, C, G ve T) her birindeki DNA parçaları elektrik alanının etkisiyle jel içinde birbirine paralel ayrı yollardan (bu yollara şerit veya çizgi denir) ilerleyerek ayrıştırılır. Aynı uzunluğa sahip DNA parçları aynı hızda ilerler ve görselleştirildiklerinde (otoradyografi veya mor ötesi ile) birer bant olarak görünürler. Sağdaki resimde jelin üzerine bir röntgen filmi konmuştur, siyah bantlar belli uzunluktaki DNA parçalarına karşılık gelir. Belli bir şeritteki karanlık bant, bir dideoksinükleotitin (ddATP, ddGTP, ddCTP veya ddTTP) zincire dahi edilmesi sonucu sonlanan bir DNA parçasıdır. Dört şeritteki farklı bantların göreceli konumlarına bakılarak DNA dizisi (alttan yukarı doğru) okunabilir.

Zincir sonlandırma dizilemesinin teknik çeşitlemeleri mevcuttur. Radyoaktif fosfor içeren nükleotitler kullanılarak radyoişaretleme yapılabilir veya 5' ucunda floresan boya ile işaretlenmiş bir primer kullanılabilir. Optik bir sistemde yapılan boya-primer dizilemesi sayesinde okuma daha hızlı ve ekonomik yapılabilir ve sistemin otomatizasyonu mümkün olur. Leroy Hood ve arkadaşları tarafından geliştirilen bu sistemler otomatik ve yüksek hacimli DNA dizilemesini mümkün kıldı.[21][22]
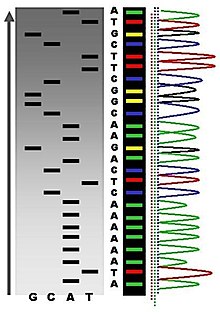
Zincir sonlandırması DNA dizilemesini son derece kolaylaştırmıştır. Örneğin, ticarî olarak elde edilebilen zincir sonlandırma kitlerinde dizileme yapmak için gerekli olan reaktantlar, taksim edilmiş ve kullanıma hazır şekilde bulunur. Yöntemin sınırlı kalabileceği durumlar, (1) primerin DNA'ya non-spesifik bağlanıp DNA dizisinin doğru okunamamasına neden olması ve (2) DNA'daki ikincil yapıların dizinin doğal haline etki etmesidir.
Boya sonlandırmalı dizileme
[değiştir | kaynağı değiştir]
Boya sonlandırmalı dizilemede (İng. Dye-terminator sequencing) zincir sonladırıcı ddNTP'lerin işaretlenir, böylece işaretlenmiş primer yönteminde olduğu gibi dört reaksiyon yerine, dizileme tek bir reaksiyon içinde yürütülebilir. Boya sonlandırma dizilemesinde dört dideoksinükleotit bitiricilerin her biri farklı floresan boyalarla işaretlidir, bunların her biri farklı dalga boylarında ışık salar.
Daha az işlem gerektirdiğinden ve daha hızlı çalıştığından dolayı, günümüzde otomatik dizileme makinalarının çoğunda boya sonlandırma dizilemesi yapılır. Bu yöntemin bazı sınırlamaları vardır, boya işaretli zincir sonlandırıcıların DNA parçasına dahil oluşunda boyadan boyaya farklar mevcuttur, bunun sonucu kapiler elektroforezde elde edilen dizi kromatogramındaki pik yükseklikleri ve şekilleri eşitsizlikler gösterir (soldaki şekle bakınız). Modifiye edilmiş DNA polimeraz enzim sistemleri ve DNA'ya dahil olmadaki çeşitliliği azaltan boyalar ile bu problem çözülmüştür. Boya sonlandırma yöntemi ile otomatize edilmiş yüksek hacimli DNA dizi analiz makinaları günümüzde dizileme projelerinin büyük çoğunluğunda kullanılmaktadır.
Zorluklar
[değiştir | kaynağı değiştir]DNA dizilemesinde sık rastlanan sorunlar arasında ilk 15-40 baz dizisinin kötü kaliteli olması ve 700-900 bazdan sonra dizileme kromatogramının kalitesinin kötüleşmesidir. Baz bildirim (İng. Base calling) yazılımları kalite kırpması (İng.quality trimming) için tipik olarak bir kalite değeri de verir.[23][24]
DNA parçaları dizilemeden önce klonlanmışsa, elde edilen dizide klonlama vektörüne ait kısımlar da olabilir. Buna karşın, PCR-temelli klonlama ve pirodizilemeye dayalı yeni dizileme teknolojilerinde klonlama vektörü olmaz. Ampliseq ve SeqSharp gibi tek adımlı Sanger dizileme (kombine amplifikasyon ve dizileme) yöntemleri sayesinde hedef genler klonlanmadan ve önceden çoğaltılmadan hızlı dizilenebilmektedir.[25][26]
Mevcut yöntemler tek bir reaksiyonda sadece nispeten kısa (300-1000 nükleotit uzunlukta) DNA parçalarını doğrudan dizileyebilmektedir. Bu limitin üzerindeki DNA parçalarının dizilenmesindeki ana engel, uzunluk farkı bir nükleotit olan büyük DNA parçaları için ayrım gücünün yetersiz olmasıdır.
Otomasyon ve numune hazırlaması
[değiştir | kaynağı değiştir]
Otomatik DNA dizileme aletleri (DNA dizileyicileri) bir defada 384 DNA numunesini dizileyebilir ve bu işlemi günde 24 kere tekrarlayabilir. DNA dizileyicileri, kapiler elektroforez kullanarak büyüklük ayrıştırması yapar, boya floresansının tespit ve kayıt eder ve floresan pik çizim kromatogramı olarak veri çıkarır. Termal döndürücü (İng. thermal cycler) ile dizileme reaksiyonlarının ardından temizleme ve bir tampon çözelti içinde yeniden çözeltme, sonra da dizileyiciye yükleme işlemleri ayrı ayrı yapılır. Düşük kaliteli DNA dizilerinin kırpılmasını otomatik olarak yapabilen çeşitli yazılımlar mevcuttur. Bu programlar her pikteki kaliteyi belirleyip, genelde dizinin sonlarında bulunan düşük kaliteli baz piklerini atarlar. Bu programların doğruluk derecesi insan operatörlerinkinden daha düşüktür ama çok büyük veri kümelerinin otomatik işlenmesi için yeterlidir.
Amplifikasyon ve klonal seleksiyon
[değiştir | kaynağı değiştir]
Büyük ölçekli dizilemenin amacı, kromozom gibi çok uzun DNA parçalarını dizilemektir. Yaygın kullanılan yollardan biri büyük DNA parçalarını restriksiyon enzimleri veya mekanik güçler kullanarak küçük parçalara ayırmaktır. Parçalanmış DNA bir DNA vektörü içine klonlanır ve Escherichia coli içinde çoğaltılır. Her bir bakteriyel koloniden saflaştırılan kısa DNA parçaları ayrı ayrı dizilenir ve tek bir uzun, bitişik dizi şeklinde elektronik olarak birleştirilir.
Bu yöntem DNA dizisi hakkında bir ön bilgi gerektirmez ve de novo dizileme olarak adlandırılır. Birleştirilmiş dizideki boşluklar primer yürümesi yapılarak doldurulabilir. Farklı stratejilerin hız ve doğruluk açısından farklı avantajları vardır; saçma yöntemleri (İng. shotgun sequencing) çoğu zaman büyük genomları dizilemekte kullanılır ama elde edilen verinin birleştirmesini yapmak karmaşık ve zordur, özellikle dizi tekrarlarının neden olduğu bölgelerde.
Çoğu dizileme yönteminde bireysel DNA moleküllerinin çoğaltılması için bir in vitro klonlama adımı kullanılır, çünkü moleküler tespit yöntemleri tekil moleküllerin dizilemesine yetecek duyarlıkta değildir. Emülsiyon PCR yönteminde[27] bireysel DNA molekülleri ve primer kaplı boncuklarlar, yağ fazı içinde bulunan sulu damlacıklar içinde izole edilir. Polimeraz zincir tepkimesi (PCR) ile her boncuk DNA molekülünün klonal kopyaları ile kaplanır, sonra bu boncuklar daha sonra dizilemede kullanılmak üzere sabitlenir (immobilize edilir). Emülsiyon PCR Marguilis ve arkadaşları (454 Life Sciences tarafından ticarileştirilmiştir), Shendure ve Porreca ve arkadaşları (Poloni dizilemesi olarak bilinir) ve SOLiD dizilemesi (Agencourt tarafından geliştirilmiştir, artık Applied Biosystems bünyesindedir).[28][29][30]
In vitro klonal çoğaltma için kullanıla bir diğer yöntem köprü PCR (İng. bridge PCR) olarak adlandırılır, bunda DNA parçaları katı bir yüzeye bağlanmış primerler üzerinde çoğaltılır (bu yöntem Illumina Genome Analyzer makinasında kullanılır). Tek molekül yöntemleri (Stephen Quake'in laboratuvarında geliştirilen ve daha sonra Helicos tarafından ticarileştirilen) bir istisnadır: bu yöntemde parlak floresan boyalar ve lazer uyarımı kullanılarak bir yüzey üzerine sabitleştirilmiş bireysel DNA moleküllerindeki baz ekleme olayları tespit edilir, böylece moleküler çoğaltma gereği ortadan kalkar.[31]
Yüksek hacimli dizileme
[değiştir | kaynağı değiştir]Düşük masraflı dizilemeye olan büyük talep, yüksek hacimli dizileme teknolojilerinin geliştirilmesine yol açmıştır. Bu teknolojilerde dizileme süreci paralelleştirilerek binlerce veya milyonlarca dizi aynı anda üretilir.[32][33] Yüksek hacimli dizileme teknolojilerinin amacı, standart boya sonlandırma yöntemleri ile mümkün olan DNA dizileme masrafını azaltmaktır.[34]
Lynx Therapeutics'in Kitlesel Paralel İmza Dizilemesi
[değiştir | kaynağı değiştir]"Gelecek kuşak" dizileme teknolojilerinin ilki olan Kitlesel Paralel İmza Dizilemesi (İng. Massively Parallel Signature Sequencing veya MPSS), 1990'larda Lynx Therapeutics'te geliştirilmiştir. Bu şirket 1992'de Sydney Brenner ve Sam Eletr tarafından kurulmuştur. MPSS, boncuk temelli bir yöntemdi, bir adaptör ligasyonu ve onu takip eden bir adaptör deşifrasyon adımı içeriyordu ve dizi dört nükleotitlik birimler halinde okunuyordu. Bu yöntem diziye özgü taraflılığa yol açıyordu ve spesifik dizilerin kaybına yol açıyordu. Teknoloji çok karmaşık olduğu için MPSS sadece Lynx Therapeutics tarafından bir hizmet olarak sunulmaktaydı ve dizileme makinası satılmıyordu. Daha sonradan Solexa ile şirket evliliği olunca bu teknoloji, sentez yoluyla dizilemenin gelişmesine yol açtı, çok daha basit olan bu yeni yaklaşım sayesinde MPSS kulanılmaz oldu. Ancak, MPSS çıktısının esas özellikleri daha sonra gelen "gelecek kuşak" (İng. "next gen") veri tiplerine çok benzemekteydi, yüzlerce bin sayıda kısa diziler üretmesi de dahil olmak üzere. MPSS durumunda, bu kısa diziler tipik olarak cDNA dizilemesinde, gen ifade düzeylerini ölçmek amacıyla kullanılıyordu. Lynx Therapeutics 2004'te Solexa ile birleşti ve bu şirket de daha sonra Illumina tarafından satın alındı.[35]
Poloni dizilemesi
[değiştir | kaynağı değiştir]Harvard'da George Church'ün laboratuvarında geliştirilen poloni dizilemesi, 2005'te tüm bir genomu dizilemek için kullanılan ilk gelecek-kuşak dizileme sistemleri arasındaydı. In vitro Eşli etiket ("paired-tag") kitaplığı, emülsiyon PCR'si, otomatik bir mikroskop ve ligasyon-temelli dizileme kimyasını birleştirerek bir E. coli genomunu %99.9999'dan yüksek bir doğruluk üretebilmiş ve bunun maliyetini Sanger dizilemesinin yaklaşık 1/10'una getirmiştir. Bu teknoloji önce Agencourt Biosciences şirketine lisanslanmış, daha sonra ana şirketten ayrılan Agencourt Personal Genomics'e aktarılmış ve en nihayet Applied Biosystems'in SOLiD dizileme platformuna dahil edilmiştir.
454 pirodizilemesi
[değiştir | kaynağı değiştir]Pirodizilemenin paralelleştirilmiş bir versiyonu 454 Life Sciences tarafından geliştirilmiştir. Bu yöntemde bir yağ solüsyonu içindeki su damlacıklarında yer alan DNA, PCR ile çoğaltılır (emülsiyon PCR'si). Tek bir DNA kalıbının tek bir primer kaplı boncuğa bağlı olduğu her damlacık, sonra klonal bir koloni oluşturur. Dizileme makinası çok sayıda pikolitre hacimli kuyulara sahiptir, bunların her biri tek bir boncuk ve dizileme enzimleri içerir. Pirodizilemede lüsiferaz enzimi kullanılır, bu enzimin ürettiği ışık ile büyümekte olan DNA'ya eklenen her bir nükleotitin tespit edilir. Veriler birleştirilerek dizi okumaları üretilir.[28] Bu teknoloji orta uzunlukta diziler üretir, baz başına maliyeti Sanger dizilemesi ile SOLiD arasında yer alır.[36]
Solexa dizilemesi
[değiştir | kaynağı değiştir]Solexa tersinir boya sonlandırıcılarına dayanan dizileme teknolojisini geliştirmiştir. DNA molekülleri bir lam üzerindeki primerlere bağlanır, sonra çoğaltılarak lokal, klonal koloniler oluştururlar (köprü amplifikasyonu). Dört tip ddNTP eklenir, dahil edilmeyen nükleotitler yıkanıp atılır. Pirodizilemeden farklı olarak, DNA ancak bir defada bir nükleotit kadar uzatılabilir. Bir kamera ile floresan işaretli nükleotitlerin resmi çekilir. Sonra 3' uçtaki bloker ve floresan boya beraberce kimyasal olarak çıkarılır ve bir sonraki döngü başlar.[37]
SOLiD dizilemesi
[değiştir | kaynağı değiştir]Applied Biosystems'in SOLiD teknolojisinde ligasyon yoluyla dizileme yöntemi kullanılır. Burada, belli uzunluktaki tüm olası oligonükleotitlerin bir karışımı dizilenen konuma göre işaretlenir. Oligonükleotitler tavlanır ve ligasyona uğrar; DNA ligazın birbiriyle eşleşen dizileri bağlama tercihi nedeniyle, o pozisyon için bilgilendirici bir sinyal elde edilir. Dizilemeden önce DNA emülsiyon PCR ile çoğaltılır. Elde edilen boncukların her birinde aynı DNA'nın kopyaları bulunmaktadır, bu boncuklar bir cam lamın üzerine yerleştirilir.[38] Sonuç, Illumina dizilemesine benzer sayı ve uzunluklarda dizilerdir.[36]
İyon yarı iletken dizilemesi
[değiştir | kaynağı değiştir]Ion Torrent Systems Inc. iyon yarı iletken dizilemesine dayalı bir sistem geliştirmiştir. Bu dizileme yöntemi, DNA'nın polimerizasyonu sırasında açığa çıkan hidrojen iyonlarının tespitine dayalıdır. Dizilenecek bir kalıp DNA ipliği içeren bir mikrokuyu, tek bir nükleotit tipi ile doldurulur. Eğer eklenen nükleotit uzayan zincire dahil edilebiliyorsa bu bir hidrojen iyonunun salınmasına yol açar, bu da çok hassas bir iyon sensorunu uyarır. Eğer kalıp diziden aynı nükleotitten peşpeşe birkaç tane varsa (homopolimer tekrar), bir döngüde birden çok nükleotit zincire katılacaktır. Bu durumda daha çok sayıda hidrojen iyonu salınacak ve orantılı olarak daha yüksek bir elektronik sinyal elde edilecektir.[39][40]
DNA nanotop dizilemesi
[değiştir | kaynağı değiştir]DNA nanotop dizilemesi Complete Genomics şirketi tarafından geliştirilmiş bir dizileme teknolojisidir. Yöntem, dönen çember ikileşmesi kullanarak genomik DNA'dan elde edilmiş küçük parçaları çoğaltıp bunlardan DNA nanotopları meydana getirmektedir. Ligaz yoluyla dizileme ile nükleotit dizisi belirlenir.[41] Bu yöntem bir defada çok sayıda DNA nanotoplarının dizilenmesini sağlar ve diğer gelecek-kuşak dizileme platformlarına kıyasla daha düşük rektant masrafı vardır.[42] Ancak, her bir DNA nanotopundan sadece kısa diziler elde edilir, bu yüzden bu kısa dizilerin bir referans genomu üzerinde haritalanması zordur.[43] Bu teknoloji çeşitli genom dizileme projelerinde uygulanmıştır.[44]
Gelecek yöntemler
[değiştir | kaynağı değiştir]Hibridizasyon yoluyla dizileme DNA mikrodizilimi kullanan non-enzimatik bir yöntemdir. Dizisi belirlenecek olan bir DNA havuzu, floresan işaretlenip üzerinde bilinen diziler bulunan bir mikroçipe hibiridize edilir. Çip üzerinde belli bir noktada kuvvetli hibridizasyon sinyali olması, dizilenmekte olan DNA'da o dizinin bulunduğunu gösterir.[45] Kütle spektrometresi zincir sonlandırma reaksiyonlarında meydana gelen DNA parçaları arasındaki kütle farklarının belirlenmesi için kullanılabilir.[46]
Halen geliştirilmekte olan DNA dizileme yöntemleri arasında DNA polimerazın işaretlenmesi,[47] DNA bir nanopordan geçerken dizisinin okunması,[48][49] ve ağır elementlerle (halojenler gibi) nükleotitleri işaretleyerek uzun DNA parçalarıdaki (>5,000 bp) bireysel nükleotitlerin yerlerini tespit etmeyi amaçlayan mikroskopi temelli teknikler (atomik kuvvet mikroskopu veya transmisyon elektron mikroskopisi).[50][51]
Ekim 2006'da X Prize Foundation (X Ödül Vakfı) tüm genom dizileme teknolojilerinin geliştirilmesine önayak olmak için Archon X Ödülü'nü ilan etti. Bu ödül "100 insan genomunu 10 gün veya daha kısa bir zamanda, dizilenen her 100.000 bazdan en fazla 1 hatalık bir doğrulukla, genomdaki dizilerin en az %98'ini içeren diziler üreten ve genom başına $10,000 (US) maliyete bunu yapabilen ekibe" $10 milyon ödül vadetmektedir.[52]
2010 hibeleri ve 2011 adayları, mikroakışkan, poloni ve baz ağırlıklı dizileme metodolojilerinde devam eden çalışmaları içermektedir.[53]
DNA dizilemesinde önemli aşamalar
[değiştir | kaynağı değiştir]- 1953: DNA çifte sarmal yapısının keşfi.[54]
- 1972: Rekombinant DNA teknolojisinin keşfi. Bunun sayesinde tanımlı DNA parçalarının izolasyonu mümkün hâle gelmiştir. Bundan evvel dizilenebilen numeneler sadece bakteriyofaj veya virüs DNA'larıydı.
- 1977: İlk dizilenen DNA genom bacteriophage φX174.[55]
- 1977: Allan Maxam ve Walter Gilbert "Kimyasal yıkım ile DNA dizilemesi" adlı makalelerini yayımladılar.[15] Bağımsız olarak, Frederick Sanger, "Zincir sonlandırma inhibitörleri ile DNA dizilemesi" adlı makalesini yayımlıyor.[56]
- 1984: Britanya'da Tıbbi Araştırma Derneği araştırmacıları Epstein-Barr virüsünün DNA dizisini (170 kb) yayımladılar .
- 1986: California Institute of Technology'de Leroy E. Hood'un laboratuvarı ve Smith ilk yarı otomatik DNA dizileme makinasını ilan ettiler.
- 1987: Applied Biosystems ilk tamamen otomatik otomatik dizileme makinası olan model ABI 370'ı pazarladı.
- 1990: ABD Millî Sağlık kurumu (NIH), Mycoplasma capricolum, Escherichia coli, Caenorhabditis elegans ve Saccharomyces cerevisiae için ilk büyük ölçekli denemelere başladı (baz başına US$0.75 masraf ile).
- 1991: ifade edilmiş dizi etiketlerinin (İng. expressed sequence tag) dizilenmesi Craig Venter'in laboratuvarında başladı, insan genomunun kodlayıcı kısmını elde etmek amacıyla.[57]
- 1995: The Institute for Genomic Research (TIGR)'da Craig Venter, Hamilton Smith ve arkadaşları doğada yaşayan bir organizmanın (Haemophilus influenzae bakterisinin) ilk genom dizisini yayımladılar. Dairesel kromozomda 1.830.137 baz bulunmaktaydı ve Science dergisinde yayımlanması[58] tüm-genom saçma dizilime (whole-genome shotgun sequencing) yönteminin ilk kullanımı olmuştur, bu yöntem ile, daha evvelki dizileme projelerinde kullanılan baştan bir haritalama aşaması bertaraf edilmiştir.
- 1996 Stokholm'daki Kraliyet Teknoloji Enstitüsü'nden Pål Nyrén ve öğrencisi Mostafa Ronaghi pirodizileme yöntemini yayınladılar[59]
- 1998 University of Washington'dan Phil Green ve Brent Ewing, dizileyici veri analizi için
“phred”yayımladılar.[60] - 2000: Lynx Therapeutics, paralelleştirilmiş, adaptör/ligasyon aracılıklı, boncuk tabanlı bir dizileme teknolojisi olan "MPSS"yi yayımladı ve pazarlayıp "gelecek kuşak" dizileme akımını başlattı.[61]
- 2001: insan genomunun taslak sürümü yayımlandı.[62][63]
- 2004: 454 Life Sciences pirodizilemenin paralelleştirilmiş bir versiyonunu pazarladı.[64][65] Makinalarının ilk sürümü, otomatik Sanger dizilemesine kıyasla dizileme masraflarını 6-kat azaltmakta ve MPSS'ninkinin ardından "gelecek kuşak" dizileme makinalarının ikincisiydi.[36]
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b c d "Heather, J. M., & Chain, B. (2016). The sequence of sequencers: The history of sequencing DNA. Genomics, 107(1), 1-8. "Open archive"".
- ^ James Dewey Watson, Robert Mullan Cook-Deegan (1991). "Cook-Deegan, Robert Mullan (1991). "Origins of the Human Genome Project". FASEB Journal. University of Washington. 5 (1): 8–11. Open Source". The FASEB Journal.
- ^ Metzker, Michael L. (2005). ""Emerging technologies in DNA sequencing"". 15 (12). Genome research. s. 1767.
- ^ a b Pettersson E, Lundeberg J, Ahmadian A (Şubat 2009). "Generations of sequencing technologies "Open Access"". Genomics. 93 (2). ss. 105-11. doi:10.1016/j.ygeno.2008.10.003. PMID 18992322.
- ^ "Molecular biology". Wikipedia. 1 Ocak 2004 tarihinde kaynağından arşivlendi.
- ^ "Metagenomics". Wikipedia. 18 Şubat 2005 tarihinde kaynağından arşivlendi.
- ^ "Forensic DNA analysis". Wikipedia. 11 Ocak 2019 tarihinde kaynağından arşivlendi.
- ^ Wohl, S., Schaffner, S. F., & Sabeti, P. C. (2016). "Genomic analysis of viral outbreaks". 3 (1). Annual review of virology. s. 173.
- ^ Milton W. Taylor (2014). "Introduction: a short history of virology". Springer. s. 1-22. 15 Ocak 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Ocak 2023.
- ^ "Chapter 40". Rodgers, M. H. (2020). Discovery of the Structure of DNA. Science, Technology, & Society: A Student-Led Exploration. "Open Source". 12 Ocak 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Ocak 2023.
- ^ Fatih Ozsolak and Patrice M. Milos (2011). "RNA sequencing: advances, challenges and opportunities". NIH Public Access.
- ^ ""Ray Wu Faculty Profile". Cornell University. Archived from the original on 4 March 2009. "Open Archived"". 8 Mart 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 12 Ocak 2023.
- ^ Jay, E., Bambara, R., Padmanabhan, R., & Wu, R. (1974). "DNA sequence analysis: a general, simple and rapid method for sequencing large oligodeoxyribonucleotide fragments by mapping". 1 (3). Nucleic Acids Research. s. 331.
- ^ a b c Ebertz, Dr Andreas (2 Kasım 2020). "A Journey Through The History Of DNA Sequencing". The DNA Universe BLOG (İngilizce). 2 Kasım 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Ocak 2023.
- ^ a b Maxam AM, Gilbert W (Şubat 1977). "A new method for sequencing DNA". Proc. Natl. Acad. Sci. U.S.A. 74 (2). ss. 560-4. doi:10.1073/pnas.74.2.560. PMC 392330 $2. PMID 265521.
- ^ Sanger F, Coulson AR (Mayıs 1975). "A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase". J. Mol. Biol. 94 (3). ss. 441-8. doi:10.1016/0022-2836(75)90213-2. PMID 1100841.
- ^ Sanger F. Determination of nucleotide sequences in DNA 7 Aralık 2013 tarihinde Wayback Machine sitesinde arşivlendi.. Nobel lecture, 8 December 1980.
- ^ Graziano Pesole; Cecilia Saccone (2003). Handbook of comparative genomics: principles and methodology. New York: Wiley-Liss. s. 133. ISBN 0-471-39128-X.
- ^ "Cold Spring Harb Protoc -- Sign In Page". 25 Temmuz 2011 tarihinde kaynağından arşivlendi.
- ^ "Cold Spring Harb Protoc -- Sign In Page". 25 Temmuz 2011 tarihinde kaynağından arşivlendi.
- ^ Smith LM, Sanders JZ, Kaiser RJ; ve diğerleri. (1986). "Fluorescence detection in automated DNA sequence analysis". Nature. 321 (6071). ss. 674-9. doi:10.1038/321674a0. PMID 3713851.
We have developed a method for the partial automation of DNA sequence analysis. Fluorescence detection of the DNA fragments is accomplished by means of a fluorophore covalently attached to the oligonucleotide primer used in enzymatic DNA sequence analysis. A different coloured fluorophore is used for each of the reactions specific for the bases A, C, G and T. The reaction mixtures are combined and co-electrophoresed down a single polyacrylamide gel tube, the separated fluorescent bands of DNA are detected near the bottom of the tube, and the sequence information is acquired directly by computer.
- ^ Smith LM, Fung S, Hunkapiller MW, Hunkapiller TJ, Hood LE (Nisan 1985). "The synthesis of oligonucleotides containing an aliphatic amino group at the 5' terminus: synthesis of fluorescent DNA primers for use in DNA sequence analysis". Nucleic Acids Res. 13 (7). ss. 2399-412. doi:10.1093/nar/13.7.2399. PMC 341163 $2. PMID 4000959.
- ^ "Phred - Quality Base Calling". 26 Nisan 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Şubat 2011.
- ^ "Base-calling for next-generation sequencing platforms - Brief Bioinform". 17 Haziran 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Şubat 2011.
- ^ DOI:10.1373/clinchem.2004.039164
- ^ DOI:10.2353/jmoldx.2010.090134
- ^ Richard Williams, Sergio G Peisajovich, Oliver J Miller, Shlomo Magdassi, Dan S Tawfik, Andrew D Griffiths (2006). "Amplification of complex gene libraries by emulsion PCR". Nature methods. 3 (7). ss. 545-550. doi:10.1038/nmeth896. PMID 16791213.
- ^ a b Margulies M, Egholm M, Altman WE; ve diğerleri. (Eylül 2005). "Genome sequencing in microfabricated high-density picolitre reactors". Nature. 437 (7057). ss. 376-80. doi:10.1038/nature03959. PMC 1464427 $2. PMID 16056220.
- ^ Shendure, J.; Porreca, GJ; Reppas, NB; Lin, X; McCutcheon, JP; Rosenbaum, AM; Wang, MD; Zhang, K; Mitra, RD (2005). "Accurate Multiplex Polony Sequencing of an Evolved Bacterial Genome". Science. 309 (5741). s. 1728. doi:10.1126/science.1117389. PMID 16081699.
- ^ "Applied Biosystems' SOLiD technology". 16 Mayıs 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Haziran 2011.
- ^ Braslavsky I, Hebert B, Kartalov E, Quake SR (Nisan 2003). "Sequence information can be obtained from single DNA molecules". Proc. Natl. Acad. Sci. U.S.A. 100 (7). ss. 3960-4. doi:10.1073/pnas.0230489100. PMC 153030 $2. PMID 12651960.
- ^ Hall N (Mayıs 2007). "Advanced sequencing technologies and their wider impact in microbiology". J. Exp. Biol. 210 (Pt 9). ss. 1518-25. doi:10.1242/jeb.001370. PMID 17449817.
- ^ Church GM (Ocak 2006). "Genomes for all". Sci. Am. 294 (1). ss. 46-54. doi:10.1038/scientificamerican0106-46. PMID 16468433.
- ^ Schuster, Stephan C. (2008). "Next-generation sequencing transforms today's biology". Nature methods. 5 (1). Nature Methods. ss. 16-18. doi:10.1038/nmeth1156. PMID 18165802.
- ^ Brenner, Sidney; Johnson, M; Bridgham, J; Golda, G; Lloyd, DH; Johnson, D; Luo, S; McCurdy, S; Foy, M (2000). "Gene expression analysis by massively parallel signature sequencing (MPSS) on microbead arrays". Nature Biotechnology. 18 (6). Nature Biotechnology. ss. 630-634. doi:10.1038/76469. PMID 10835600.
- ^ a b c Schuster SC (Ocak 2008). "Next-generation sequencing transforms today's biology". Nat. Methods. 5 (1). ss. 16-8. doi:10.1038/nmeth1156. PMID 18165802.
- ^ Mardis ER (2008). "Next-generation DNA sequencing methods". Annu Rev Genomics Hum Genet. Cilt 9. ss. 387-402. doi:10.1146/annurev.genom.9.081307.164359. PMID 18576944.
- ^ Valouev A, Ichikawa J, Tonthat T; ve diğerleri. (Temmuz 2008). "A high-resolution, nucleosome position map of C. elegans reveals a lack of universal sequence-dictated positioning". Genome Res. 18 (7). ss. 1051-63. doi:10.1101/gr.076463.108. PMC 2493394 $2. PMID 18477713.
- ^ Rusk, N. (2011). "Torrents of sequence." Nat Meth 8(1): 44-44.
- ^ "Ion Torrent Official Webpage". 6 Kasım 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Mart 2020.
- ^ Human Genome Sequencing Using Unchained Base Reads in Self-Assembling DNA Nanoarrays 2 Haziran 2013 tarihinde Wayback Machine sitesinde arşivlendi.. Drmanac, R. et. al. Science, 2010, 327 (5961): 78-81,
- ^ Genome Sequencing on Nanoballs 2 Haziran 2013 tarihinde Wayback Machine sitesinde arşivlendi. Porreca, JG. Nature Biotechnology, 2010, 28:(43-44)
- ^ Human Genome Sequencing Using Unchained Base Reaads in Self-Assembling DNA Nanoarrays, Supplementary Material 2 Haziran 2013 tarihinde Wayback Machine sitesinde arşivlendi.. Drmanac, R. et. al. Science, 2010, 327 (5961):78-81,
- ^ Complete Genomics 25 Ağustos 2010 tarihinde Wayback Machine sitesinde arşivlendi. Press release, 2010
- ^ Hanna GJ, Johnson VA, Kuritzkes DR; ve diğerleri. (1 Temmuz 2000). "Comparison of sequencing by hybridization and cycle sequencing for genotyping of human immunodeficiency virus type 1 reverse transcriptase". J. Clin. Microbiol. 38 (7). ss. 2715-21. PMC 87006 $2. PMID 10878069. 15 Eylül 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Haziran 2011.
- ^ J.R. Edwards, H.Ruparel, and J. Ju (2005). "Mass-spectrometry DNA sequencing". Mutation Research. 573 (1-2). ss. 3-12. doi:10.1016/j.mrfmmm.2004.07.021. PMID 15829234.
- ^ "VisiGen Biotechnologies Inc. - Technology Overview". Visigenbio.com. 7 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2009.
- ^ "The Harvard Nanopore Group". Mcb.harvard.edu. 4 Haziran 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2009.
- ^ "Nanopore Sequencing Could Slash DNA Analysis Costs". 21 Kasım 2011 tarihinde kaynağından arşivlendi.
- ^ US patent 20060029957, ZS Genetics, "Systems and methods of analyzing nucleic acid polymers and related components", çıkış tarihi: 2005-07-14
- ^ Xu M, Fujita D, Hanagata N (Aralık 2009). "Perspectives and challenges of emerging single-molecule DNA sequencing technologies". Small. 5 (23). ss. 2638-49. doi:10.1002/smll.200900976. PMID 19904762.
- ^ ""PRIZE Overview: Archon X PRIZE for Genomics"". 21 Nisan 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Haziran 2011.
- ^ "National Human Genome Research Institute (NHGRI)". 19 Nisan 2003 tarihinde kaynağından arşivlendi.
- ^ Watson JD, Crick FH (1953). "The structure of DNA". Cold Spring Harb. Symp. Quant. Biol. Cilt 18. ss. 123-31. PMID 13168976.
- ^ Sanger F, Air GM, Barrell BG; ve diğerleri. (Şubat 1977). "Nucleotide sequence of bacteriophage phi X174 DNA". Nature. 265 (5596). ss. 687-95. doi:10.1038/265687a0. PMID 870828.
- ^ Sanger F, Nicklen S, Coulson AR (Aralık 1977). "DNA sequencing with chain-terminating inhibitors". Proc. Natl. Acad. Sci. U.S.A. 74 (12). ss. 5463-7. doi:10.1073/pnas.74.12.5463. PMC 431765 $2. PMID 271968.
- ^ Adams MD, Kelley JM, Gocayne JD; ve diğerleri. (Haziran 1991). "Complementary DNA sequencing: expressed sequence tags and human genome project". Science. 252 (5013). ss. 1651-6. doi:10.1126/science.2047873. PMID 2047873.
- ^ Fleischmann RD, Adams MD, White O; ve diğerleri. (Temmuz 1995). "Whole-genome random sequencing and assembly of Haemophilus influenzae Rd". Science. 269 (5223). ss. 496-512. doi:10.1126/science.7542800. PMID 7542800. 26 Mart 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Haziran 2011.
- ^ M. Ronaghi, S. Karamohamed, B. Pettersson, M. Uhlen, and P. Nyren (1996). "Real-time DNA sequencing using detection of pyrophosphate release". Analytical Biochemistry. 242 (1). ss. 84-9. doi:10.1006/abio.1996.0432. PMID 8923969.
- ^ Ewing B, Green P (Mart 1998). "Base-calling of automated sequencer traces using phred. II. Error probabilities". Genome Res. 8 (3). ss. 186-94. doi:10.1101/gr.8.3.186. PMID 9521922. 15 Eylül 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Haziran 2011.
- ^ Brenner S; ve diğerleri. (2000). "Gene expression analysis by massively parallel signature sequencing (MPSS) on microbead arrays". Nature Biotechnology. 18 (6). Nature Biotechnology. ss. 630-634. doi:10.1038/76469. PMID 10835600.
- ^ Lander ES, Linton LM, Birren B; ve diğerleri. (Şubat 2001). "Initial sequencing and analysis of the human genome". Nature. 409 (6822). ss. 860-921. doi:10.1038/35057062. PMID 11237011.
- ^ Venter JC, Adams MD, Myers EW; ve diğerleri. (Şubat 2001). "The sequence of the human genome". Science. 291 (5507). ss. 1304-51. doi:10.1126/science.1058040. PMID 11181995.
- ^ Stein RA (1 Eylül 2008). "Next-Generation Sequencing Update". Genetic Engineering & Biotechnology News. 28 (15). 18 Temmuz 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Haziran 2011.
- ^ Margulies M, Egholm M, Altman WE; ve diğerleri. (Eylül 2005). "Genome sequencing in microfabricated high-density picolitre reactors". Nature. 437 (7057). ss. 376-80. doi:10.1038/nature03959. PMC 1464427 $2. PMID 16056220.
