Barij

 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Barij u periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element, Simbol, Atomski broj | Barij, Ba, 56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Zemnoalkalni metali | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, Perioda, Blok | 2, 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | sivobijeli metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 0,026[1] % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 137,327(7)[2] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus (izračunat) | 215 (253) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 215 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | 268[3] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [Xe] 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektrona u energetskom nivou | 2, 8, 18, 18, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izlazni rad | 2,7[4] eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 502,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 965,2 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | čvrsto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsova skala tvrdoće | 1,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | kubična prostorno centrirana | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 3620 kg/m3 pri 293,15[5] K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | paramagnetičan ( = 6,8 · 10−6)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 1000 K (727 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 1910[7] K (1637 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | 38,16 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 149[7] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pritisak pare | 98 Pa pri 371 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | 1620 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična toplota | 204 J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična električna provodljivost | 2,94 · 106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 18 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | +2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksid | BaO | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrodni potencijal | −2,92 V (Ba2+ + 2e− → Ba) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 0,89 (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oznake upozorenja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R: 11-14/15-36/37/38 S: 16-26-43-36/37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste se osnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Barij (latinski: barium) jeste hemijski element sa simbolom Ba i atomskim brojem 56. On je peti element u drugoj grupi periodnog sistema, mehki srebrenasti metal, koji spada u grupu zemnoalkalnih metala. Zbog svoje izuzetno velike hemijske reaktivnosti, barij se nikad ne javlja u prirodi u elementarnom stanju. Njegov hidroksid je još u prahistoriji bio poznat kao barita; ova supstanca se ne javlja kao mineral, ali se može dobiti zagrijavanjem barij-karbonata.
Među najčešćim mineralima barija u prirodi javljaju se barit (barij-sulfat, BaSO4) i viterit (barij-karbonat, BaCO3), oba nerastvorljiva u vodi. Ime ovog elementa potječe iz alhemijskih derivata "barita", čiji dalje naziv dolazi od grčke riječi βαρύς (barys) u značenju "težak". Kao novi hemijski element, barij je otkriven 1774. ali sve do 1808. nije reduciran u metalni oblik, nakon razvitka elektrolize.
Barij se u industriji koristi u samo nekoliko aplikacija. Historijski, koristio se kao geter ("sakupljač gasova") u vakuumskim cijevima. On je i jedna od komponenta YBCO (visokotemperaturnih superprovodnika) i elektrokeramike, te se dodaje u čelik i lijevano gvožđe radi smanjenja veličine ugljikovih čestica unutar mikrostrukture metala. Spojevi barija se dodaju u vatromet za postizanje zelene boje. Barij-sulfat se koristi kao nerastvorljivi teški aditiv u tečnosti za bušenje naftnih bušotina, kao i u veoma čistom obliku kao kontrastno sredstvo pri fotografisanju x-zračenjem ljudskog probavnog sistema. Rastvorljivi spojevi barija su otrovni zbog otpuštanja rastvorljivih iona barija te se zbog toga oni koriste kao rodenticid.
Historija
[uredi | uredi izvor]Alhemičari u ranom srednjem vijeku poznavali su neke od minerala barija. Mineral barit u obliku glatkih kamenih oblutaka nađen kod Bologne, Italija, bio je poznat kao "kamenje iz Bologne". Oni su pokazali ogromno zanimanje za to kamenje jer nakon njihovog izlaganja svjetlošću, nastavili su svijetliti i godinama nakon toga.[8] Fosforescentne osobine barita zagrijanog sa organskim tvarima opisao je 1602. godine V. Casciorolus.[9]:5
Carl Wilhelm Scheele je 1774. spoznao da barit sadrži neki novi element, ali nije uspio izdvojiti barij, nego je dobio barij-oksid. Johan Gottlieb Gahn je također izolirao barij-oksid dvije godine ranije pri sličnim proučavanjima. Oksidirani barij je najprije nazvan "barot" od strane Guyton de Morveaua, ime koje je Antoine Lavoisier promijenio u barita. Također u 18. vijeku, engleski mineralog William Withering zapazio je jedan teški mineral u rudnicima olova u Cumberlandu, danas poznat kao viterit. Barij je prvi put izdvojio Humphry Davy u Engleskoj 1808. pomoću elektrolize njegovih istopljenih soli.[10] Analogijom sa kalcijom, Davy je elementu dao ime "barium" po bariti, gdje nastavak -ium označava metalni element.[8] Robert Bunsen i Augustus Matthiessen uspjeli su dobiti čisti metalni barij elektrolizom istopljene smjese barij-hlorida i amonij-hlorida.[11][12]
Proizvodnja čistog kisika putem Brinovog procesa bila je aplikacija koja je upotrebljavala barij-peroksid u velikom obimu tokom 1880tih, prije nego se kisik počeo dobijati elektrolizom vode i frakcijskom destilacijom ukapljenog zraka početkom 20. vijeka. U Brinovom procesu, barij-oksid pri 500-600 °C reagira sa kisikom iz zraka gradeći barij-peroksid, a koji se raspada pri 700 °C otpuštajući kisik:[13][14]
- 2 BaO + O2 ⇌ 2 BaO2
Godine 1908. barij-sulfat je prvi put korišten kao radiokontrastno sredstvo za snimanje probavnog sistema rendgenskim zračenjem.[15]
Osobine
[uredi | uredi izvor]Fizičke
[uredi | uredi izvor]

Barij je mehki, srebrenasto-bijeli metal. Kada je izrazito čist bez primjesa, ima blagu zlatnu nijansu.[9]:2 Srebrenasto-bijela boja metalnog barija vrlo brzo nestaje nakon što se izloži zraku pri čemu oksidira, dobijajući tamno sivi sloj oksida. Barij ima osrednju specifičnu težinu i relativno dobro provodi električnu struju. Dobijanje barija visoke čistoće je izuzetno teško, pa do danas mnoge osobine čistog barija nisu u dovoljnoj mjeri proučene i izmjerene.[9]:2
Pri standardnim uslovima temperature i pritiska, ovaj metal se kristalizira u prostorno-centriranom kubičnom kristalnom sistemu, gdje udaljenost između dva atoma iznosi 503 pikometra, a pri zagrijavanju se širi brzinom od približno 1,8×10-5/°C.[9]:2 Ovaj metal se odlikuje izuzetnom mehkoćom, njegova tvrdoća po Mohsu iznosi 1,25.[9]:2 Topi se pri temperaturi od 727 °C[6]:4–43 što je između lakšeg stroncija (777 °C)[6]:4–86 i težeg radija (700 °C).[6]:4–78 Međutim, njegova tačka ključanja (1637 °C) viša je nego kod stroncija (1380 °C).[6]:4–86 Gustoća barija (3,62 g·cm−3)[6]:4–43 je također između stroncija (2,63 g·cm−3)[6]:4–86 i radija (~5,5 g·cm−3).[6]:4–78
Hemijske
[uredi | uredi izvor]U hemijskom smislu, barij je sličan magneziju, kalciju i stronciju, a od njih je i još reaktivniji. On se u svojim spojevima uvijek javlja u oksidacijskom stanju +2.[9]:2 Njegove reakcije sa halkogenim elementima su izuzetno egzotermne (otpušta se velika količina energije); reakcija sa kisikom ili zrakom odvija se na sobnoj temperaturi, pa se elementarni barij skladišti u atmosferi nekog inertnog gasa.[9]:2 Reakcije sa drugim nemetalima, poput ugljika, dušika, fosfora, silicija i vodika, općenito su egzotermne te se odvijaju zagrijavanjem.[9]:2–3 Reakcije s vodom i alkoholima su također veoma egzotermne te se u njima otpušta gasoviti vodik:[9]:3
- Ba + 2 ROH → Ba(OR)2 + H2↑ (gdje je R alkil ili atom vodika)
Pored toga, barij reagira s amonijakom dajući komplekse kao što je Ba(NH3)6.[9]:3
Metal vrlo lahko napada većina kiselina. Međutim, sumporna kiselina je jedan od rijetkih izuzetaka, jer se zbog pasivizacije zaustavlja reakcija formirajući nerastvorljivi barij-sulfat.[16] Barij se kombinira sa nekoliko metala, uključujući aluminij, cink, olovom i kalajom, gradeći međumetalne faze i legure.[17]
Izotopi
[uredi | uredi izvor]Barij se na Zemlji javlja u prirodi kao smjesa sedam primordijalnih nuklida: barij-130, barij-132, te od 134 do 138.[18] Izotop barij-130 se raspada veoma sporo na ksenon-130 preko dvostrukog β+ raspada, a za barij-132 se pretpostavlja da se raspada na sličan način do ksenona-132. Međutim odgovarajuća vremena poluraspada bi kod ova dva izotopa prevazilazila pretpostavljenu starost svemira najmanje hiljadu puta.[19] Stoga se ti izotopi u praktične svrhe smatraju stabilnim. Njihova radioaktivnost je tako slaba da ne predstavljaju gotovo nikakvu opasnost po život živih bića. Njihov udio u prirodnom bariju iznosi oko 0,1%.[18] Od svih stabilnih izotopa na barij-138 otpada 71,7% prirodnog barija, a što je lakši izotop, to je njegov udio manji.[18] Sveukupno, poznato je oko 50 izotopa ovog elementa, čije mase se kreću u rasponu od 114 do 153. Najstabilniji metastabilni izotop je barij-133, čije vrijeme poluraspada iznosi približno 10,51 godina, a drugih pet izotopa imaju vremena poluraspada duža od jednog dana.[19] Barij također ima 10 meta-stanja, od kojih je barij-133m1 najstabilniji sa vremenom poluraspada od oko 39 sati.[19]
Rasprostranjenost
[uredi | uredi izvor] |
| Mineral barit |
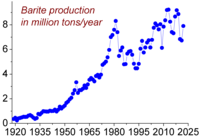 |
| Trend proizvodnje barita u svijetu |
Udio barija u Zemljinoj kori iznosi oko 0,026 %, dok ga u morskoj vodi ima oko 13 µg/L. Osnovni komercijalni izvor ovog elementa je barit (poznat i pod naziv teški spar), koji je zapravo mineral barij-sulfata.[9]:5 Njegova nalazišta su raspršena po cijelom svijetu. Jedini drugi ekonomični izvor je daleko manje značaja od barita, viterit, kao mineral barij-karbonata. Viterita ima u Engleskoj, Rumuniji i zemljama bivšeg Sovjetskog saveza.[9]:5
Rezerve barita u svijetu se procjenjuju na 0,7 do 2 milijarde tona. Najveća proizvodnja ostvarena je 1981. sa 8,3 miliona tona, a samo 7% do 8% je iskorišteno za dobijanje barija ili njegovih spojeva.[9]:5 Proizvodnja barita je ponovno porasla počev od druge polovine 1990tih, od 5,6 miliona tona u 1996, preko 7,6 miliona u 2005. do 7,8 miliona u 2011. godini. U Kini se dobija više od 50% ove količine, a slijede je Indija (14% u 2011), Maroko (8,3%), SAD (8,2%), Turska (2,5%) te Iran i Kazahstan (svaki po 2,6%).[20]
Iskopana ruda se najprije opere, smrvi, razvrsta te odvoji od kvarca. Ako je kvarc srastao isuviše duboko u rudu, ili je udio željeza, cinka ili olova nenormalno visok, primjenjuju se metode flotacije. Proizvod tog procesa je 98%-tni čisti barit (po masi). Njegova čistoća ne bi trebala biti ispod 95%, sa što nižim udjelom željeza i silicij-dioksida.[9]:7 On se dalje reducira pomoću ugljika do barij-sulfida:[9]:6
- BaSO4 + 2 C → BaS + 2 CO2↑
Barij-sulfid rastvorljiv u vodi je polazna tačka za druge spojeve. Rastvoreni BaS nakon reakcije sa kisikom daje sulfate, sa dušičnom kiselinom nitrate, sa ugljik-dioksidom karbonate i tako dalje.[9]:6 Nitrat se termalno može raspasti dajući oksid.[9]:6 Metalni barij se proizvodi njegovom redukcijom sa aluminijem pri temperaturi od 1100 °C. Međumetalni spoj BaAl4 nastaje prvi:[9]:3
- 3 BaO + 14 Al → 3 BaAl4 + Al2O3
To je međuproizvod, koji reagira sa barij-oksidom te daje metal. Međutim, u toj reakciji ne reducira se sav barij.[9]:3
- 8 BaO + BaAl4 → Ba↑ + 7 BaAl2O4
Preostali barij-oksid reagira sa nastalim aluminij-oksidom:[9]:3
- BaO + Al2O3 → BaAl2O4
pa tako, sveukupna reakcija glasi[9]:3
- 4 BaO + 2 Al → 3 Ba↑ + BaAl2O4
Ovim procesom nastaju pare barija koje se skupljaju u hladnijem dijelu mašine te se zatim skladište u kalupe u atmosferi inertnog gasa argona.[9]:3 Ovaj metod se koristi i komercijalno te može dati barij izrazito velike čistoće.[9]:3 Komercijalno dostupni barij na tržištu prodaje se kao 99% čisti metal, a osnovne nečistoće u njemu su stroncij i kalcij (od 0,25% do 0,8%) dok ostale nečistoće učestvuju do najviše 0,1% udjela.[9]:4 Slična reakcija dešava se sa silicijem pri 1200 °C dajući barij i barij-metasilikat.[9]:3 Elektroliza nije pogodna jer se barij vrlo lahko rastvara u rastopljenim halidima te se dobija nečist pri izoliranju ovim metodom.[9]:3
Benitoit je mineral koji u svom sastavu sadrži barij (barij-titanij-silikat) a javlja se kao veoma rijetki fluorescentni dragi kamen, koji je zvanični dragulj američke savezne države Kalifornije.
Upotreba
[uredi | uredi izvor]Metal i legure
[uredi | uredi izvor]Barij, kao metal ili u leguri sa aluminijem, koristi se za uklanjanje nepoželjnih gasova (getering) iz vakuumskih cijevi, kao što su televizorske katodne cijevi.[9]:4 Barij je pogodan u ove svrhe jer ima vrlo nizak pritisak pare te visoku reaktivnost prema kisiku, dušiku, ugljik-dioksidu i vodi. Jednim malim dijelom može uklanjati i plemenite gasove rastvarajući ih u svojoj kristalnoj rešeci. Međutim, ova primjena barija postepeno nestaje zbog sve manjeg obima korištenja i proizvodnje starih televizora sa katodnim cijevima odnosno povećanja popularnosti LCD i plazma televizora i monitora.[9]:4
Ostale upotrebe elementarnog barija su neznatne a uključuju njegovo dodavanje siluminu (legurama aluminija i silicija) gdje on poboljšava njegovu strukturu, kao i za[9]:4
- legure za ležajeve;
- topive legure olova i kalaja, kojima povećava otpornost na puzanje;
- legure sa niklom za pravljenje svjećica;
- dodavanje čeliku i lijevanom gvožđu kao inokulant;
- legure sa kalcijem, manganom, silicijem i aluminijem kao visokokvalitetni deoksideri čelika.
Barij-sulfat i barit
[uredi | uredi izvor]Barij-sulfat (mineral barit, BaSO4) je važan u industriji nafte, naprimjer kao tekućina za bušenje u naftim bušotinama.[6]:4–5 Talog ovog spoja (nazvan blanc fixe, od francuskog izraza koji znači "trajno bijelo") koristi se u bojama i izbjeljivačima.[9]:9[21] Također se koristi i kao pigment za oblaganje papira.[9]:9 U obliku nanočestica, može poboljšati fizičke osobine nekih polimera poput epoksi-smola.[9]:9
Spojevi
[uredi | uredi izvor]| O2− | S2− | F− | Cl− | SO2− 4 | CO2− 3 | O2− 2 | H− | |
|---|---|---|---|---|---|---|---|---|
| Ca2+[6]:4–48–50 | 3,34 | 2,59 | 3,18 | 2,15 | 2,96 | 2,83 | 2,9 | 1,7 |
| Sr2+[6]:4–86–88 | 5,1 | 3,7 | 4,24 | 3,05 | 3,96 | 3,5 | 4,78 | 3,26 |
| Ba2+[6]:4–43–45 | 5,72 | 4,3 | 4,89 | 3,89 | 4,49 | 4,29 | 4,96 | 4,16 |
| Zn2+[6]:4–95–96 | 5,6 | 4,09 | 4,95 | 2,09 | 3,54 | 4,4 | 1,57 | — |
Soli barija su najčešće bijele u čvrstom stanju, a bezbojne kad se rastvore, jer im ioni barija ne daju nikakvu posebnu boju.[22] Oni su također i mnogo gušći od svojih analoga stroncija i kalcija, sa izuzetkom halidnih soli (vidi tabelu, cink je naveden za usporedbu).
Barij-hidroksid (barita) je bio poznat i srednjovjekovnim alhemičarima, koji su ga dobijali zagrijavanjem barij-karbonata. Za razliku od kalcij-hidroksida, on je apsorbirao vrlo malo CO2 u vodenim rastvorima te je bio neosjetljiv na atmosferske promjene. Ova osobina se koristila za podešavanje opreme za mjerenje pH vrijednosti.
Nestabilni, isparljivi spojevi barija sagorijevaju zelenim do tamnozelenim plamenom, koji je vrlo pogodan test za dokazivanje prisustva barijevih spojeva. Boja potječe od spektralnih linija na 455,4; 493,4; 553,6 i 611,1 nm.[9]:3
Organobarijevi spojevi su klasa spojeva koji sve više dobijaju na značaju. Naprimjer poznati su dialkili barija u vidu alkilhalobarija.[9]:3
Reference
[uredi | uredi izvor]- ^ Harry H. Binder (1999). Lexikon der chemischen Elemente. Stuttgart: S. Hirzel Verlag. ISBN 3-7776-0736-3.
- ^ CIAAW, Standard Atomic Weights Revised 2013.
- ^ Manjeera Mantina, Adam C. Chamberlin, Rosendo Valero, Christopher J. Cramer, Donald G. Truhlar (2009). "Consistent van der Waals Radii for the Whole Main Group". J. Phys. Chem. A. 113: 5806–5812. doi:10.1021/jp8111556.CS1 održavanje: više imena: authors list (link)
- ^ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing (2005). Lehrbuch der Experimentalphysik, vol. 6: Festkörper (2 izd.). Berlin: Walter de Gruyter. str. 361. ISBN 978-3-11-017485-4.CS1 održavanje: više imena: authors list (link)
- ^ Norman N. Greenwood, Alan Earnshaw (1988). Chemie der Elemente (1 izd.). Weinheim: VCH. str. 136. ISBN 3-527-26169-9.
- ^ a b c d e f g h i j k l m Weast, Robert C., ured. (1990). CRC Handbook of Chemistry and Physics. Boca Raton: CRC (Chemical Rubber Publishing Company). str. E-129 do E-145. ISBN 0-8493-0470-9.
- ^ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang (2011). "Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks". Journal of Chemical & Engineering Data. 56: 328–337. doi:10.1021/je1011086.CS1 održavanje: više imena: authors list (link)
- ^ a b Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Publishing Group. str. 80. ISBN 0-313-33438-2.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (2007). "Barium and Barium Compounds". u Ullman, Franz (ured.). Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2.CS1 održavanje: više imena: authors list (link)
- ^ Davy, H. (1808) "Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia," Philosophical Transactions of the Royal Society of London, vol. 98, str. 333–370.
- ^ "Masthead". Annalen der Chemie und Pharmacie. 93 (3): fmi–fmi. 1855. doi:10.1002/jlac.18550930301.
- ^ Wagner Rud; Neubauer C.; Deville H. Sainte-Claire; Sorel Wagenmann (1856). "Notizen". Journal für Praktische Chemie. 67: 490–508. doi:10.1002/prac.18560670194.CS1 održavanje: više imena: authors list (link)
- ^ Jensen William B. (2009). "The Origin of the Brin Process for the Manufacture of Oxygen". Journal of Chemical Education. 86 (11): 1266. Bibcode:2009JChEd..86.1266J. doi:10.1021/ed086p1266.
- ^ Ihde, Aaron John (1. 4. 1984). The development of modern chemistry. str. 681. ISBN 978-0-486-64235-2.
- ^ Schott, G. D. (1974). "Some Observations on the History of the Use of Barium Salts in Medicine". Med. Hist. 18 (1): 9–21. doi:10.1017/S0025727300019190. PMC 1081520. PMID 4618587.
- ^ Müller, Hermann (2007). "Sulfuric Acid and Sulfur Trioxide". u Ullman, Franz (ured.). Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2.
- ^ Ferro, Riccardo; Saccone, Adriana (2008). Intermetallic Chemistry. Elsevier. str. 355. ISBN 978-0-08-044099-6.CS1 održavanje: više imena: authors list (link)
- ^ a b c De Laeter J. R.; Böhlke J. K.; De Bièvre P.; Hidaka H. (2003). "Atomic weights of the elements. Review 2000 (IUPAC Technical Report)". Pure and Applied Chemistry. 75 (6): 683–800. doi:10.1351/pac200375060683.CS1 održavanje: više imena: authors list (link)
- ^ a b c Audi Georges; Bersillon O.; Blachot J.; Wapstra A.H. (2003). "The NUBASE Evaluation of Nuclear and Decay Properties". Nuclear Physics A. Atomic Mass Data Center. 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.CS1 održavanje: više imena: authors list (link)
- ^ Miller, M. M. Barite. USGS.gov
- ^ F. Cardarelli (2000). Materials Handbook. Springer. ISBN 978-1-84628-668-1.
- ^ Slowinski, Emil J.; Masterton, William L. (1990). Qualitative analysis and the properties of ions in aqueous solution (2 izd.). Saunders. str. 87. ISBN 978-0-03-031234-2.CS1 održavanje: više imena: authors list (link)
Vanjski linkovi
[uredi | uredi izvor]- Barij na stranici Periodic Videos



