Bombykol
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
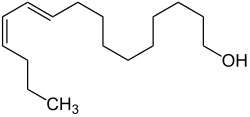 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bombykol | |||||||||||||||
| Andere Namen | (10E,12Z)-10,12-Hexadecadien-1-ol (IUPAC) | |||||||||||||||
| Summenformel | C16H30O | |||||||||||||||
| Kurzbeschreibung | ölige, geruchlose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 238,41 g·mol−1 | |||||||||||||||
| Aggregatzustand | flüssig | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Bombykol ist ein Insektenpheromon, das von einigen Arten von Schmetterlings-Weibchen als Sexual-Lockstoff produziert wird. Dabei wird der Stoff von einer Drüse im Abdomen produziert und in die Luft entlassen, um männliche Sexualpartner anzulocken.

Die Männchen erkennen die Substanz mit ihren Antennen, sogar wenn nur ein einziges Molekül auf sie trifft, weswegen es gern als Beispiel in der Sinnesphysiologie verwendet wird. Eine Reaktion des Faltermännchens erfolgt jedoch erst bei Konzentrationen ab etwa 1000 Bombykolmolekülen pro cm3 im Luftstrom.[1] Nach einer anderen Literaturquelle[3] wirken bereits 60 Moleküle dieses Pheromons in einem Liter Luft bei den Männchen als eindeutig erregend.
Die Detektion geschieht durch chemosensorische Neurone in porösen Härchen, sogenannten „Sensillen“ auf den gefächerten Antennen der Männchen.
Bombykol wird von mehreren Arten verwendet, zum Beispiel vom Seidenspinner (Bombyx mori) und von Bombyx mandarina (Bombycidae). Aber auch bei Coloradia velda und Hemileuca eglanterina (beide Saturniidae) wirkt der Stoff als Pheromon.
Bombykol wurde 1959 von Adolf Butenandt als das erste Pheromon chemisch charakterisiert. Dazu wurden aus den Abdominaldrüsen von etwa 500.000 weiblichen Faltern 12 mg des flüssigen Pheromons gewonnen.[4][1] Wichtiger Baustein einer Totalsynthese ist 10-Undecinol.[5]
Synthese
[Bearbeiten | Quelltext bearbeiten]Zur Synthese von Bombykol werden hauptsächlich Wittig-Reaktionen durchgeführt, da diese durch die Stabilisierung/Destabilisierung des entstehenden Ylids eine selektive Bildung einer trans- bzw. cis-konfigurierten Doppelbindung ermöglichen.[6] Eine Möglichkeit der Totalsynthese ergibt sich beispielsweise ausgehend von 1,9-Nonandial. Dieses reagiert mit (1,3-Dioxolan-2-yl-methyl)-triphenylphosphoniumbromid in einer zweifachen Wittig-Reaktion zu (2E,11E)-Tridecadiendial. Anschließend findet mit Butyltriphenylphosphoniumbromid eine weitere Wittig-Olefinierung statt, es entsteht (2E,10E,12Z)-Hexadecatrienal. Die Z-Konfiguration entsteht hierbei mindestens im Verhältnis 9:1. Die Doppelbindung, die sich an der zweiten Position befindet, wird danach zu einer Einfachbindung reduziert. Dieser Schritt erfolgt durch Umsetzung mit dem Hantzsch-Ester, welcher als schwaches Reduktionsmittel verwendet wird. Im letzten Schritt erfolgt eine Reduktion der Aldehydgruppe zu einer primären Hydroxygruppe mittels Natriumborhydrid, es entsteht Bombykol.
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Die Biosynthese findet in den Pheromondrüsen der weiblichen Motten statt und basiert auf der Fettsäurebiosynthese.[7] Die Biosynthese von Bombykol nutzt keine kettenverlängernden oder -verkürzenden Schritte, weshalb sie von Palmitoyl-CoA ausgeht. Im ersten Schritt der Synthese erfolgt die Reaktion von Palmitoyl-CoA zu 11-Z-Hexadecenoyl-CoA, katalysiert wird die Reaktion durch das Enzym Palmitoyl-CoA-Desaturase. Im nächsten Schritt erfolgt die Bildung der zweiten Doppelbindung, diesmal in trans-Konfiguration, sodass (10E,12Z)-10,12-Hexadecadienoyl-CoA entsteht. Das katalysierende Enzym weist eine hohe Substratspezifität auf, sodass nur eine geringe Menge an Isomeren entsteht.[7] Das 10,12-Dien stellt den Vorgänger des Bombykols dar und liegt hauptsächlich als Triglycerin vor und wird in zytoplasmatischen Lipidtröpfchen gespeichert. Die Neurohormone führen zur Freisetzung und Weiterreaktion zu Bombykol.[8] Im letzten Schritt entsteht durch Reduktion und Abspaltung con CoA das Bombykol.[7]
Detektion des Bombykols
[Bearbeiten | Quelltext bearbeiten]Die Detektion des Bombykol erfolgt über die Sensillen der Männchen.[9] Das vom Weibchen ausgestoßene Bombykol gelangt durch mikroskopisch kleine Öffnungen in der wachsartigen Kutikula der Sensillen. Diese mikroskopischen Poren bieten Duftstoffen aus der Luft Zugang, während sie die Verdunstung der dendritischen Rezeptorzellen umgebenden wässrige Lösung in den Sensillen minimiert. Um eine Interaktion des Pheromons mit dem entsprechenden Pheromonrezeptor zu ermöglichen, muss das hydrophobe Pheromon zunächst die sensilläre Lymphe passieren. Der Transport erfolgt über ein Pheromonbindendes Protein (PBP). Charakteristisch für Proteinbindende Pheromone ist das geringe Gewicht von bis zu 20~kDa.
Das Pheromonbindungsprotein des Bombykols besteht aus sechs α-Helices. Das Bombykol wird in einer geschlossenen, hydrophoben Tasche gebunden, die von vier antiparallelen α-Helices gebildet wird. Die Bindung basiert auf hydrophoben Wechselwirkungen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Wissenschaft-Online-Lexika: Eintrag zu Bombykol im Lexikon der Biologie. Abgerufen am 14. September 2008.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 134.
- ↑ Louis Fieser, Mary Fieser: Organische Chemie, Verlag Chemie Weinheim, 2. Auflage, 1972, S. 1244, ISBN 3-527-25075-1.
- ↑ N. Miyaura, H. Suginome, A. Suzuki: New stereospecific syntheses of pheromone bombykol and its three geometrical isomers. In: Tetrahedron. Band 39, Nr. 20, 1983, S. 3271–3277, doi:10.1016/S0040-4020(01)91575-3.
- ↑ Renata Marcia de Figueiredo, Raphael Berner, Jennifer Julis, Ting Liu, David Türp, and Mathias Christmann: Bidirectional, Organocatalytic Synthesis of Lepidopteran Sex Pheromones. In: The Journal of Organic Chemistry. Band 72, 2007, S. 640–642, doi:10.1021/jo0620415.
- ↑ a b c T. Ando, T. Hase, R. Arima, M.Uchiyamau: Biosynthetic Pathway of Bombykol, the Sex Pheromone of the Female Silkworm Moth. Tokyo University of Agriculture and Technology 1987.
- ↑ A. Ohnishi, K. Hashimoto, K. Imai, S. Matsumoto: Functional Characterization of the Bombyx mori Fatty Acid Transport Protein (BmFATP) within the Silkmoth Pheromone Gland. Molecular Entomology Laboratory, Advanced Science Institute and Department of Materials Chemistry, Hosei University, Japan 2008.
- ↑ Benjamin H Sandler, Larisa Nikonova, Walter S Leal and Jon Clardy: Sexual attraction in the silkworm moth: structure of the pheromone-binding-protein–bombykol complex. In: Chemistry & Biology. Nr. 7, 2000, S. 143–151.
Literatur
[Bearbeiten | Quelltext bearbeiten]- A. Butenandt, E. Hecker: Synthese des Bombykols, des Sexuallockstoffes des Seidenspinners, und seiner geometrischen Isomeren. In: Angew. Chem. 73, 1961, S. 349.
- A. Butenandt, E. Hecker, M. Hopp, W. Koch: Über den Sexuallockstoff des Seidenspinners. IV. Die Synthese des Bombykols und der cis-trans-Isomeren Hexadecadien-(10,12)-ole-(1). In: Liebigs Ann. Chem. 658, 1962, S. 39–64.