Dichlorcarben
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | Dichlorcarben | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | CCl2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 82,92 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
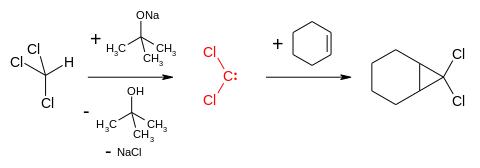
Dichlorcarben ist ein in der organischen Chemie anzutreffendes Carben. Das reaktive Intermediat mit der Summenformel CCl2 ist durch die Reaktion zwischen Chloroform und einer Base wie Kalium-tert-butanolat[2] oder Natriumhydroxid leicht zugänglich. Bei Letzterem ist der Eintrag der als Salz vorliegenden Base in die organische Chloroform-Phase durch einen Phasentransferkatalysator erforderlich.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Dichlorcarben kann ebenso durch Reaktion von Trichloressigsäureethylester mit Natriummethanolat in Pentan[3] oder thermische Zersetzung von Phenyl(trichloromethyl)quecksilber[4] gewonnen werden.
Dichlordiazirin ist ein experimenteller Dichlorcarben-Vorläufer, der im Dunkeln bei Raumtemperatur stabil ist und durch Photolyse unter Freisetzung von molekularem Stickstoff die Carbenverbindung liefert. Phenol reagiert hierbei mit Bromcyan zu Phenylcyanat (a), das mit Hydroxylamin zu N-Hydroxy-O-phenyl-iminocarbamat umgesetzt wird (b). Die Hydroxygruppe wird durch Methansulfonylchlorid aktiviert und in eine Mesylgruppe überführt (c). Der intramolekulare Ringschluss zum Azirin gelingt mit Natriumhypochlorit (d), woraufhin eine Nitrierung der Phenylgruppe mit Nitroniumtetrafluoroborat folgt (e). In einer ionischen Flüssigkeit wird eine nukleophile Substitution mit Caesiumchlorid unter Phasentransferkatalyse mit Tetrabutylammoniumchlorid durchgeführt (f).
Dichlorcarben kann ebenso durch sonochemische Reaktion von Tetrachlormethan mit elementarem Magnesium gewonnen werden.[5] Diese Reaktion toleriert Ester- und Carbonylfunktionen, da keine starke Base benötigt wird.
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Dichlorcarben reagiert mit Alkenen formal in einer [1+2]-Cycloaddition zu geminalen Dichlorcyclopropanen, die anschließend zu den entsprechenden Cyclopropanen reduziert oder mit Wasser zu einem Cyclopropanon hydrolysiert werden können. Die Darstellung von Dichlorcarben aus Chloroform und sein präparativer Nutzen wurde 1954 durch William von Eggers Doering entdeckt,[6] der auf diese Weise Cyclohexen funktionalisierte.
In der Reimer-Tiemann-Reaktion reagiert Dichlorcarben mit Phenol zu Salicylaldehyd.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Dichlorcarben als reaktives Intermediat wurde zuerst 1862 von Anton Geuther vorgeschlagen, der Chloroform als CCl2·HCl auffasste.[7] Jack Hine publizierte 1950 einen Artikel über Dichlorcarben als Reaktionsintermediat der Chloroformhydrolyse.[8] Der Nachweis gelang William von Eggers Doering 1954.
Verwandte Reaktionen
[Bearbeiten | Quelltext bearbeiten]In der Allensynthese nach Doering-LaFlamme werden Alkene in einer Kettenverlängerungsreaktion zu Allenen umgesetzt.[9] Hierzu wird das Alken zunächst mit Dichlorcarben zur Reaktion gebracht, um anschließend durch Einsatz von Magnesium oder Natrium das Allen zu gewinnen. Diese Reaktionssequenz kommt ebenso in der Gewinnung von Cyclopentadienen mittels Skattebøl-Umlagerung vor. Die Reaktion zwischen Phenolen mit Dichlorcarben wird als Reimer-Tiemann-Reaktion bezeichnet. Dem Dichlorcarben eng verwandt ist das reaktivere Dibromcarben CBr2.
Chlorcarben
[Bearbeiten | Quelltext bearbeiten]Das verwandte Chlorcarben (ClHC) kann durch Reaktion von Dichlorcarben mit Methyllithium gewonnen werden. Es kann zur Gewinnung von Spiropentadien genutzt werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ E. Vogel, W. Klug, A. Breuer: 1,6-Methanoannulene In: Organic Syntheses. 54, 1974, S. 11, doi:10.15227/orgsyn.054.0011; Coll. Vol. 6, 1988, S. 731 (PDF).
- ↑ William E. Parham, Edward E. Schweizer, Sigmund A. Mierzwa Jr: 2-Oxa-7,7-Dichloronorcarane In: Organic Syntheses. 41, 1961, S. 76, doi:10.15227/orgsyn.041.0076; Coll. Vol. 5, 1973, S. 874 (PDF).
- ↑ Ted J. Logan: Phenyl(trichloromethyl)mercury In: Organic Syntheses. 46, 1966, S. 98, doi:10.15227/orgsyn.046.0098; Coll. Vol. 5, 1973, S. 969 (PDF).
- ↑ Haixia Lin, Mingfa Yang, Peigang Huang and Weiguo Cao: A Facile Procedure for the Generation of Dichlorocarbene from the Reaction of Carbon Tetrachloride and Magnesium using Ultrasonic Irradiation. In: Molecules 2003, 8, S. 608–613 (PDF; 64 kB)
- ↑ The Addition of Dichlorocarbene to Olefins W. von E. Doering and A. Kentaro Hoffmann J. Am. Chem. Soc.; 1954; 76(23) S. 6162–6165; doi:10.1021/ja01652a087
- ↑ Ueber die Zersetzung des Chloroforms durch alkoholische Kalilösung Annalen der Chemie und Pharmacie Volume 123, Issue 1, Date: 1862, S. 121–122 A. Geuther doi:10.1002/jlac.18621230109
- ↑ Carbon Dichloride as an Intermediate in the Basic Hydrolysis of Chloroform. A Mechanism for Substitution Reactions at a Saturated Carbon Atom Jack Hine J. Am. Chem. Soc., 1950, 72 (6), S. 2438–2445 doi:10.1021/ja01162a024
- ↑ W. von E. Doering and P. M. LaFlamme: A two-step of synthesis of allenes from olefins. In: Tetrahedron, Volume 2, Issues 1-2, 1958, S. 75–79 doi:10.1016/0040-4020(58)88025-4.