Lysergsäure
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
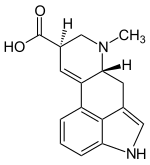 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lysergsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C16H16N2O2 | ||||||||||||||||||
| Kurzbeschreibung | blättchenförmige Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 268,31 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert | 3,3[3] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Die Lysergsäure ist eine tetracyclische (Struktur mit vier Ringen) β-Aminosäure. Die D-(+)-Lysergsäure ist die Vorstufe für eine Vielzahl von Mutterkornalkaloiden, die von dem Mutterkornpilz Claviceps purpurea, weiteren Schlauchpilzen und wenigen höheren Pflanzen aus der Gruppe der Windengewächse (Convolvulaceae) produziert werden.[1] Der Name leitet sich ab von Ergot, dem französischen Wort für ‚Mutterkorn‘ und lysis (griechisch für ‚Auflösung‘).
Struktur
[Bearbeiten | Quelltext bearbeiten]Der erste korrekte Strukturvorschlag stammt von W. A. Jacobs[5] und wurde durch Synthese von Dehydrolysergsäure von Arthur Stoll, Albert Hofmann und Franz Troxler bestätigt.[6][7] Das Molekül besitzt zwei Stereozentren, dementsprechend gibt es vier Stereoisomere: D-Lysergsäure, L-Lysergsäure, D-Isolysergsäure und L-Isolysergsäure. Die relative Konfiguration der beiden Stereozentren wurde 1954 von Stoll et al. abgeleitet.[8] Die absolute Konfiguration der natürlichen Lysergsäure wurde 1962 von Stadler und Hofmann durch chemischen Abbau und Verknüpfung mit D-(−)-N-Methylasparaginsäure bestätigt.[9]
| Epimere | (+)-Enantiomer | (−)-Enantiomer |
| Lysergsäure |  (5R,8R) |  (5S,8S) |
| Isolysergsäure |  (5R,8S) |  (5S,8R) |
Synthese
[Bearbeiten | Quelltext bearbeiten]Die erste Totalsynthese racemischer Lysergsäure gelang im Jahr 1954 Ed Kornfeld und Robert Woodward als Mitarbeiter von Eli Lilly.[10] Die effiziente Wipf-Methode aus dem Jahr 2022 eignet sich zur Erzielung von Gramm-Ausbeuten und bedient sich der Mizoroki-Heck-Kreuzkupplung zum Schließen des Rings C.[11][12] Die Biosynthese der Lysergsäure geht – wie bei allen Mutterkornalkaloiden – vom Tryptophan aus.[1]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Mutterkorn (Claviceps purpurea), Trichterwinden (z. B. Ipomoea tricolor oder Turbina corymbosa) (Produzent bei den Winden sind durch die Samen übertragene epibiotische Pilze der Clavicipitaceae-Familie[13]).
Verwendung
[Bearbeiten | Quelltext bearbeiten]Lysergsäure und ihre Amide – die Lysergsäureamide – haben eine erhebliche therapeutische Breite. Lysergsäure in ihrer Grundform wurde in der frühen Neuzeit erstmals zum Auslösen von Wehen eingesetzt.
Bekannter ist sie jedoch als Basis des Halluzinogens Lysergsäurediethylamid (LSD). Daher unterliegt die Lysergsäure in vielen Ländern dem jeweiligen Grundstoffüberwachungsgesetz.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Eintrag zu Lysergsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. April 2020.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 977.
- ↑ pKa Data, Compiled by R. Williams, chem.wisc.edu (PDF; 78 kB).
- ↑ a b Registrierungsdossier zu Lysergic acid (Abschnitt GHS) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. März 2019.
- ↑ L. C. Craig, T. Shedlovsky, R. G. Gould, W. A. Jacobs in: J. Biol. Chem. Vol. 125, 1938, S. 289.
- ↑ A. Stoll, A. Hofmann, F. Troxler: Über die Isomerie von Lysergsäure und Isolysergsäure. 14. Mitteilung über Mutterkornalkaloide. In: Helvetica Chimica Acta. 32, 1949, S. 506–521, doi:10.1002/hlca.19490320219.
- ↑ M. Volkan Kisakürek, Edgar Heilbronner: Highlights of chemistry. Wiley-VCH-Verlag, Weinheim 1994, S. 164 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. Stoll, T. Petrzilka, L. Rutschmann, A. Hofmann, H. H. Günthard: Über die Stereochemie der Lysergsäuren und der Dihydro-lysergsäuren. 37. Mitteilung über Mutterkornalkaloide. In: Helvetica Chimica Acta, 1954, Band 37, Nr. 7, S. 2039–2057, doi:10.1002/hlca.19540370716.
- ↑ P. A. Stadler, A. Hofmann in: Helvetica Chimica Acta. Bd. 45, 1962, S. 2005–2011.
- ↑ E. C. Kornfeld, E. J. Fornefeld, G. B. Kline, M. J. Mann, D. E. Morrison, R. G. Jones, R. B. Woodward in: J. Am. Chem. Soc. Vol. 78, 1956, S. 3087.
- ↑ Nutt MJ, Nick Woolf N, Stewart GS, 2023: Overview of the synthetic approaches to lysergic acid as a precursor to the psychedelic LSD, Australian Journal of Chemistry.
- ↑ Tasker NR, Wipf P, 2022: A Short Synthesis of Ergot Alkaloids and Evaluation of the 5-HT1/2 Receptor Selectivity of Lysergols and Isolysergols, Org. Lett., S. 7255–7259
- ↑ U Steiner, MA Ahimsa-Müller, A Markert, S Kucht, J Gross, N Kauf, M Kuzma, M Zych, M Lamshöft, Miroslawa Furmanowa, Volker Knoop, Christel Drewke, Eckhard Leistner: Molecular characterization of a seed transmitted clavicipitaceous fungus occurring on dicotyledoneous plants (Convolvulaceae). In: Planta. 224. Jahrgang, Nr. 3, 2006, S. 533–544, doi:10.1007/s00425-006-0241-0, PMID 16525783.
