Markownikow-Regel
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie

Die Markownikow-Regel (nach Wladimir Wassiljewitsch Markownikow) beschreibt in der organischen Chemie die Produkte einer elektrophilen Addition von Halogenwasserstoffen an Kohlenstoff-Kohlenstoff-Doppelbindungen in asymetrisch Alkenen.[1]
Die Regel besagt, dass bei der Anlagerung von Halogenwasserstoffen an asymmetrische Alkene das Wasserstoffatom immer an das bereits wasserstoffreichere Kohlenstoffatom gebunden wird. Das Halogenatom wird dementsprechend an das wasserstoffärmere, also höher substituierte Kohlenstoffatom gebunden. Bei der Addition von Wasser ist derselbe Effekt zu beobachten: Das H-Atom wird an das niedriger substituierte Kohlenstoffatom gebunden, die OH-Gruppe an das höher substituierte. Man kann also verallgemeinert sagen, dass +δElektrophil–Nucleophilδ− dieser Regel folgen (Ausnahmen: siehe unten).[1][2] Als Merksatz gilt: „Wer hat, dem wird gegeben.“
Erklärung[Bearbeiten | Quelltext bearbeiten]
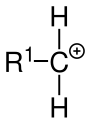
Die Ursache für diesen Verlauf ist, dass bei einer elektrophilen Addition als Zwischenstufe ein positiv geladenes und möglichst gut stabilisiertes Carbeniumion entsteht. Befindet sich die positive Ladung an einem tertiären Kohlenstoffatom, wird sie durch drei +I-Effekte der angrenzenden Alkylreste stabilisiert. Ein sekundäres Kohlenstoffatom wird nur durch zwei +I-Effekte stabilisiert und ein primäres durch einen. Neben +I-Effekten bewirkt auch die Hyperkonjugation eine Stabilisierung des Carbeniumions. Deshalb sind tertiäre Carbeniumionen energieärmer und damit stabiler als sekundäre, und diese wiederum stabiler als primäre Carbeniumionen. Es bilden sich fast ausschließlich tertiäre Carbeniumionen.
- primäres Carbeniumion
- sekundäres Carbeniumion
- tertiäres Carbeniumion
Beispiel[Bearbeiten | Quelltext bearbeiten]
Bei der folgenden Reaktion reagiert 2-Methylprop-1-en mit Chlorwasserstoff:

Nach dem Weg a) wird das Wasserstoffatom an das Kohlenstoffatom addiert, welches weniger substituiert ist, sodass ein stabileres tertiäres Carbeniumion entsteht. Dadurch entsteht nach der Addition des Chloridions das sogenannte Markownikow-Produkt, da dies nach der Regel von Markownikow entstanden ist. Im Weg b) wird das Wasserstoffatom an das höher substituierte Kohlenstoffatom gebunden, sodass ein labiles primäres Carbeniumion entstehen würde und danach das Anti-Markownikow-Produkt.
Da das Zwischenprodukt im Weg a) stabiler ist, entsteht dieses bevorzugt.[2][1]
Ausnahmen[Bearbeiten | Quelltext bearbeiten]
Wird die Stabilität der beiden im Übergangszustand möglichen Carbeniumionen jedoch nicht ausschließlich durch +I-Effekte von Alkylsubstituenten bestimmt, können auch Anti-Markownikow-Produkte auftreten. So erhält man bei der Addition von HCl an Acrylsäure (CH2=CH–COOH) beispielsweise nur 3-Chlorpropionsäure, weil das stabilere Carbeniumion während der Reaktion nicht in unmittelbarer Nachbarschaft der Elektronen ziehenden Carboxygruppe (−I-Effekt) entsteht.

Bei der radikalischen Addition, der Hydroborierung und der Hydrosilylierung gilt die Markownikowregel ebenfalls nicht (wie zuerst Morris S. Kharasch zeigte). Auch hier werden Anti-Markownikow-Produkte erhalten, bei denen das Heteroatom an das niedriger substituierte Kohlenstoffatom gebunden ist.[3]
Entstehen Alkene aus dem Markownikow-Produkt der primären Addition, kann die Richtung (Regioselektivität) der Elimination durch die Begriffe Saytzeff-Regel- und Hofmann-Produkt näher beschrieben werden.
Kritik[Bearbeiten | Quelltext bearbeiten]
Die Anwendung der historisch wichtigen Markownikow-Regel führt zu falschen Vorhersagen über zu erwartende Additionsprodukte an unsymmetrische Alkene, wenn sich als Zwischenprodukte mesomeriestabilisierte Carbeniumionen bilden können. Die mesomeren Effekte überspielen (überkompensieren) die induktiven Effekte. Es entsteht stets jenes Carbeniumion als Zwischenprodukt, das stabiler ist. Daraus ergibt sich dann automatisch die Additionsrichtung.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Milton Orchin, Roger S. Macomber, Allan R. Pinhas, R. Marshall Wilson: The Vocabulary and Concepts of Organic Chemistry. 2. Auflage, John Wiley & Sons, Hoboken 2005, ISBN 0-471-68028-1, S. 558–559.
- ↑ a b Paula Yurkanis Bruice: Organic Chemistry. 4. Auflage, Prentice-Hall, 2003, ISBN 0-131-41010-5, S. 148–149.
- ↑ Matthias Beller, Jayasree Seayad, Annegret Tillack, Haijun Jiao: Katalytische Markownikow- und Anti-Markownikow-Funktionalisierung von Alkenen und Alkinen. In: Angewandte Chemie. Band 116, Nr. 26, 28. Juni 2004, ISSN 0044-8249, S. 3448–3479, doi:10.1002/ange.200300616 (wiley.com [abgerufen am 4. Juni 2019]).