Natriumhyperoxid
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
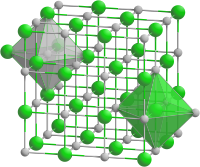 | |||||||||||||
| _ Na+ _ O2− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Natriumhyperoxid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Verhältnisformel | NaO2 | ||||||||||||
| Kurzbeschreibung | leicht zersetzlicher gelber Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 54,99 g·mol−1 | ||||||||||||
| Aggregatzustand | fest | ||||||||||||
| Dichte | 2,2 g·cm−3 [2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Natriumhyperoxid ist eine chemische Verbindung mit der Formel NaO2 aus der Gruppe der Hyperoxide.
Darstellung und Vorkommen
[Bearbeiten | Quelltext bearbeiten]Es entsteht bei der Umsetzung von Natriumperoxid mit Sauerstoff bei hohen Temperaturen und Drücken[5] (z. B. bei Eintritt von Meteoriten in die Erdatmosphäre) und kommt in einigen Mineralien vor.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Natriumhyperoxid zersetzt sich bei Kontakt mit Wasser (Hydrolyse) zu Natriumhydroxid und Sauerstoff und/oder Wasserstoffperoxid:
Es tritt in drei Kristallstrukturen auf (trimorph): Unter −77 °C in Markasitstruktur (ähnlich wie FeS2), zwischen −77 °C und −50 °C in Pyritstruktur und oberhalb −50 °C ähnlich wie Kochsalz (NaCl).
Die Standardbildungsenthalpie von Natriumhyperoxid beträgt ΔHf0 = -260 kJ/mol.[3]
Zukünftige Anwendungen
[Bearbeiten | Quelltext bearbeiten]Natriumhyperoxid ist derzeit Gegenstand der Akkuforschung. Bei der Entwicklung moderner Metall-Luft-Akkus zeigt sich ein großes Potential bezüglich Stabilität, Lade- und Entladeeffizienz.[6]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]- uni-Kiel: Alkalimetalle (PDF-Datei; 2,46 MB)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu Natriumoxide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ Natriumhyperoxid bei webelements.com
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1176.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Stephen E. Stephanou et al.: Sodium superoxide. In: J. C. Bailar, Jr. (Hrsg.): Inorganic Syntheses. Band 4. McGraw-Hill, Inc., 1953, S. 82–85 (englisch).
- ↑ P. Hartmann et al.: A rechargeable room-temperature sodium superoxide (NaO2) battery, Nature Materials 12, 2013, S. 228–232, doi:10.1038/nmat3486.
![{\displaystyle \mathrm {Na_{2}O_{2}+O_{2}\ {\xrightarrow[{138\ bar}]{450\,{}^{\circ }C}}\ 2\ NaO_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/19e04da534a74bc19d1440a294ae0b401b50d9ca)

