Radiumbromid
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
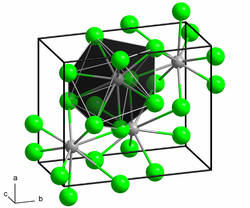 | |||||||||||||
| _ Ra2+ _ Br− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Radiumbromid | ||||||||||||
| Verhältnisformel | RaBr2 | ||||||||||||
| Kurzbeschreibung | weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 385,83 g·mol−1 | ||||||||||||
| Aggregatzustand | fest[1] | ||||||||||||
| Dichte | 5,78 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit | |||||||||||||
| Gefahren- und Sicherheitshinweise | |||||||||||||
 Radioaktiv | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Radiumbromid ist ein weißer Feststoff, der im Dunkeln von selber leuchtet. Im Laufe der Zeit färbt sich Radiumbromid durch Radiolyse gelblich.[1]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Wasserfreies Radiumbromid wird hergestellt, indem man das Chlorid bei Rotglut mehrere Stunden mit gasförmigem Bromwasserstoff umsetzt.[1] Das Dihydrat RaBr2·2 H2O des Radiumbromids wird durch Auflösen von Radiumcarbonat in Bromwasserstoffsäure und anschließender Kristallisation erhalten.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Aus wässriger Lösung kristallisiert Radiumbromid als Dihydrat aus, das isomorph mit Bariumbromid BaBr2·2H2O ist. Das Dihydrat kann entwässert werden, indem man 200 °C heiße, trockene Luft darüberleitet.[1] Das frisch kristallisierte Salz ist farblos, färbt sich aber durch Radiolyse durch Alphastrahlung mit der Zeit gelb. Durch das in den Kristallen entstandene Helium kann es passieren, dass die Kristalle zerplatzen.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Kirby, H. W. and Salutsky, Murrell L. (1964) The Radiochemistry of Radium, Subcommittee on Radiochemistry, National Academy of Sciences, abgerufen am 28. Februar 2017.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 100 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Gmelins Handbuch der Anorganischen Chemie: Radium, System Nummer 31, Achte Auflage, Verlag Chemie GmbH, Berlin 1927, Seite 61–62.
