Wallach-Umlagerung
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
Die Wallach-Umlagerung, auch Wallach-Transformation genannt, ist eine Namensreaktion der organischen Chemie und wurde 1880 von Otto Wallach und L. Belli entdeckt. Es handelt sich hierbei um eine säurekatalytische Umlagerung von Azoxybenzolen zu Hydroxyazobenzolen.[1][2]
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]Otto Wallach und L. Belli entdeckten die Reaktion, als sie Azobenzol durch leichtes Erwärmen in konzentrierter Schwefelsäure lösten. Nach der Verdünnung mit Wasser, fielen granatrote, metallisch schillernde Pyramiden aus.[3]
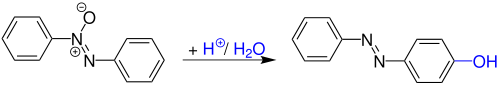
Die Benzidin-Umlagerung ist der Wallach-Umlagerung sehr ähnlich. Allerdings werden für die Wallach-Umlagerung starke Säuren verwendet, wohingegen bei der Benzidin-Umlagerung schwache Säuren genügen. Aufgrund der höheren Wasserstoff-Ionen-Konzentration in starken Säuren können beide Stickstoff-Atome protoniert werden. Kinetische Studien haben gezeigt, dass nach der Monoprotonierung die Umlagerungsrate steigt; dies deutet auf ein dikationisches Zwischenprodukt hin. Weitere kinetische Studien zeigten, dass je nach Konzentration der Säure ein unterschiedliches Zwischenprodukt gebildet wird. Bei bis zu 75%iger Schwefelsäure entsteht ein Chinolin-Zwischenprodukt. Ab 80%iger Schwefelsäure entsteht ein dikationisches Zwischenprodukt. Wenn die Konzentration zwischen 75 % und 80 % liegt, sind beide Intermediate möglich.
Mechanismus
[Bearbeiten | Quelltext bearbeiten]Ein möglicher Mechanismus wurde von Zerong Wang formuliert.[1] Hierbei wird der Weg über dikationische Zwischenprodukte gezeigt:

Die Wallach-Umlagerung beginnt damit, dass zwei Wasserstoff-Ionen an das Azoxybenzol (1) gelagert werden. Das erste lagert sich an das negativ geladene Sauerstoff-Atom des Edukts. Ein weiteres lagert sich an das Stickstoff-Atom ohne gebundenen Sauerstoff. Durch Wasserabspaltung bildet sich das Dikation 2 mit zwei mesomeren Grenzstrukturen. Ein Phenylring wird dabei entaromatisiert, es entsteht ein 1,4-chinoides System. Im nächsten Schritt lagert sich Wasser unter Bildung des Oxoniumions 3 an. Da dieses instabil ist, spaltet sich ein Proton ab. Durch die Abspaltung eines weiteren Protons wird der zweite Sechsing wieder aromatisiert und es entsteht das gewünschte Endprodukt, das Hydroxyazobenzol (4).
Anwendung
[Bearbeiten | Quelltext bearbeiten]Diese Reaktion findet vor allem eine Anwendung bei der Herstellung von Hydroxyazobenzol und Hydroxyazonaphthalin. Diese Stoffe werden dazu verwendet Seifen, Lacke, Fette und Harze einzufärben.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2942–2945.
- ↑ M. Windholz: The Merck Index. Merck&Co., Rakway 1976, ISBN 0-911910-26-3, S. ONR-92.
- ↑ O. Wallach, L. Belli: Über die Umwandlung von Azoxybenzol in Oxazobenzol. In: Chem. Ber. Band 13, 1880, S. 525–527, doi:10.1002/cber.188001301153.