Cytosquelette


Le cytosquelette est un réseau de protéines dans le cytoplasme de toute cellule. Il regroupe des protéines polymérisées en fibre, des protéines de liaison, et des protéines motrices. Les trois principaux composants du cytosquelette sont les microfilaments d'actine, les filaments intermédiaires, et les microtubules. Le cytosquelette a un rôle structural puisqu'il est responsable de la forme de la cellule, de l'intégration de celle-ci dans un tissu, et du positionnement des organites, mais aussi dynamique puisqu'il est responsable des mouvements des organites dans la cellule et des mouvements de la cellule elle-même.
Les cytosquelettes des cellules eucaryotes sont assez similaires, bien qu'ils dépendent notamment de la spécialisation cellulaire. Les cytosquelettes des cellules procaryotes, récemment mis en évidence, semblent plus différents.
Structure
[modifier | modifier le code]Mise en évidence
[modifier | modifier le code]Le cytosquelette est observable par microscopie à fluorescence. On utilise pour cela une molécule se liant à l'actine, que l'on couple à un marqueur fluorescent ou fluorochrome. Pour les microfilaments d'actine, on peut utiliser la phalloïdine conjuguée à l'éosine (ils apparaitront rouge). Pour les microtubules, on peut utiliser des anticorps anti-tubuline associés à la fluorescéine (ils apparaitront vert). Les filaments intermédiaires ne sont pas visibles en microscopie optique avec des colorations standards.
Filaments d'actine
[modifier | modifier le code]L'actine G globulaire se polymérise en actine F (filament d'actine), au niveau de l'extrémité + du microfilament tandis qu'il y a dépolymérisation au niveau de l'extrémité - du microfilament. L'actine est associé à de l'ATP avant sa polymérisation, à de l'ADP après sa dépolymérisation. On parle donc de filament polarisé. Un microfilament est une hélice de deux filaments d'actine F, un tour d'hélice correspond à treize actines. Un microfilament a un diamètre d'environ sept nanomètres et une longueur de persistance d'environ 17 micromètres. Ces microfilaments sont très résistants mais leur capacité de déformation est très réduite. L'actine est associée à d'autres protéines (protéine de réticulation) comme la filamine et la fodrine, des protéines de poids moléculaire respectifs 250 et 243 kDa, qui sont à l'origine du réseau tridimensionnel. Le résultat de ces associations est, entre autres, l'augmentation de la viscosité du cytosol. Le moteur moléculaire, ou protéine motrice, associé à ce type de filament est la myosine.
- Structure schématique d'un filament d'actine.
- Constituants d'un filament d'actine.
- Formation d'un filament d'actine.
- Filaments d'actine dans des fibroblastes embryonnaires de souris, colorés à la phalloïdine.
Filaments intermédiaires
[modifier | modifier le code]Les filaments intermédiaires se forment à partir de monomères, associés en dimères, eux-mêmes associés en tétramères. Ils ne sont pas polarisés et ont un diamètre d'une dizaine de nanomètres. Ils se déforment presque proportionnellement à la force exercée et le recouvrement important des dimères et des tétramères permet une très grande résistance aux contraintes mécaniques. On distingue les filaments intermédiaires de kératine, caractérisés par de nombreux ponts disulfures ; les filaments intermédiaires de lamine, constituant la lamina au niveau du noyau ; et les filaments intermédiaires à desmine que l'on retrouve dans les cellules musculaires striées squelettiques et cardiaques et les cellules des muscles lisses.
- Structure schématique d'un filament intermédiaire.
- Constituants d'un filament intermédiaire.
- Formation d'un filament intermédiaire.
- Filaments intermédiaires de kératine dans des cellules embryonnaires.
Microtubules
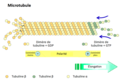
[modifier | modifier le code]Les microtubules sont composés de treize protofilaments, eux-mêmes constitués de dimères de tubuline α et β. Comme pour les microfilaments, la polymérisation du microtubule s'effectue à son extrémité + tandis que la dépolymérisation s'effectue à son extrémité -. Il existe toutefois une exception lors des divisions cellulaires, lors desquelles il y a dépolymérisation à l'extrémité +. Les dimères de tubuline sont associés à du GTP avant leur polymérisation, à du GDP après leur dépolymérisation. Les microtubules ont un diamètre d'environ 25 nanomètres, et leur longueur de persistance est de plusieurs millimètres, ce qui dépasse largement l'échelle de la cellule. Ils ont une capacité d'étirement importante mais une très faible résistance. Les moteurs moléculaires, ou protéines motrices, associés à ce type de filament sont la dynéine, se déplaçant vers l'extrémité - du microtubule, et la kinésine, se déplaçant vers l'extrémité + du microtubule.
- Structure schématique d'un microtubule.
- Constituants d'un microtubule.
- Formation d'un microtubule.
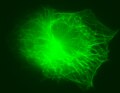
- Microtubules dans une cellule rétinienne.
Les microtubules sont formés au niveau du centre organisateur des microtubules, souvent abrégé en COMT. Il regroupe deux centrioles, formant le centrosome, et du matériel péricentriolaire. Un centriole correspond à neuf triplets de microtubules. Les microtubules en formation sont implantés dans le centre organisateur des microtubules par leur extrémité +.
Assemblage, réseau
[modifier | modifier le code]Les polymères sont organisés en réseaux, faisceaux ou câbles suivant les rôles qu'ils remplissent. Il est important de garder à l'esprit que la structure et la composition du cytosquelette sont hautement dynamiques. Ce haut niveau d'organisation et de labilité est rendu possible par la présence de centaines de protéines auxiliaires associées au cytosquelette : les protéines de pontage (couramment désignées par les termes anglais crosslinkers ou crosslinking proteins), les protéines de branchement (parfois considérées comme un cas particulier des précédentes, mais importantes essentiellement dans le cas des filaments d'actine), les protéines capuchon et les protéines dépolymérisantes (capping, severing proteins), les protéines d'ancrage, et les moteurs moléculaires évoqués précédemment. Les protéines de pontage permettent l'ajout de certains composants (comme le soufre pour le caoutchouc) et conduisent à la formation de pontages entre les chaînes et modifie complètement les propriétés physiques du matériau. Les protéines capuchon et les protéines dépolymérisantes qui régulent les taux de polymérisation des filaments à leurs extrémités.
La référence terminologique au « squelette » des vertébrés est cependant trompeuse puisque la plupart des composantes du cytosquelette sont renouvelées par polymérisation en permanence, les propriétés mécaniques du cytosquelette sont très variables suivant les composantes et les situations considérées, l'activité du cytosquelette a des conséquences dépassant les rôles purement mécaniques (par exemple : la régulation de l'expression génique, la différenciation cellulaire ou la prolifération).
Fonctions
[modifier | modifier le code]Rôle structural
[modifier | modifier le code]

Dans les entérocytes, les microfilaments d'actine sont responsables de l'architecture de la cellule avec notamment le soutien des microvillosités, d'une hauteur de un micromètre. Dans les neurones, ce sont les microtubules qui assurent ce rôle architectural.
La cohésion des tissus est assurée par le cytosquelette. Les ceintures d'adhérence et les points focaux (dont le rôle est important lors du développement embryonnaire) font intervenir des microfilaments d'actine, tandis que les desmosomes et hémidesmosomes font intervenir des filaments intermédiaires de kératine. Les ceintures d'adhérence et desmosomes permettent l'adhérence entre cellules avec l'intervention de protéines telles que les cadhérines, reliées au cytosquelette par une protéine de liaison ou plaque protéique. Les hémidesmosomes et points focaux permettent l'adhérence de la cellule à la matrice extracellulaire avec l'intervention de protéines telles que les intégrines, reliées elles aussi au cytosquelette par une protéine de liaison. Les cadhérines établissent des liaisons homophiliques calcium dépendante tandis que les intégrines établissent des liaisons hétérophiliques calcium dépendante, c'est-à-dire qu'elles nécessitent du calcium pour se réaliser.
Enfin, le rôle structural du cytosquelette se traduit par le positionnement des organites dans le noyau. En particulier, les filaments intermédiaire de lamine forment la lamina, responsable de la position et du maintien de l'enveloppe nucléaire. En effet, lors des divisions cellulaires notamment, la phosphorylation de ces filaments entraîne le disparition de l'enveloppe nucléaire.
Rôle dynamique
[modifier | modifier le code]

Le rôle dynamique correspond aux mouvements de la cellule et dans la cellule. À titre d'exemple, lors du développement embryonnaire, les cellules mésodermiques se déplacent sur la matrice extracellulaire lors de la gastrulation. Ce déplacement fait intervenir les points focaux et les microfilaments d'actine qui, en se polymérisant, permettent la formation de lamellipodes.
Dans le cytoplasme, les microfilaments d'actine, associés à leur protéine motrice, la myosine, permettent le mouvement des organites, notamment des chloroplastes lors de la cyclose. L'actine et la myosine jouent également un rôle important dans la contraction musculaire puisque le raccourcissement des fibres musculaires et permis par le coulissage relatif des myofilaments entre eux. Les sarcomères sont moins longs, ce qui se répercutent à l'échelle du muscle. Les microtubules, associés à la kinésine et la dynéine, permettent l'organisation du trafic vésiculaire.
Lors des divisions cellulaires, les microtubules kinétochoriens permettent la migration des chromosomes (lors de la méiose) ou des chromatides (lors de la mitose) vers les pôles opposés de la cellule. Ils s'y fixent en se polymérisant à leur extrémité + puis les font migrer en se dépolymérisant, toujours à l'extrémité +. Les microtubules polaires permettent l'allongement du fuseau mitotique avec l'intervention des protéines motrices. Il existe aussi des microtubules astériens, disposés en étoile autour des deux centres organisateurs des microtubules de la cellule en division. Les microfilaments d'actine interviennent en particulier lors de la cytodiérèse, permettant la séparation du cytoplasme à l'issue de la télophase.
Autres rôles
[modifier | modifier le code]Cas particuliers
[modifier | modifier le code]Cas des végétaux
[modifier | modifier le code]La forme de la cellule étant principalement définie par l'interaction pression hydrostatique/résistance de la paroi, on constate une moindre importance du cytosquelette : absence de filaments intermédiaires (sauf au niveau du noyau). Le réseau de microtubules est très développé et s'organise en une structure hélicoïdale se plaquant contre la membrane (liaison avec la synthèse des fibres de cellulose de la paroi). En effet la synthèse des fibres de cellulose de la paroi végétale est orientée grâce à des microtubules corticaux le long de la membrane plasmique.
Cas des procaryotes
[modifier | modifier le code]La présence d'un cytosquelette a été mise en évidence chez les procaryotes en 2006, grâce notamment aux travaux de Rut Carballido Lopez et de son équipe[1]. Ceux-ci ont découvert la protéine MreB (en), homologue à la protéine d'actine, et de structure similaire, localisée sous la membrane et semblant jouer un rôle important dans la structure et la forme cellulaire. La protéine FtsZ jouerait également un rôle dans la cytodiérèse des bactéries.
Notes et références
[modifier | modifier le code]- (en) Rut Carballido-López, « The Bacterial Actin-Like Cytoskeleton », Microbiology and Molecular Biology Reviews, vol. 70, no 4, , p. 888-909 (DOI 10.1128/MMBR.00014-06)
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- Raymond Julien (dir.), Jean-Michel Petit et Sébastien Arico, Biologie cellulaire, Dunod, (ISBN 978-2-10-080401-6 et 2-10-080401-4, OCLC 1145890587, lire en ligne).