Phénolphtaléine

| Phénolphtaléine[1] | |
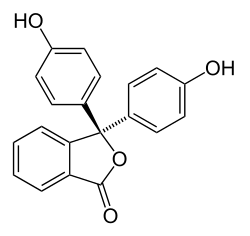 | |
| Représentation de Cram de la phénolphtaléine (forme acide, incolore) | |
| Identification | |
|---|---|
| Nom UICPA | 3,3-bis(4-hydroxyphényl)-2-benzofuran-1(3H)-one (forme acide) |
| No CAS | (acide) (basique) (Na) |
| No ECHA | 100.000.914 |
| No CE | 201-004-7 208-254-6 (Na) |
| Code ATC | A06 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs |
| Propriétés chimiques | |
| Formule | C20H14O4 [Isomères] C20H12O42−,Na+ (Na) |
| Masse molaire[3] | 318,322 8 ± 0,018 2 g/mol C 75,46 %, H 4,43 %, O 20,1 %, 362,28 g.mol−1 (Na) |
| pKa | pKa1 : <0 pKa2 : 9,4[2] |
| Propriétés physiques | |
| T° fusion | 258 à 263 °C |
| Solubilité | eau : 1,4 g.mol−1 |
| Masse volumique | 1,299 |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | Pna21 [4] |
| Paramètres de maille | a = 19,270 Å b = 14,819 Å |
| Volume | 3 253,12 Å3 [4] |
| Précautions | |
| SGH | |
| Directive 67/548/EEC | |
Phrases R : acide : 22 - 45 - 62 - 68 | |
| Classification du CIRC | |
| Groupe 1B : Peut provoquer le cancer[5] | |
| Considérations thérapeutiques | |
| Classe thérapeutique | laxatifs de contact |
| Voie d’administration | orale |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
La phénolphtaléine ou 3,3-bis(4-hydroxyphényl)-1-(3H)-monobenzofuranone (le symbole φφ (phi-phi) ou la notation générale HIn, commune à d'autres indicateurs, sont utilisés) est un composé organique de formule brute C20H14O4. C'est un indicateur de pH (ou un indicateur coloré), c'est-à-dire un composé qui change de couleur selon la valeur du pH de la solution dans laquelle on le place.
Histoire
[modifier | modifier le code]La phénolphtaléine fut découverte et synthétisée en 1871 par Adolf von Baeyer, par condensation d'une molécule d'anhydride phtalique avec deux molécules de phénol en milieu acide. La molécule tire son nom de la contraction de ceux des deux réactifs.
Structure chimique de la phénolphtaléine
[modifier | modifier le code]Le changement de couleur de la phénolphtaléine est due à la modification de la structure chimique de la molécule lors du passage de la forme protonée (milieu acide) à celle de sa forme déprotonée (milieu basique). Dans le cas de la phénolphtaléine, la forme acide présente une structure aromatique (présence de 3 cycles benzéniques) alors que la forme basique est de type quinoïdique.
La forme basique de la phénolphtaléine est un dianion ; cette charge est compensée par un dication ou par deux monocations. Par exemple, dans un milieu contenant de l'hydroxyde de sodium NaOH, la charge de la forme basique est compensée par deux ions Na+. Il s'agit donc d'un sel de disodium.
| Espèce | H3In+ | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| Structure |  |  |  |  |
| Structure 3D |  |  |  |  |
| pH | < 0 | 0−8,2 | 8,2−12,0 | > 12,0 |
| Conditions | Très acide | acide à peu basique | basique | très basique |
| Couleur | orange | incolore | rose à fuchsia | incolore |
| Image |  |  |
Réaction en présence de base
[modifier | modifier le code]En solution, la phénolphtaléine peut se présenter sous plusieurs formes en fonction de la quantité relative de base présente dans le milieu (l'explication présente exclut le cas des pH très acides).
- I. Pour des solutions acides : la phénolphtaléine est sous sa forme dite acide. La molécule possède un cycle de type lactone (A).
- II. Lors d'un ajout de base, le cycle lactone s'ouvre et évolue vers une structure triphénylcarbinol (non représentée) et cela amène la perte d'une molécule d'eau dans la structure et on forme une espèce ionique de couleur rouge pourpre (la longueur d'onde majoritairement absorbée se trouvant vers 550 nm). Cette espèce est décrite par deux formes mésomères (B1 et B2). La forme mésomère B2 laisse apparaître un système conjugué sur l'ensemble de la molécule. Ce système conjugué étendu est à l'origine de la coloration
- IV. Pour un excès de base, la coloration pourpre disparait et le milieu redevient incolore traduisant la formation en solution du composé (C), ce composé ne possédant pas un système conjugué étendu.

 |
| Une animation du mécanisme de transformation: H3In+ → H2In → In2− → In(OH)3− |
Indicateur de pH
[modifier | modifier le code]La phénolphtaléine fait partie de la famille des phtaléines, c'est-à-dire les indicateurs colorés qui dérivent du triphénylméthane et qui possèdent un cycle lactone R-COO-R.
| Couleurs de la phénolphtaléine | forme acide incolore | zone de virage[2] pH 8,2 à pH 10,0 | forme basique rose |

- Sous forme acide, la phénolphtaléine est incolore alors que sa forme basique est de couleur rose vif. Son est de 9.4 ce qui signifie que le virage (c'est-à-dire le changement de coloration) de cet indicateur se fait en milieu basique. Sa zone de virage est située entre un de pH = 8,2 (passage de l'incolore au rose) et 10,0. Autrement dit, la phénolphtaléine est un marqueur pour les solutions basiques, c’est-à-dire ayant un pH > 7.
- Deux autres zones de virage peu connues et très peu utilisées peuvent caractériser la phénolphtaléine. L'une se situe à pH ≈ 0, la molécule prend une teinte orange pour des pH négatifs. L'autre se situe en milieu très basique, la phénolphtaléine passe alors du rose à l'incolore couleur rose très clair.
Laxatif
[modifier | modifier le code]La phénolphtaléine a aussi été utilisée en médecine humaine comme laxatif de contact (irritant ou stimulant) dès 1906, à la dose de 200 mg par jour par voie orale, jusqu'au retrait de la plupart des médicaments en contenant à la suite de la découverte de son caractère cancérogène à haute dose[6]. D'autres laxatifs, tels que le bisacodyl, sont de structure apparentée.
Remplacement
[modifier | modifier le code]Du fait de sa toxicité (la phénolphtaléine est un cancérogène avéré), l'INRS recommande de remplacer cet indicateur coloré par une autre molécule[7].
Références
[modifier | modifier le code]- Acros Organics, Reference Handbook of Fine Chemicals, p.1459-1460
- (en) David R. Lide, Handbook of Chemistry and Physics 84th edition (2003/2004), CRC Press, 2004, p.8-20
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Phenolphthalein », sur reciprocalnet.org (consulté le ).
- UDPPC, « Chimie : produit en question-la phénolphtaléine », sur national.udppc.asso.fr, CIRC, (consulté le ).
- (en) Sheryl Gay Stolberg, « 3 Versions of Ex-Lax Are Recalled After F.D.A. Proposes Ban on Ingredient », The New York Times, (lire en ligne
 , consulté le ).
, consulté le ). - « Phénolphtaléine. Laboratoire de chimie - Brochure - INRS », sur inrs.fr (consulté le ).

