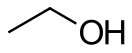
Этанол

| Этанол | |||
|---|---|---|---|
  | |||
| Общие | |||
| Систематическое наименование | Этанол, эти́лгидрат, мети́лкарбино́л | ||
| Сокращения | Спи́рт | ||
| Традиционные названия | Эти́ловый спи́рт | ||
| Хим. формула | |||
| Рац. формула | |||
| Физические свойства | |||
| Состояние | Жидкость | ||
| Молярная масса | 46,069 г/моль | ||
| Плотность | 0,78945 г/см3 (при 20 °C)[1][нет в источнике] | ||
| Поверхностное натяжение | 22,39×10−3 Н/м при 20 °C Н/м | ||
| Динамическая вязкость | 1,2 мПа·с (при 20 °C) | ||
| Энергия ионизации | 10,47 ± 0,01 эВ[5] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −114,3 °C | ||
| • кипения | +78,39[2] °C | ||
| • вспышки | 13 °C | ||
| • самовоспламенения | +363 °C | ||
| Пределы взрываемости | 3,28—18,95 % | ||
| Тройная точка | −114,3 °C; 0,43 мПа | ||
| Критическая точка | +241 °C; 6,137 МПа | ||
| Мол. теплоёмк. | 112,4 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −234,8 кДж/моль | ||
| • сгорания | −1367 кДж/моль[3] | ||
| Давление пара | 5,95 кПа (при 20 °С) | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 16 ± 0,01[6] | ||
| Растворимость | |||
| • в воде | Неограниченно | ||
| Оптические свойства | |||
| Показатель преломления | 1,3611 | ||
| Структура | |||
| Дипольный момент | (газ) 1,69 Д | ||
| Классификация | |||
| Рег. номер CAS | 64-17-5 | ||
| PubChem | 702 | ||
| Рег. номер EINECS | 200-578-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | KQ6300000 | ||
| ChEBI | 16236 | ||
| Номер ООН | 1170 | ||
| ChemSpider | 682 | ||
| Безопасность | |||
| Предельная концентрация | 1г/м3[4] | ||
| ЛД50 | 10 300 мг/кг | ||
| Токсичность | Метаболит, малотоксичен | ||
| Краткие характер. опасности (H) | H225, H319 | ||
| Меры предостор. (P) | P210, P240, P305+P351+P338, P403+P233 | ||
| Сигнальное слово | опасно | ||
| Пиктограммы СГС | | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Этано́л (эти́ловый спирт, эти́лгидра́т, мети́лкарбино́л, ви́нный спи́рт или алкого́ль, в просторечии — спирт), химическая формула в разных вариантах записи — или или — органическое соединение, относящееся к классу одноатомных первичных спиртов.
При стандартных условиях, этанол — это летучая, горючая, бесцветная прозрачная жидкость с характерным запахом и жгучим сладковатым вкусом.
Действующий компонент алкогольных напитков. Является депрессантом — психоактивным веществом, угнетающим центральную нервную систему человека[7].
Свойства
[править | править код]Физические свойства
[править | править код]В обычных условиях представляет собой бесцветную, легкоподвижную, летучую жидкость с характерным запахом и жгучим вкусом.
Плотность этилового спирта 0,789 г/см3 при 20 °C, он легче воды.
Является хорошим растворителем многих органических веществ и некоторых неорганических солей.
Физические свойства абсолютированного этанола (100 %) немного отличаются от свойств спирта-ректификата с концентрацией 95,57 %. Их физические свойства почти одинаковы, но численно различаются на 0,1—0,01 %.
| Молекулярная масса | 46,069 а. е. м. |
| Температура замерзания | −114,15 °C |
| Температура кипения | 78,39 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | Смешивается в произвольных отношениях с бензолом, водой, глицерином, диэтиловым эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом |
| Показатель преломления | Показатель преломления (для D-линии натрия) 1,3611 (при 20 °C) (температурный коэффициент показателя преломления −4,0⋅10−4/°C, почти постоянный в интервале температур 10—30 °C) |
| Стандартная энтальпия образования ΔH | −234,8 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 281,38 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 1,197 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHплав | 4,81 кДж/моль |
| Энтальпия кипения ΔHкип | 839,3 кДж/моль |
 |  |
Смесь по массе 95,57 % этанола и 4,43 % воды является азеотропной, т. е. не разделяется при перегонке, при нормальном давлении температура кипения составляет 78,174 °C, в то время как абсолютированный этанол имеет более высокую точку кипения в 78,39 °C[2][9].
С водой этанол смешивается в произвольном отношении, при смешивании наблюдается значительное, до нескольких процентов уменьшение объёма смеси относительно исходного суммарного объёма чистых веществ, например, при смешивании 50 мл этанола с 50 мл воды образуется 97 мл раствора. Также смешивание сопровождается некоторым нагреванием смеси.
Абсолютный этанол затвердевает при температуре −114,5 °C[10]. Температура плавления смесей этанола с водой уменьшается при увеличении концентрации этанола в растворе и достигает минимума при массовой концентрации этанола в воде равной 93,5 % — эвтектики этанол-вода, имеющей температуру плавления −118 °C[11]. При низких температурах, ниже −20 °С водный раствор этанола (96 %) практически не испаряется и превращается в вязкую жидкость. При −70°C он становится ещё более вязким и по текучести напоминает густой мёд.
Давление насыщенного пара
[править | править код]| t | 10°С | 20°С | 30°С | 40°С | 50°С | 60°С | 70°С | 80°С | 90°С | 100°С | 110°С | 120°С | 130°С | 140°С |
| P, мм рт.ст. | 23,6 | 43,9 | 79,2 | 135,3 | 222,2 | 352,7 | 543,6 | 809,7 | 1170,4 | 1651,5 | 2280,2 | 3087,5 | 4107,9 | 5380,2 |
| P, 105 Па | 0,0315 | 0,0585 | 0,1056 | 0,1804 | 0,2962 | 0,4702 | 0,7247 | 1,0795 | 1,5604 | 2,2018 | 3,04 | 4,1163 | 5,4767 | 7,173 |
| P, атм | 0,0311 | 0,0578 | 0,1042 | 0,1780 | 0,2924 | 0,4641 | 0,7153 | 1,0654 | 1,5400 | 2,1730 | 3,0003 | 4,0625 | 5,4051 | 7,0792 |
При температуре от −31 до 78 °С давление насыщенного пара этанола с хорошей точностью может быть вычислено по эмпирической формуле:
- где — давление, выражено в кПа;
- — температура в °C.
Химические свойства
[править | править код]
Типичный представитель одноатомных спиртов.
Горюч. Легко воспламеняется. При достаточном доступе воздуха горит (за счёт его кислорода) светлым голубоватым пламенем, образуя конечные продукты окисления — диоксид углерода и воду:
- .
Ещё энергичнее данная реакция протекает в атмосфере чистого кислорода.
При определённых условиях (температура, давление, катализаторы) возможно и контролируемое окисление (как элементарным кислородом, так и многими другими окислителями) до ацетальдегида, уксусной кислоты, щавелевой кислоты и некоторых других продуктов, например:
- .
Обладает слабо выраженными кислотными свойствами, в частности, подобно кислотам взаимодействует со щелочными металлами, а также магнием, алюминием и их гидридами, выделяя при этом водород и образуя солеподобные этилаты, являющиеся типичными представителями алкоголятов:
- .
Обратимо реагирует с карбоновыми и некоторыми неорганическими кислородсодержащими кислотами с образованием сложных эфиров:
- .
С галогеноводородами (HCl, HBr, HI) вступает в обратимые реакции нуклеофильного замещения:
- .
Без катализаторов реакция с HCl идёт относительно медленно; значительно быстрее — в присутствии хлорида цинка и некоторых других кислот Льюиса.
Вместо галогеноводородов для замещения гидроксильной группы на галоген могут быть использованы галогениды и галогеноксиды фосфора, тионилхлорид и некоторые другие реагенты, например:
- .
Сам этанол также обладает нуклеофильными свойствами. В частности, он относительно легко присоединяется по активированным кратным связям, например:
- .
Реагирует с альдегидами с образованием полуацеталей и ацеталей:
- .
При умеренном (не выше 120 °C) нагревании с концентрированной серной кислотой или другими водоотнимающими средствами кислотного характера образует диэтиловый эфир:
- .
При более сильном нагревании с серной кислотой, а также при пропускании паров над нагретым до 350—500°C оксидом алюминия происходит более глубокая дегидратация. При этом образуется этилен:
- .
При использовании катализаторов, содержащих наряду с оксидом алюминия высокодисперсное серебро и другие компоненты, процесс дегидратации может быть совмещён с контролируемым окислением этилена элементным кислородом, в результате чего с удовлетворительным выходом удаётся реализовать одностадийный процесс получения окиси этилена:
- .
В присутствии катализатора, содержащего оксиды алюминия, кремния, цинка и магния, претерпевает серию сложных превращений с образованием в качестве основного продукта бутадиена (реакция С. В. Лебедева):
- .
В 1932 году на основе этой реакции в СССР было организовано первое в мире крупнотоннажное производство синтетического каучука.
В слабощелочной среде образует иодоформ:
- .
Эта реакция имеет некоторое значение для качественного и количественного определения этанола в отсутствие других веществ, дающих подобную реакцию.
Пожароопасность
[править | править код]В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Легковоспламеняющаяся бесцветная жидкость; удельная теплота сгорания — 30 МДж/кг (1408 кДж/моль;), теплота образования −239,4 кДж/моль; температура вспышки 13 °С (в закрытом тигле), 16 °С (в открытом тигле); температура воспламенения 18 °С; температура самовоспламенения 400 °С; концентрационные пределы распространения пламени 3,6—17,7 % об.; температурные пределы распространения пламени: нижний 11 °С, верхний 41 °С; минимальная флегматизирующая концентрация негорючих газов, % объёмных: CO2 — 29,5, H2O — 35,7, N2 — 46; максимальное давление взрыва 682 кПа; максимальная скорость нарастания давления 15,8 МПа/с; скорость выгорания 0,037 кг/(м2·с); максимальная нормальная скорость распространения пламени — 0,556 м/с; минимальная энергия зажигания — 0,246 МДж; минимальное взрывоопасное содержание кислорода 11,1 % объёмных.
Получение
[править | править код]Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена).
Брожение
[править | править код]Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала картофеля, риса, кукурузы. Источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её результат можно выразить уравнением:
- .
Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путём дистилляции.
Для получения этанола данным способом наиболее часто используют различные штаммы дрожжей вида Saccharomyces cerevisiae, в качестве питательной среды предварительно обработанные древесные опилки и/или раствор, полученный из них.
Промышленное производство спирта из биологического сырья
[править | править код]Современная промышленная технология получения этилового спирта из пищевого сырья включает следующие стадии:
- Подготовка и измельчение крахмалистого сырья — зерна (прежде всего — ржи, пшеницы), картофеля, кукурузы, яблок и т. п.
- Ферментация. На этой стадии происходит ферментативное расщепление крахмала до сбраживаемых сахаров. Для этих целей применяются рекомбинантные препараты альфа-амилазы, полученные биоинженерным путём — глюкамилаза, амилосубтилин.
- Брожение. Благодаря сбраживанию дрожжами сахаров происходит накопление в браге спирта.
- Брагоректификация. Осуществляется на разгонных колоннах.
Отходами бродильного производства являются углекислый газ, барда, эфиро-альдегидная фракция, сивушный спирт и сивушные масла.
Спирт, поступающий из брагоректификационной установки (БРУ), не является безводным, содержание этанола в нём не более 95,6 %. В зависимости от содержания в нём посторонних примесей, его разделяют на следующие категории:
- Альфа;
- Люкс;
- Экстра;
- базис;
- высшей очистки;
- 1-й сорт.
Производительность современного спиртового завода составляет около 30 000—100 000 литров спирта в сутки.
Гидролизное производство
[править | править код]В промышленных масштабах этиловый спирт получают из сырья, содержащего целлюлозу (древесина, солома), которую предварительно гидролизуют. Образовавшуюся при этом смесь пентоз и гексоз подвергают спиртовому брожению. В странах Западной Европы и Америки эта технология не получила распространения, но в СССР (ныне в России) существовала развитая промышленность кормовых гидролизных дрожжей и гидролизного этанола.
Гидратация этилена
[править | править код]В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию проводят по двум схемам:
- прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
- ;
- гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа):
- ,
- .
Эта реакция сопровождается параллельной нежелательной реакцией образования диэтилового эфира.
Очистка этанола
[править | править код]Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95,6 % (мас.); эта неразделимая перегонкой азеотропная смесь содержит 4,4 % воды (мас.) и имеет температуру кипения 78,15 °C.
Перегонка освобождает этанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт
[править | править код]Абсолютный спирт — этиловый спирт, практически не содержащий воды. Он кипит при температуре 78,39 °C, в то время как спирт-ректификат, содержащий не менее 4,43 % воды, кипит при 78,15 °C. Получают перегонкой водного спирта, содержащего бензол, и другими способами[13], например, спирт обрабатывают веществами, реагирующими с водой или поглощающими воду, такими, как негашёная известь CaO или прокалённый медный купорос CuSO4[14].
Применение
[править | править код]Этанол используется как топливо, в качестве растворителя, как сырье в химической промышленности, в медицине — как дезинфицирующее средство и др.
Топливо
[править | править код]Первым использовал этанол в качестве моторного топлива Генри Форд, который в 1880 году создал первый автомобиль, работающий на этаноле. Возможность использования спиртов в качестве моторного топлива была показана также в 1902 году, когда на конкурсе в Париже были выставлены более 70 карбюраторных двигателей, работающих на этаноле и смесях этанола с бензином[15]. Этанол характеризуется высоким октановым числом, что делает его пригодным для бензиновых двигателей с высокой степенью сжатия.
Этанол может использоваться как топливо, в т. ч. для ракетных двигателей (так, этанол использовался в качестве топлива в первой в мире серийной баллистической ракете — немецкой «Фау-2» и ранних советских ракетах конструкции Королёва — от Р-1 до Р-5), двигателей внутреннего сгорания, бытовых, походных и лабораторных нагревательных приборов (т. н. «спиртовок»), грелок для туристов и военнослужащих (каталитическое автоокисление на платиновом катализаторе). Ограниченно (в силу своей гигроскопичности) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов — этил-трет-бутилового эфира, более независимого от ископаемой органики, чем МТБЭ.
Химическая промышленность
[править | править код]- служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
- широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
- является компонентом антифризов и стеклоомывателей;
- в бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
Медицина
[править | править код]
- по своему действию этиловый спирт можно отнести к антисептикам;
- как обеззараживающее и подсушивающее средство, наружно;
- подсушивающие и дубящие свойства 97%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
- растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.;
- консервант настоек и экстрактов (минимальная концентрация 18 %);
- пеногаситель при подаче кислорода, искусственной вентиляции лёгких;
- в согревающих компрессах;
- для физического охлаждения при лихорадке (для растирания)[16];
- компонент общей анестезии в ситуации дефицита медикаментозных средств;
- как пеногаситель при отёке лёгких в виде ингаляции 33 % раствора;
- этанол является противоядием при отравлении некоторыми токсичными спиртами, такими, как метанол и этиленгликоль. Его действие обусловлено тем, что фермент алкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного (почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола — формальдегида и муравьиной кислоты, для этиленгликоля — щавелевой кислоты)[17].
Парфюмерия и косметика
[править | править код]Является универсальным растворителем различных веществ и основным компонентом духов, одеколонов, аэрозолей и т. п. Входит в состав разнообразных средств, включая зубные пасты, шампуни, средства для душа, и т. д.
Пищевая промышленность
[править | править код]Наряду с водой, является основным компонентом спиртных напитков (водка, вино, джин, пиво и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1—3 % этанола (в крепком до 4,5 %), в квасе — от 0,5 до 1,2 %[18].
Растворитель для пищевых ароматизаторов. Может быть использован как консервант для хлебобулочных изделий, а также в кондитерской промышленности[19].
Зарегистрирован в качестве пищевой добавки E1510[20].
Энергетическая ценность этанола — 7,1 ккал/г.
Прочее
[править | править код]Применяется для фиксирования и консервирования биологических препаратов. Используется для удаления пятен, например, древесной смолы. Благодаря низкой температуре замерзания водных растворов, может использоваться как теплоноситель в системах охлаждения.
Применение этанола в составе моторного топлива
[править | править код]Топливный этанол делится на биоэтанол и этанол, полученный другими методами (из отходов пластмасс, синтезированный из газа и т. п.).
Биоэтанол — это жидкое этанолсодержащее топливо, получаемое специальными заводами из крахмал-, целлюлозно- или сахаросодержащего сырья по укороченной дистилляции (что позволяет получать качество, достаточное для использования в качестве топлива). Содержит наряду с этанолом метанол и сивушные масла, что делает его совершенно непригодным для питья[21].
Применяется в чистом виде (точнее в виде азеотропа 96,6 %), а чаще в смеси с бензином (так называемый газохол) или дизельным топливом.
Производство и использование биоэтанола увеличивается в большинстве стран мира, как более экологичная и возобновляемая альтернатива нефти[22] (недоступная ссылка).
Полноценно использовать биоэтанол способны лишь автомобили с соответствующим двигателем или с универсальным Flex-Fuel (способен применять смеси бензин/этанол с любым соотношением). Обычный бензиновый двигатель способен потреблять бензин с добавкой этанола не более 30 %, возможно также переоборудование обычного бензинового двигателя, но это экономически нецелесообразно.
Некоторой проблемой является недостаточная смешиваемость бензина и дизельного топлива с этанолом, из-за чего происходит расслоение смеси (при низких температурах всегда). Особенно эта проблема актуальна для стран с холодным климатом. Решения этой проблемы на данный момент не найдено[23].
Преимуществом смесей этанола с другими видами топлива перед чистым этанолом является лучшая зажигаемость, благодаря низкому содержанию влаги, тогда как чистый этанол (марка E100, с практическим содержанием C2H5OH 96,6 %) является неразделяемым дистилляцией азеотропом. Разделение же иными способами невыгодно. При добавлении этанола к бензину или дизельному топливу происходит отслаивание воды.
В разных странах действуют следующие государственные программы применения этанола и содержащих его смесей на транспорте с двигателями внутреннего сгорания[23][24][25]:
| Бразилия | 22—25 % этанола в бензине, 2 % в дизельном топливе[26], доступны высокоэтанольные марки (E85, E100), их процент на рынке плавно увеличивают. Основной источник — сахарный тростник. Около 25-30 % мирового производства топливного спирта. |
| США | Внедряются марки смеси этанола и бензина (E85, E10). Предполагается ввести 20 % к 2020 году[уточнить]. Около 55—60 % мирового производства топливного спирта. |
| Венесуэла | 10 % этанола в бензине. |
| Евросоюз | До ~6 % добавляется в обязательном порядке, внедряются этанольные марки E10 и выше[27][28]. |
| Аргентина | Обязательна 5 % добавка этанола в любых марках бензина, внедряются марки с большим содержанием. |
| Таиланд | 5 % этанола является минимальным допустимым содержанием в бензине. |
| Украина | Законодательно установлено содержание 5 % этанола в бензине с 2013, и 7 % с 2014 года. На заправках широко продается топливо с содержанием биоэтанола от 30 до 37,2 % |
| Колумбия | 10%-я смесь в больших городах к сентябрю 2005 года. |
| Канада | 5%-я смесь с 2010 года[29] |
| Япония | Разрешено 3%-е содержание этанола в бензине и менее[30]. |
| Индия | Была заявлена цель в 20 % биотоплив к 2017 году[31]. Сейчас[когда?] 5 %[уточнить]. Производится из самого различного сырья, в частности из древесной стружки. |
| Австралия | Этанола в бензине не более 10 %, марка E10. |
| Индонезия | 10 % спирта в бензине. |
| Филиппины | E10 постепенно внедряется. |
| Ирландия | Марки E5—E10 достаточно широко применяются и продолжат внедряться. |
| Дания | Аналогично Ирландии. |
| Чили | Разрешено 2 % содержание этанола в автомобильном топливе. |
| Мексика | 3,2 % биотоплива в автомобильном топливе, обязательно с 2012 года[32]. В Америке самая неохотно внедряющая биотопливо страна. |
Внедрение производства биотоплива является затратным процессом, однако дает экономике преимущества впоследствии. Так, например, строительство завода по производству этанола мощностью 40 млн галлонов даёт экономике (на примере США):
- 142 млн долл. инвестиций во время строительства;
- 41 рабочее место на заводе, плюс 694 рабочих места во всей экономике;
- Увеличивает местные цены на зерновые на 5—10 центов за бушель;
- Увеличивает доходы местных домохозяйств на 19,6 млн долл. ежегодно;
- Приносит в среднем 1,2 млн долларов налогов;
- Доходность инвестиций 13,3 % годовых[33].
В 2006 году этаноловая индустрия дала экономике США:
- 160231 новое рабочее место во всех секторах, включая 20 000 рабочих мест в строительстве;
- Увеличила доходы домохозяйств на $6,7 миллиарда;
- Принесла $2,7 млрд федеральных налогов и $2,3 млрд местных налогов[26].
В 2006 году в США было переработано в этанол 2,15 миллиарда бушелей[что?][уточнить] кукурузы, что составляет 20,5 % годового производства кукурузы. Этанол стал третьим по величине потребителем кукурузы после животноводства и экспорта. На этанол перерабатывается 15 % урожая сорго США. Побочным продуктом производства этанола является барда, которая используется как вторичное кормовое сырьё, а также может быть использована для получения биогаза.
В США «Энергетический билль», подписанный президентом Бушем в 2005 году, предусматривал производство к 2012 году ежегодно 30 миллиардов литров этанола из зерна и 3,8 млрд литров из целлюлозы (стебли кукурузы, рисовая солома, отходы лесной промышленности)[34].
Мировое производство топливного этанола
[править | править код]Производство этанола на топливо по странам, млн литров. Данные по ежегодным отчетам Renewable Fuels Association Архивная копия от 17 мая 2008 на Wayback Machine.
| Страна | 2004[35] | 2009[36] | 2014[37] | 2019[38] |
|---|---|---|---|---|
| США | 13 381 | 40 125 | 54 131 | 59 809 |
| Бразилия | 15 100 | 24 900 | 23 432 | 32 630 |
| Евросоюз | 3 935 | 5 470 | 5 451 | |
| Китай | 3 649 | 2 050 | 2 404 | 3 407 |
| Индия | 1 749 | 347 | 587 | 2 006 |
| Канада | 231 | 1 100 | 1 931 | 1 893 |
| Таиланд | 280 | 1 647 | 1 173 | 1 590 |
| Аргентина | 159 | — | 606 | 1 098 |
| Россия | 750 | 517[источник не указан 1404 дня] | — | — |
| ЮАР | 416 | — | — | — |
| Франция | 829 | |||
| Великобритания | 401 | |||
| Весь мир | 40 769 | 73 948 | 93 008 | 110 155 |
Автомобильный парк, работающий на этаноле
[править | править код]Смесь этанола с бензином обозначается буквой Е. Цифрой у буквы Е обозначается процентное содержание этанола. Е85 означает смесь из 85 % этанола и 15 % бензина.
Смеси до 20 % содержания этанола могут применяться на любом автомобиле. Однако некоторые производители автомобилей ограничивают гарантию при использовании смеси с содержанием более 10 % этанола. Смеси, содержащие более 20 % этанола, во многих случаях требуют внесения изменения в систему зажигания автомобиля.
Автопроизводители выпускают автомобили, способные работать и на бензине, и на Е85. Такие автомобили называются «Flex-Fuel». В Бразилии такие автомобили называют «гибридными». В русском языке названия нет. Большинство современных автомобилей либо изначально поддерживает использование такого топлива, либо опционально, по соответствующему запросу.
В 2005 году в США более 5 млн автомобилей имели гибридные двигатели. В конце 2006 года в США эксплуатировалось 6 млн автомобилей с такими двигателями. Общий автопарк составляет 230 млн автомобилей.
1200 заправочных станций продают Е85 (май 2007). Всего в США автомобильное топливо продают около 170 000 заправочных станций.
В Бразилии около 29 000 заправочных станций продают этанол.
Экономичность
[править | править код]Себестоимость бразильского этанола (около 0,19 долларов США за литр в 2006 году) делает его использование экономически выгодным [3] Архивная копия от 15 июля 2014 на Wayback Machine.
Экологические аспекты
[править | править код]Биоэтанол как топливо часто называют «нейтральным» в качестве источника парниковых газов. Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующем сгорании выделяется столько же CO2, сколько до этого было взято из атмосферы использованными для его производства растениями. Однако ректификация этанола требует дополнительных затрат энергии, вырабатываемой одним из «традиционных» способов (в том числе и сжиганием ископаемого топлива).
В 2006 году применение этанола в США позволило сократить выбросы около 8 млн тонн парниковых газов (в СО2 эквиваленте), что примерно равно годовым выхлопам 1,21 млн автомобилей.
Безопасность и регулирование
[править | править код]
- Этанол — горючее вещество, смесь его паров с воздухом взрывоопасна.
- При приёме внутрь этанол отрицательно влияет на организм человека, употребление этанола является наиболее значимым фактором сокращения продолжительности жизни[39][40].
- О налогообложении питьевого спирта и напитков с ним см. Алкогольные напитки — Акциз
В России
[править | править код]- Спирт этиловый синтетический, технический и пищевой, непригодный для производства алкогольной продукции, входит в список ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации[41].
- С 2005 года розничная продажа спирта в России запрещена (за исключением районов Крайнего Севера)[42].
- Этанол как горючая жидкость относится к опасным веществам. Промышленные предприятия, использующие в технологическом процессе более 1 тонны этанола, обязаны быть зарегистрированы как опасные производственные объекты[43][нет в источнике].
Действие этанола на организм человека
[править | править код]В биохимии этанола существенную роль играет тот факт, что он образует растворы в широком диапазоне пропорций как с водой, так и с жирами. Является побочным продуктом метаболизма глюкозы, в крови здорового человека может содержаться до 0,01 % эндогенного этанола, являющегося продуктом метаболизма[44].
При приёме внутрь этанол обладает наркотическим и токсическим действием[44], в зависимости от дозы, концентрации, пути попадания в организм и длительности воздействия его действие различается[45]. Любая доза алкоголя приносит вред организму, безопасной его дозы не существует[40][46].
Под наркотическим действием обозначается его способность вызывать кому, ступор, нечувствительность к боли[47], угнетение функций ЦНС, алкогольное возбуждение[48], привыкание[49], а также его наркозное действие[50]. Под действием этанола происходит выделение эндорфинов в прилежащем ядре (Nucleus accumbens), у страдающих алкоголизмом — также в орбитофронтальной коре (поле 10)[51]. Тем не менее с юридической точки зрения этиловый спирт наркотиком не признан, так как это вещество не включено в международный список контролируемых веществ конвенции ООН 1988 года[52]. В определённых дозах к массе тела и концентрациях приводит к острому отравлению и смерти.
Основной метаболит этанола ацетальдегид является токсичным, мутагенным[53] и, возможно, канцерогенным веществом[54]. Существуют доказательства канцерогенности ацетальдегида в экспериментах на животных; кроме того, ацетальдегид повреждает ДНК[53].
Длительное употребление этанола может вызвать такие заболевания, как цирроз печени[55], гастрит[56], некротизирующий панкреатит[57], язва желудка[58], рак груди[59][60], рак желудка[61] и рак пищевода[62] (то есть является канцерогеном[63]), гемолитическая анемия[64], артериальная гипертензия[65], инсульт[66], стать причиной внезапной смерти людей, страдающих ишемической болезнью сердца[67]:159; может вызвать серьёзные нарушения обмена веществ[67]:157. Алкоголь может увеличить риск рождения ребёнка с врождёнными аномалиями нервной системы и обусловить задержку роста[68].
Употребление этанола может вызвать оксидативное повреждение нейронов головного мозга[69], а также их гибель вследствие повреждения гемато-энцефалического барьера[69].
Злоупотребление алкогольными напитками может привести к клинической депрессии[70][71][72] и алкоголизму[73].
Приём алкогольных напитков на фоне приёма лекарств очень нежелателен, так как алкоголь извращает действие лекарственных средств и вследствие этого становится опасен для жизни человека. Отрицательное влияние алкогольных напитков на результаты фармакотерапии многообразно и зависит от различных факторов: индивидуальных свойств больного, его чувствительности, тяжести заболевания, но во всех случаях у пациентов, принимающих лекарства и потребляющих алкоголь, эффективность фармакотерапии ослабляется, а порой и сводится на нет[67]:157,159.
Этанол может в небольших количествах синтезироваться в просвете желудочно-кишечного тракта в результате процессов ферментации углеводной пищи микроорганизмами (условный эндогенный алкоголь)[74]. Существование биохимических реакций с синтезом этанола в тканях организма человека (истинно эндогенный алкоголь) полагается возможным, но не доказано к настоящему моменту[75][76]. Количество эндогенного алкоголя редко превышает 0,18 промилле, что находится на границе чувствительности самых современных приборов. Обычный алкотестер такое количество определить не может[77].
Опасность вдыхания паров
[править | править код]Этанол может наносить вред здоровью и при вдыхании паров при достаточно большой концентрации. В РФ установлена ПДК этого вещества: 1000 мг/м3 (среднесменная, за 8 часов) и 2000 мг/м3 (максимальная разовая). По классу опасности этиловый спирт отнесён к 4-му классу[78] опасности (малоопасное вещество).
Виды и марки этанола
[править | править код]- Ректификат (точнее, спирт-ректификат) — это очищенный путём ректификации этиловый спирт, содержит 95,57 %,.
- Спирт этиловый абсолютированный — содержание спирта >99,9 %.
- Спирт медицинский — содержание спирта 96,4—97 %.
Этимология названий
[править | править код]Для обозначения данного вещества используется несколько наименований. Технически наиболее правильным является термин этанол или этиловый спирт. Однако значительное распространение получили названия алкоголь, винный спирт или просто спирт, хотя спирты, или алкоголи — это более широкий класс веществ.
Этимология термина «этанол»
[править | править код]Названия этанол и этиловый спирт указывают на то, что данное соединение содержит в своей основе этил — радикал этана. При этом слово спирт (суффикс -ол) в названии указывает на содержание гидроксильной группы (-OH), характерной для спиртов.
Этимология названия «алкоголь»
[править | править код]Название алкоголь происходит от араб. الكحل аль-кухуль, означающего мелкий порошок, полученный возгонкой[79], порошкообразная сурьма[80], порошок для подкрашивания век[81]. В средневековой латыни словом лат. alcohol обозначали порошки, дистиллированную воду[82][83].
В русский язык слово «алкоголь» пришло через его немецкий вариант нем. Alkohol. Однако в русском языке сохранился в виде архаизма, по всей видимости, и омоним слова «алкоголь» в значении «мелкий порошок»[84].
Этимология слова «спирт»
[править | править код]Наименование этанола винный спирт произошло от лат. spiritus vini (дух вина). В русский язык слово «спирт» пришло через английский его вариант англ. spirit[85].
В английском языке слово «спирт» в данном значении использовалось уже в середине XIII века, и только начиная с 1610 года слово «спирт» стало употребляться алхимиками для обозначения летучих веществ, что соответствует основному значению слова «spiritus» (испарения) в латинском языке[86]. К 1670-м годам значение слова сузилось до «жидкостей с высоким процентным содержанием алкоголя»[87], а летучие жидкости получили название эфиров[88].
См. также Этимология названия в статье «Спирты».
См. также
[править | править код]Примечания
[править | править код]- ↑ CRC Handbook of Chemistry and Physics - 102nd Edition - John Rumble. Taylor & Francis. Дата обращения: 19 сентября 2021. Архивировано 5 октября 2021 года.
- ↑ 1 2 3 Этиловый спирт: химические и физические свойства. Дата обращения: 28 сентября 2012. Архивировано 6 декабря 2012 года.
- ↑ https://sites.google.com/site/ellesmerealevelchemistry/module-3-periodic-table-energy/3-2-physical-chemistry-1/3-2-1-enthalpy-changes/3-2-1-d-enthalpy-change-definitions
- ↑ по ГОСТ 12.1.005
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ http://openmopac.net/pKa_table.html
- ↑ Chastain G. Alcohol, neurotransmitter systems, and behavior (неопр.) // The Journal of general psychology. — 2006. — Т. 133, № 4. — С. 329. — ISSN 0022-1309. — doi:10.3200/GENP.133.4.329-335. — PMID 17128954.
- ↑ Ernest W. Flick Industrial Solvents Handbook, Fifth Edition, Noyes Data Corporation (ndc), Westwood, NJ/USA, 1998, S. 252
- ↑ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 3.246. ISBN 1-4398-5511-0.
- ↑ Eintrag zu Ethanol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. März 2015.
- ↑ Flick E. W.: Industrial Solvents Handbook. Fifth Edition, Noyes Data Corporation (ndc), Westwood, NJ/USA 1998, ISBN 0-8155-1413-1, S. 252.
- ↑ Давление насыщенного пара в мм рт.ст. над органической жидкостью при температуре (°С) Анилин, Ацетон, Бензол, Бромбензол, Бутанол, Гексан, Гептан, Дихлорэтан, Изопропанол... 10-140°С - Инженерный справочник DPVA.ru / Технический справочник ДПВА / Таблицы для инженеров (ex DPVA-info). dpva.ru. Дата обращения: 19 мая 2022. Архивировано 25 января 2021 года.
- ↑ Статья «Абсолютный спирт» в БСЭ.
- ↑ Получение абсолютного спирта. Дата обращения: 18 июля 2012. Архивировано 8 апреля 2019 года.
- ↑ Козин В. Г., Солодова Н. Л., Башкирцева Н. Ю., Абдуллин А. И. Современные технологии производства компонентов моторных топлив. Учебное пособие.. — Казань: КГТУ, 2009. — 327 с.
- ↑ Средства, влияющие на ЦНС. Дата обращения: 27 мая 2007. Архивировано из оригинала 3 июля 2007 года.
- ↑ Flomenbaum, Goldfrank et al. Goldfrank's Toxicologic Emergencies. 8th Edition. — McGraw Hill, 2006. — С. 1465. — 2170 с. — ISBN 0071437630.
- ↑ [1] Архивная копия от 20 июля 2017 на Wayback Machine Федеральное агентство по техническому регулированию и метрологии. ГОСТ Р 52409-2005 (полный текст)
- ↑ Russell, Nicholas J. Food preservatives (неопр.). — New York: Kluwer Academic/Plenum Publishers, 2003. — С. 198. — ISBN 0-306-47736-X.
- ↑ E1510 — спирт этиловый. Дата обращения: 3 мая 2011. Архивировано 11 января 2011 года.
- ↑ Национальная Биотопливная Ассоциация. Дата обращения: 20 декабря 2012. Архивировано из оригинала 18 июня 2009 года.
- ↑ Национальная Программа.рф — Альтернативные виды топлива. Дата обращения: 4 января 2020. Архивировано 15 августа 2014 года.
- ↑ 1 2 Биоэтанол: обзор мирового и российского рынков. Cleandex. Дата обращения: 19 декабря 2012. Архивировано 23 сентября 2012 года.
- ↑ Информационно аналитическое агентство «ИНФОБИО». Дата обращения: 19 декабря 2012. Архивировано 24 сентября 2012 года.
- ↑ ЭКОТОК. Дата обращения: 19 декабря 2012. Архивировано 21 октября 2012 года.
- ↑ 1 2 Россия и Америка в XXI веке. Дата обращения: 19 декабря 2012. Архивировано 13 мая 2013 года.
- ↑ Евросоюз с 1 января отказывается от традиционного бензина /16.12.2010 (недоступная ссылка)
- ↑ биоэтанол, биобензин, альтернативное топливо INNOVATIVE Е 95 проблема использования применения. Дата обращения: 19 декабря 2012. Архивировано 15 мая 2013 года.
- ↑ Ottawa to push ethanol, despite concerns (недоступная ссылка с 23-05-2013 [4186 дней] — история, копия)
- ↑ Интерфакс Запад. Дата обращения: 19 декабря 2012. Архивировано из оригинала 14 мая 2013 года.
- ↑ [India Sets Target of 20 % Biofuels by 2017. Дата обращения: 23 декабря 2008. Архивировано 23 декабря 2008 года. India Sets Target of 20 % Biofuels by 2017]
- ↑ Ivan Castano Mexican Biofuels Seen Meeting 3 % Blending Target In 2012 2 Май 2011. Дата обращения: 20 мая 2011. Архивировано 15 мая 2013 года.
- ↑ Комментарий. Стратегия противостояния — мифы и реалии. / Продукты питания / RosInvest.Com /. Дата обращения: 19 декабря 2012. Архивировано 4 марта 2016 года.
- ↑ Национальная Биотопливная Ассоциация. Дата обращения: 19 декабря 2012. Архивировано 14 июля 2014 года.
- ↑ Ethanol Industry Outlook 2005. Renewable Fuels Association (2/2005). Дата обращения: 26 февраля 2017. Архивировано 26 февраля 2017 года.
- ↑ Ethanol Industry Outlook 2010. Renewable Fuels Association (2/2010). Дата обращения: 3 января 2021. Архивировано 10 мая 2021 года.
- ↑ Ethanol Industry Outlook 2015. Renewable Fuels Association (2/2015). Дата обращения: 3 января 2021. Архивировано 10 мая 2021 года.
- ↑ Ethanol Industry Outlook 2020. Renewable Fuels Association (2/2020). Дата обращения: 3 января 2021. Архивировано 10 мая 2021 года.
- ↑ Alcohol use and burden for 195 countries and territories, 1990–2016 : a systematic analysis for the Global Burden of Disease Study 2016 : [англ.] / GBD 2016 Alcohol Collaborators // The Lancet : журн. — 2018. — Vol. 392, no. 10152. — P. 1015–1035. — doi:10.1016/S0140-6736(18)31310-2. — PMID 30146330. — PMC 6148333.
- ↑ 1 2 По данным нового исследования, нет безопасного уровня потребления алкоголя : [арх. 20 сентября 2018]. — ЕРБ ВОЗ. — 2018. — 13 сентября.
- ↑ Постановление Правительства Российской Федерации от 29 декабря 2007 г. N 964 г. Москва «Об утверждении списков сильнодействующих и ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации, а также крупного размера сильнодействующих веществ для целей статьи 234 Уголовного кодекса Российской Федерации». Дата обращения: 4 мая 2010. Архивировано 18 мая 2010 года.
- ↑ Статья 26 Федерального закона от 22.11.1995 N 171-ФЗ (ред. от 05.04.2010) (Консультант+ Архивная копия от 20 сентября 2011 на Wayback Machine)
- ↑ "О промышленной безопасности опасных производственных объектов". Федеральный закон от 21.07.1997 N 116-ФЗ // Принят Государственной Думой РФ 20 июня 1997 года. Архивировано 30 июня 2020 года.
- ↑ 1 2 Дубынин, В. Мозг и алкоголь : [арх. 22 мая 2018] // Постнаука. — 2016. — 8 декабря.
- ↑ Федеральное государственное учреждение Национальный Научный Центр Наркологии Росздрава. Механизмы токсического действия этанола Архивная копия от 6 февраля 2007 на Wayback Machine (недоступная ссылка с 23-05-2013 [4186 дней] — история, копия)
- ↑ Bienhoff, K. New scientific study: no safe level of alcohol : [англ.] : [арх. 24 августа 2018] / K. Bienhoff, D. Owen // IHME. — 2018. — 23 August.
- ↑ Lexicon of alcohol and drug terms published by the World Health Organization. Дата обращения: 21 августа 2011. Архивировано из оригинала 5 февраля 2013 года.
- ↑ Этиловый спирт // Экслибрис — Яя. — М. : Советская энциклопедия, 1978. — С. 295—296. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 30).
- ↑ Под ред. Морозова Г. В., Рожнова В. Е., Бабаяна Э.А. Алкоголизм. — Москва: Медицина, 1983. — С. 161—162. — 432 с. — 80 000 экз.
- ↑ Гаевый М. Д., Петров В. И., Гаевая Л. М. Фармакология. Учебник для студентов вузов. — 2008. — С. 21—30.
- ↑ Alcohol Consumption Induces Endogenous Opioid Release in the Human Orbitofrontal Cortex and Nucleus Accumbens — Mitchell et all. DOI: 10.1126/scitranslmed.3002902 Архивная копия от 15 января 2012 на Wayback Machine, Sci Transl Med, 11 января 2012
- ↑ Список прекурсоров и химических веществ, часто используемых при незаконном изготовлении наркотических средств и психотропных веществ, находящихся под международным контролем. Дата обращения: 21 августа 2011. Архивировано из оригинала 19 сентября 2011 года.
- ↑ 1 2 Lambert B., He S. M. DNA and chromosome damage induced by acetaldehyde in human lymphocytes in vitro (англ.) // Ann N Y Acad Sci[англ.] : journal. — 1988. — Vol. 534. — P. 369—376. — PMID 3389666.
- ↑ Chemical Summary For Acetaldehyde, US Environmental Protection Agency
- ↑ Садовникова И. И. Циррозы печени. Вопросы этиологии, патогенеза, клиники, диагностики, лечения Архивная копия от 13 ноября 2018 на Wayback Machine // «Русский медицинский журнал». — 2003. — Т. 5. — № 2.
- ↑ Park CW, Kim A, Cha SW, Jung SH, Yang HW, Lee YJ, Lee HIe, Kim SH, Kim YH. A case of phlegmonous gastritis associated with marked gastric distension (англ.) // PMID 20981225. — Division of Gastroenterology, Department of Internal Medicine, Eulji University Hospital, Eulji University College of Medicine, Daejeon, Korea., 2010. — ISSN 18385738. Архивировано 25 июля 2018 года.
- ↑ Ramstedt M. Alcohol and pancreatitis mortality in the population level: experiences from 14 western countries. Addiction 2004; 99: 1255—1261.[2] Архивная копия от 12 ноября 2018 на Wayback Machine
- ↑ Murakami K, Okimoto T, Kodama M, Tanahashi J, Mizukami K, Shuto M, Abe H, Arita T, Fujioka T. Comparison of the efficacy of irsogladine maleate and famotidine for the healing of gastric ulcers after Helicobacter pylori eradication therapy: a randomized, controlled, prospective study (англ.) // PMID 21073372. — Department of Gastroenterology, Faculty of Medicine, Oita University, Oita, Japan., 2010. — ISSN 18385738. Архивировано 25 июля 2018 года.
- ↑ Singletary K. W., Gapstur S. M. Alcohol and breast cancer: review of epidemiologic and experimental evidence and potential mechanisms (англ.) // J. Amed. Med. Assoc. — 2001. — Vol. 286, no. 17. — P. 2143—2151.
- ↑ Allen N. E., Beral V., Casabonne D., Kan S. W., Reeves G. K., Brown A., Green J. Moderate alcohol intake and cancer incidence in women (англ.) // J. Natl. Cancer Inst. — 2009. — Vol. 101, no. 5. — P. 296—305.
- ↑ Ott JJ, Ullrich A, Mascarenhas M, Stevens GA. Global cancer incidence and mortality caused by behavior and infection (англ.) // PMID 20935133. — World Health Organization, 20 Avenue Appia, 1211 Geneva 27, Switzerland, 2010. — ISSN 20935133. Архивировано 15 мая 2013 года.
- ↑ Olokoba AB, Obateru OA. Oesophageal carcinoma--a report of two cases and review of literature (англ.) // PMID 20836328. — Gastroenterology Unit, Department of Medicine, University of Ilorin Teaching Hospital, Ilorin, Nigeria., 2009. — ISSN 20836328. Архивировано 15 мая 2013 года.
- ↑ Known and Probable Human Carcinogens. Дата обращения: 25 июня 2014. Архивировано 17 ноября 2014 года.
- ↑ Патологическая физиология [Учебник для студентов мед. вузов]. Н. Н. Зайко, Ю. В. Быць, А. В. Атаман и др. — К.: «Логос», 1996.
- ↑ Klatsky A. L., Friedman G. D., Siegelaub A. B., Gerard M. J. Alcohol consumption and blood pressure Kaiser–Permanente Multiphasic Health Examination data (англ.) // New Engl. J. Med. — 1977. — Vol. 296, no. 21. — P. 1194—1200.
- ↑ Reynolds K., Lewis B., Nolen J. D., Kinney G. L., Sathya B., He J. Alcohol consumption and risk of stroke: a meta-analysis (англ.) // J. Amer. Med. Assoc. — 2003. — Vol. 289, no. 5. — P. 579—588.
- ↑ 1 2 3 Взаимодействие лекарств и эффективность фармакотерапии / Л. В. Деримедведь, И. М. Перцев, Е. В. Шуванова, И. А. Зупанец, В. Н. Хоменко; под ред. проф. И. М. Перцева. — Харьков: Издательство «Мегаполис», 2001. — 784 с. — 5000 экз. — ISBN 996-96421-0-X.
- ↑ Sokol R. J., Clarren S. K. Guidelines for use of terminology describing the impact of prenatal alcohol on the offspring (англ.) // Alcohol Clin. Exp. Res. — 1989. — Vol. 13, no. 4. — P. 597—598.
- ↑ 1 2 Muneer PM, Alikunju S, Szlachetka AM, Haorah J. Inhibitory effects of alcohol on glucose transport across the blood-brain barrier leads to neurodegeneration: preventive role of acetyl-L: -carnitine (англ.) // Psychopharmacology[англ.]. — Springer, 2010. — ISSN 18385738. Архивировано 12 ноября 2018 года.
«Evidence shows that alcohol intake causes oxidative neuronal injury and neurocognitive deficits that are distinct from the classical Wernicke-Korsakoff neuropathy. Our previous findings indicated that alcohol-elicited blood-brain barrier (BBB) damage leads to neuroinflammation and neuronal loss». - ↑ Fergusson D. M., Boden J. M., Horwood L. J. Tests of causal links between alcohol abuse or dependence and major depression (англ.) // JAMA : journal. — 2009. — Vol. 66, no. 3. — P. 260—266. — doi:10.1001/archgenpsychiatry.2008.543. — PMID 19255375.
- ↑ Falk D. E., Yi H. Y., Hilton M. E. Age of onset and temporal sequencing of lifetime DSM-IV alcohol use disorders relative to comorbid mood and anxiety disorders (англ.) // Drug Alcohol Depend : journal. — 2008. — Vol. 94, no. 1—3. — P. 234—245. — doi:10.1016/j.drugalcdep.2007.11.022. — PMID 18215474. — PMC 2386955.
- ↑ Schuckit M. A., Smith T. L., Danko G. P. A comparison of factors associated with substance-induced versus independent depressions (англ.) // J Stud Alcohol Drugs[англ.] : journal. — 2007. — Vol. 68, no. 6. — P. 805—812. — PMID 17960298.
- ↑ Vaillant George E. The Natural History of Alcoholism Revisited. — Cambridge, Massachusetts; London, England: Harvard University Press, 1995. — ISBN 978-0-674-04456-2. — ISBN 0-674-04456-8.
- ↑ Экспертиза опьянения (недоступная ссылка)
- ↑ Алексей Водовозов. Средство от похмелья: научный взгляд на народную проблему (25 апреля 2016). Дата обращения: 26 ноября 2016. Архивировано 27 ноября 2016 года.
- ↑ Anatoly G. Antoshechkin. On Intracellular Formation of Ethanol And Its Possible Role In Energy Metabolism. Oxford University Press (1 ноября 2001). doi:https://dx.doi.org/10.1093/alcalc/36.6.608. Дата обращения: 27 ноября 2016. Архивировано 18 сентября 2016 года.
- ↑ Эндогенный алкоголь в крови, уровень, способы определения этанола. Дата обращения: 15 апреля 2013. Архивировано из оригинала 25 мая 2013 года.
- ↑ (Роспотребнадзор). № 2401. Этанол (этиловый спирт) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 162. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года.
- ↑ Online Etymology Dictionary. Дата обращения: 4 июля 2011. Архивировано 7 июня 2011 года.
- ↑ Алкоголь // Этимологический словарь русского языка = Russisches etymologisches Wörterbuch : в 4 т. / авт.-сост. М. Фасмер ; пер. с нем. и доп. чл.‑кор. АН СССР О. Н. Трубачёва, под ред. и с предисл. проф. Б. А. Ларина [т. I]. — Изд. 2-е, стер. — М. : Прогресс, 1986—1987.
- ↑ The Oxford Dictionary of Word Origins. Alcohol
- ↑ А.К.Шапошников. Алкоголь // Этимологический словарь современного русского языка. — Наука, 2010. — Т. 1. — С. 24.
- ↑ Черных П. Я. Алкоголь // Историко-этимологический словарь современного русского языка. — Русский язык, 1999. — Т. 1. — С. 37.
- ↑ Алкоголь // Толковый словарь живого великорусского языка : в 4 т. / авт.-сост. В. И. Даль. — 2-е изд. — СПб. : Типография М. О. Вольфа, 1880—1882.
- ↑ Спирт // Этимологический словарь русского языка = Russisches etymologisches Wörterbuch : в 4 т. / авт.-сост. М. Фасмер ; пер. с нем. и доп. чл.‑кор. АН СССР О. Н. Трубачёва, под ред. и с предисл. проф. Б. А. Ларина [т. I]. — Изд. 2-е, стер. — М. : Прогресс, 1986—1987.
- ↑ БОЛЬШОЙ ЛАТИНСКО-РУССКИЙ СЛОВАРЬ Архивная копия от 27 декабря 2011 на Wayback Machine.
- ↑ Online Etymology Dictionary. Дата обращения: 5 июля 2011. Архивировано 15 июня 2012 года.
- ↑ Online Etymology Dictionary. Дата обращения: 5 июля 2011. Архивировано 20 октября 2012 года.
Литература
[править | править код]- Боуден Б. С. Этиловый спирт // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 501—503. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
Ссылки
[править | править код]- ГОСТ 31763-2012 Архивная копия от 20 июля 2017 на Wayback Machine. Спирт винный. Технические условия.
- ГОСТ 3639-79 Архивная копия от 14 июня 2018 на Wayback Machine. Растворы водно-спиртовые. Методы определения концентрации этилового спирта.