ПЭТаза

| ПЭТаза | |
|---|---|
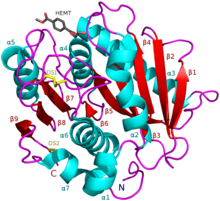 ПЭТаза I. sakaiensis в комплексе с HEMT, аналогом ПЭТ (PDB 5XH3). | |
| Идентификаторы | |
| Шифр КФ | 3.1.1.101 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
ПЭТазы представляют собой класс ферментов эстераз, которые катализируют гидролиз полиэтилентерефталатного (ПЭТ) пластика до мономерного моно-2-гидроксиэтилтерефталата (MHET).
Идеализированная химическая реакция (где n — количество мономеров в полимерной цепи):[1]
- (этилентерефталат)n + H2O → (этилентерефталат)n-1 + MHET
Остаточный ПЭТ распадается на бис (2-гидроксиэтил) терефталат (BHET). ПЭТазы также могут разрушать ПЭФ-пластик (полиэтилен-2,5-фурандикарбоксилат), который является биоразлагаемой заменой ПЭТ. ПЭТазы не могут катализировать гидролиз алифатических полиэфиров, таких как полибутиленсукцинат или полимолочная кислота[2].
Неферментативное естественное разложение ПЭТ займёт сотни лет, но ПЭТазы могут разложить мелкодисперсный ПЭТ-пластик за считанные дни[3].
История
[править | править код]Первая ПЭТаза была обнаружена в 2016 году в бактериях штамма 201-F6 Ideonella sakaiensis, обнаруженных в образцах осадка, собранных недалеко от японского предприятия по переработке ПЭТ-бутылок[1][4]. До этого открытия были известны другие типы гидролаз, разлагающих ПЭТ[2]. К ним относятся такие гидролазы, как липазы, эстеразы и кутиназы[5]. Открытия ферментов, разлагающих полиэфир, датируются, по крайней мере, 1975 г. (α-химотрипсин)[6] и 1977 г. (липаза), например[7].
ПЭТ-пластик получил широкое распространение в 1970-х годах, и было высказано предположение, что ПЭТазы в бактериях появились только недавно[2]. В прошлом у ПЭТазы могла быть ферментативная активность, связанная с разрушением воскового покрытия растений[8].
Структура
[править | править код]По состоянию на апрель 2019 года было известно 17 трёхмерных кристаллических структур ПЭТаз: 6QGC Архивная копия от 23 августа 2021 на Wayback Machine, 6ILX Архивная копия от 23 августа 2021 на Wayback Machine, 6ILW Архивная копия от 23 августа 2021 на Wayback Machine, 5YFE Архивная копия от 23 августа 2021 на Wayback Machine, 6EQD Архивная копия от 23 августа 2021 на Wayback Machine, 6EQE Архивная копия от 23 августа 2021 на Wayback Machine, 6EQF Архивная копия от 23 августа 2021 на Wayback Machine, 6EQG Архивная копия от 23 августа 2021 на Wayback Machine, 6EQH Архивная копия от 23 августа 2021 на Wayback Machine, 6ANE Архивная копия от 23 августа 2021 на Wayback Machine, 5XJH Архивная копия от 23 августа 2021 на Wayback Machine, 5YNS Архивная копия от 23 августа 2021 на Wayback Machine, 5XFY Архивная копия от 23 августа 2021 на Wayback Machine, 5XFZ Архивная копия от 23 августа 2021 на Wayback Machine, 5XG0 Архивная копия от 23 августа 2021 на Wayback Machine, 5XH2 Архивная копия от 23 августа 2021 на Wayback Machine и 5XH2. Архивная копия от 23 августа 2021 на Wayback Machine .
ПЭТаза обладает общими качествами, как с липазами, так и с кутиназами в том, что она обладает α/β-гидролазной складкой; тем не менее, расщелина активного центра, наблюдаемая в ПЭТазе, более открыта, чем в кутиназах[2]. Согласно Pfam, ПЭТаза Ideonella sakaiensis похожа на диенелактонгидролазу. Согласно ESTHER, он относится к семейству полиэстераза-липаза-кутиназа.
Существует приблизительно 69 ферментов, подобных ПЭТазе, найденных у множества различных организмов, и существует две классификации этих ферментов, включая тип I и тип II. Предполагается, что 57 ферментов относятся к категории I типа, тогда как остальные относятся к группе II типа, включая фермент ПЭТазы, обнаруженного у Ideonella sakaiensis. Во всех 69 ферментах, подобных ПЭТазе, существуют одни и те же три остатка в активном центре, что позволяет предположить, что каталитический механизм одинаков для всех форм ферментов, подобных ПЭТазе[9].
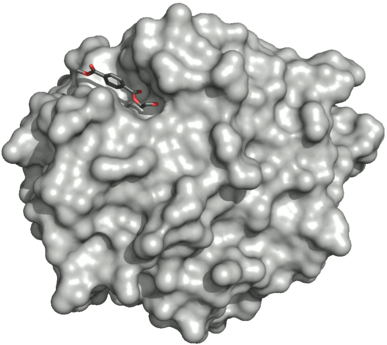
- Поверхность двойного мутанта петазы (R103G и S131A) с HEMT (1-(2-гидроксиэтил) 4-метилтерефталатом), связанного с его активным сайтом. HEMT является аналогом MHET и содержит дополнительный этерифицированный метанол. PDBID: 5XH3.
- Ленточная диаграмма ПЭТазы с тремя остатками Ser160, Asp206 и His237. Каталитическая триада представлена палочками голубого цвета. Активный сайт показан оранжевым цветом, для представления стимуляции молекулой 2-HE(MHET)4[9].
Мутации
[править | править код]В 2018 году учёные из Портсмутского университета в сотрудничестве с Национальной лабораторией возобновляемых источников энергии Министерства энергетики США разработали мутант ПЭТазы, который разлагает ПЭТ быстрее, чем тот, который находится в естественном состоянии. В этом исследовании также было показано, что ПЭТазы могут разрушать полиэтилен-2,5-фурандикарбоксилат (ПЭФ)[2][10].
Биологический путь
[править | править код]
У I. sakaiensis образующийся MHET дополнительно расщепляется под действием фермента MHETаза на терефталевую кислоту и этиленгликоль[1]. Лабораторные эксперименты показали, что химерные белки, которые искусственно связывают MHETазу и ПЭТазу, превосходят аналогичные смеси свободных ферментов[12].
См. также
[править | править код]- Galleria mellonella , гусеница, способная переваривать полиэтилен .
- Aspergillus tubingensis — гриб, способный переваривать полиуретан .
- Pestalotiopsis microspora, вид эндофитного гриба, способный расщеплять полиуретан.
- Кутиназа, фермент эстераза аналогичной геометрической формы
Примечания
[править | править код]
- ↑ 1 2 3 "A bacterium that degrades and assimilates poly(ethylene terephthalate)". Science. 351 (6278): 1196—9. March 2016. doi:10.1126/science.aad6359. PMID 26965627.
{{cite journal}}: Неизвестный параметр|laydate=игнорируется (справка) - ↑ 1 2 3 4 5 "Characterization and engineering of a plastic-degrading aromatic polyesterase". Proceedings of the National Academy of Sciences of the United States of America. 115 (19): E4350–E4357. May 2018. doi:10.1073/pnas.1718804115. PMID 29666242.
- ↑ Dockrill, Peter. "Scientists Have Accidentally Created a Mutant Enzyme That Eats Plastic Waste". ScienceAlert (англ.). Архивировано 17 апреля 2018. Дата обращения: 27 ноября 2018.
- ↑ "Ideonella sakaiensis sp. nov., isolated from a microbial consortium that degrades poly(ethylene terephthalate)". International Journal of Systematic and Evolutionary Microbiology. 66 (8): 2813—8. August 2016. doi:10.1099/ijsem.0.001058. PMID 27045688.
- ↑ "Structural insight into catalytic mechanism of PET hydrolase". Nature Communications (англ.). 8 (1): 2106. December 2017. doi:10.1038/s41467-017-02255-z. PMID 29235460.
- ↑ Tabushi, Iwao (August 1975). "Polyester readily hydrolyzable by chymotrypsin". Journal of Polymer Science: Polymer Letters Edition. 13 (8): 447—450. doi:10.1002/pol.1975.130130801.
- ↑ "Hydrolysis of polyesters by lipases". Nature. 270 (5632): 76—8. November 1977. doi:10.1038/270076a0. PMID 927523.
- ↑ "Lab 'Accident' Becomes Mutant Enzyme That Devours Plastic". Live Science. Архивировано 27 ноября 2018. Дата обращения: 27 ноября 2018.
- ↑ 1 2 "Structural insight into molecular mechanism of poly(ethylene terephthalate) degradation". Nature Communications (англ.). 9 (1): 382. January 2018. doi:10.1038/s41467-018-02881-1. PMID 29374183.
- ↑ Carrington, Damian. "New super-enzyme eats plastic bottles six times faster". The Guardian (англ.). Архивировано 12 октября 2020. Дата обращения: 23 августа 2021.
- ↑ Allison Chan. The Future of Bacteria Cleaning Our Plastic Waste (2016). Дата обращения: 23 августа 2021. Архивировано 27 ноября 2018 года.
- ↑ "Characterization and engineering of a two-enzyme system for plastics depolymerization". Proc Natl Acad Sci U S A. 117 (41): 25476—25485. Oct 2020. doi:10.1073/pnas.2006753117. PMID 32989159.
![Ленточная диаграмма ПЭТазы с тремя остатками Ser160, Asp206 и His237. Каталитическая триада представлена палочками голубого цвета. Активный сайт показан оранжевым цветом, для представления стимуляции молекулой 2-HE(MHET)4[9].](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/PETase_active_site.png/739px-PETase_active_site.png)