Точечная мутация

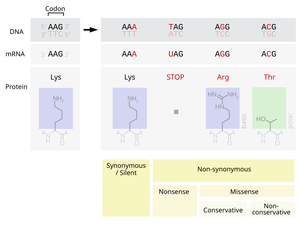
Точечная мутация — тип мутации в ДНК или РНК, при котором одно азотистое основание заменяется другим. Термин также применяется и в отношении парных замен, инсерции или делеции одного или нескольких нуклеотидов. Точечные мутации, возникающие в некодирующей ДНК, обычно никак себя не проявляют. Точечный мутант — организм, в генотипе которого произошла точечная мутация.
Точечные мутации классифицируют по эффекту, который изменённый нуклеотид оказывает на триплет:
- Синонимичная мутация (сайленс- или сеймсенс-мутация) — кодон продолжает кодировать ту же аминокислоту.
- Нонсенс-мутация — мутация, в результате которой кодон теряет способность кодировать какую-либо аминокислоту и становится стоп-кодоном, что приводит к преждевременной терминации синтеза белка.
- Миссенс-мутация — переключает кодон на кодирование другой аминокислоты.
Мутации замены оснований
[править | править код]- Точечные мутации замены оснований делят на транзиции и трансверсии[1][2].
- Транзиция — одно пуриновое основание замещается на другое (аденин на гуанин или наоборот), либо происходит аналогичная замена пиримидиновых оснований (тимин с цитозином).
- Трансверсия — пуриновое основание замещается на пиримидиновое основание или наоборот.
Транзиции происходят чаще, чем трансверсии[3][4].
Мутации замены оснований делятся на мишенные мутации замены оснований, немишенные и задерживающиеся мутации.
Мишенные мутации замены оснований
[править | править код]Мутации замены оснований, которые появляются напротив повреждений молекулы ДНК и способны останавливать синтез ДНК, называются мишенными мутациями замены оснований (от слова «мишень») [5][6][7]. К мишенным мутациям замены оснований приводят, например, циклобутановые пиримидиновые димеры[5][6][7].
Немишенные мутации замены оснований
[править | править код]Иногда мутации замены оснований образуются на неповрежденных участках ДНК. Такие мутации называются немишенными мутациями замены оснований[8]. Механизмы образования немишенных мутаций замены оснований были разработаны в рамках полимеразной и полимеразно-таутомерной моделей мутагенеза.
Задерживающиеся мутации замены оснований
[править | править код]Мутации замены оснований не всегда образуются сразу же после воздействия мутагена. Иногда они появляются после десятков циклов репликации. Это явление носит название задерживающихся мутаций[9]. Нестабильность генома — главная причина образования злокачественных опухолей[10] — характеризуется резким возрастанием количества немишенных и задерживающихся мутаций[11]. Механизмы образования задерживающихся мутаций в настоящее время не известны.
Точечные мутации сдвига рамки чтения
[править | править код]Точечные мутации сдвига рамки чтения гена делят на делеции и инсерции[12][13].
- Делеция — в молекуле ДНК выпадает один или несколько нуклеотидов.
- Инсерция — в молекулу ДНК встраивается один или несколько нуклеотидов.
Точечные мутации противопоставляются сложным мутациям, при которых один участок ДНК заменяется участком другой длины и иного нуклеотидного состава[14].
Точечные мутации могут появляться напротив таких повреждений молекулы ДНК, которые способны останавливать синтез ДНК. Например, напротив циклобутановых пиримидиновых димеров. Такие мутации называются мишенными мутациями (от слова «мишень»)[15]. Циклобутановые пиримидиновые димеры вызывают как мишенные мутации замены оснований, так и мишенные мутации сдвига рамки[16].
Иногда точечные мутации образуются на так называемых неповреждённых участках ДНК, часто в небольшой окрестности от фотодимеров. Такие мутации называются немишенными мутациями замены оснований или немишенными мутациями сдвига рамки[17].
Точечные мутации образуются не всегда сразу же после воздействия мутагена. Иногда они появляются после десятков циклов репликации. Это явление носит название задерживающихся мутаций[9]. При нестабильности генома, главной причине образования злокачественных опухолей, резко возрастает количество немишенных и задерживающихся мутаций[11].
Причины возникновения
[править | править код]Точечные мутации могут возникать в результате спонтанных мутаций, происходящих во время репликации ДНК. Они также могут возникать в результате действия мутагенов — к примеру, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры или химических веществ. Мутации появляются при синтезе молекулы ДНК, содержащей повреждения, в процессах репликации ДНК, репарации ДНК или транскрипции[18][19].
В настоящее время существует несколько подходов, используемых для объяснения природы и механизмов образования точечных мутаций. В рамках общепринятой, полимеразной модели считается, что единственная причина образования мутаций замены оснований — спорадические ошибки ДНК-полимераз[20]. Уотсон и Крик[21] предложили таутомерную модель спонтанного мутагенеза. Они объяснили появление спонтанных мутаций замены оснований тем, что при соприкосновении молекулы ДНК с молекулами воды могут изменяться таутомерные состояния оснований ДНК. Образование мутаций замены оснований объяснялось образованием Хугстиновских пар[22]. Одной из причин образования мутаций замены основания считается дезаминирование 5-метилцитозина[23].
Активные формы кислорода (АФК), которые являются побочными продуктами клеточного метаболизма, могут дополнительно способствовать точечным мутациям, вызывая окислительный стресс. АФК могут привести к модификациям оснований или разрывам цепи ДНК, что приводит к мутациям, если их не исправить должным образом. [24]Со временем связи ДНК могут деградировать из-за факторов окружающей среды или естественного процесса старения, что увеличивает вероятность мутаций. Старение также может влиять на эффективность механизмов репликации и восстановления ДНК, что приводит к более высокой частоте точковых мутаций, поскольку клетки со временем накапливают повреждения[25][26][27].
Примечания
[править | править код]- ↑ Тарасов В. А. Молекулярные механизмы репарации и мутагенеза. — М.: Наука, 1982. — 226 с.
- ↑ Friedberg E. C., Walker G. C., Siede W. DNA repair and mutagenesis. — Washington: ASM Press, DC, 1995.
- ↑ Fields Virology by David M Knipe and Peter M Howley | Publisher: Lippincott Williams & Wilkins, 2007 | ISBN 0-7817-1832-5 | стр. 394
- ↑ https://www.mun.ca/biology/scarr/Transitions_vs_Transversions.html Архивная копия от 22 октября 2018 на Wayback Machine Transition versus Transversion mutations
- ↑ 1 2 Wang C.-I., Taylor J.-S. In vitro evidence that UV-induced frameshift and substitution mutations at T tracts are the result of misalignment-mediated replication past a specific thymine dimer // Biochemistry - 1992. – 31. – P. 3671–3681. doi:10.1021/bi00129a016
- ↑ 1 2 Lawrence C. W., Banerjee S. K., Borden A., LeClerc J. E. T-T cyclobutane dimers are misinstructive rather than non-instructive, mutagenic lesions // Mol. Gen. Genet. – 1990. – 222. – P. 166-169. doi:10.1007/BF00283040
- ↑ 1 2 LeClerc J. E., Borden A., Lawrence C. W. The thymine-thymine pyrimidine-pyrimidine (6-4) ultraviolet light photoproduct is highly mutagenic and specifically induces 3'-thymine-to-cytosine transitions in Escherichia coli // Proc. Nat. Acad. Sci. USA. – 1991. – 88. – P. 9685-9686.
- ↑ Maor-Shoshani A., Reuven N. B., Tomer G., Livneh Z. Highly mutagenic replication by DNA polymerase V (UmuC) provides a mechanistic basis for SOS untargeted mutagenesis // Proc. Natl. Acad. Sci. USA - 2000. - 97. – P. 565–570.
- ↑ 1 2 Little J. B., Gorgojo L., Vetrovs H. Delayed appearance of lethal and specific gene mutations in irradiated mammalian cells // Int. J. Radiat. Oncol. Biol. Phys. — 1990. — 19. — P. 1425—1429.
- ↑ Кордюм В. И. Опухоль — как она видится сегодня с позиций молекулярной генетики // Биополимеры и клетка. — 2001. — Т. 17. — С. 109—139.
- ↑ 1 2 Niwa O. Radiation induced dynamic mutations and transgenerational effects // J. Radiation Research. — 2006. — 47. — P. B25-B30.
- ↑ Ауэрбах Ш. Проблемы мутагенеза. — М.: Мир, 1978. — 463 с.
- ↑ Friedberg E. C., Walker G. C., Siede W., Wood R. D., Schultz R. A., Ellenberger T. DNA repair and mutagenesis. — part 3. Washington: ASM Press. — 2006. 2nd ed.
- ↑ Levine J. G., Schaaper R. M., De Marini D. M. Complex frameshift mutations mediated by plasmid pkm 101: Mutational mechanisms deduced mutation spectra in Salmonella // Genetics. — 1994. — 136. — P. 731—746.
- ↑ Pham P., Bertram J. G, O’Donnell M., Woodgate R., Goodman M. F. A model for SOS-lesion-targeted mutations in Escherichia coli // Nature. — 2001. — 408. — P. 366—370.
- ↑ Wang C.-I., Taylor J.-S. In vitro evidence that UV-induced frameshift and substitution mutations at T tracts are the result of misalignment-mediated replication past a specific thymine dimer // Biochemistry — 1992. — 31. — P. 3671-3681.
- ↑ Maor-Shoshani A., Reuven N. B., Tomer G., Livneh Z. Highly mutagenic replication by DNA polymerase V (UmuC) provides a mechanistic basis for SOS untargeted mutagenesis // Proc. Natl. Acad. Sci. USA — 2000. — 97. — P. 565—570.
- ↑ Banerjee S. K., Borden A., Christensen R. B., LeClerc J. E., Lawrence C. W. SOS-dependent replication past a single trans-syn T-T cyclobutane dimer gives a different mutation spectrum and increased error rate compared with replication past this lesion in uniduced cell // J. Bacteriol. — 1990. — 172. — P. 2105—2112.
- ↑ Jonczyk P., Fijalkowska I., Ciesla Z. Overproduction of the subunit of DNA polymerase III counteracts the SOS-mutagenic response of Esthetician coli // Proc. Nat. Acad. Sci. USA. — 1988. — 85. — Р. 2124—2127.
- ↑ Tang M., Shen X., Frank E. G., O’Donnell M., Woodgate R., Goodman M. F. UmuD’(2)C is an error-prone DNA polymerase. Escherichia coli pol V // Proc. Natl. Acad. Sci. USA — 1999. — Vol. 96. — P. 8919-8924.
- ↑ Watson J. D., Crick F. H. C. The structure of DNA // Cold Spring Harbor Symp. Quant. Biol. — 1953. — 18. — P. 123—131.
- ↑ Полтев В. И., Шулюпина Н. В., Брусков В. И. Молекулярные механизмы правильности биосинтеза нуклеиновых кислот. Компьютерное изучение роли полимераз в образовании неправильных пар модифицированными основаниями // Молек. биол. — 1996. — 30. — С. 1284—1298.
- ↑ Cannistraro V. J., Taylor J. S. Acceleration of 5-methylcytosine deamination in cyclobutane dimers by G and its implications for UV-induced C-to-T mutation hotspots // J. Mol. Biol. — 2009. — 392. — P. 1145—1157.
- ↑ T. Yasukawa. A pathogenic point mutation reduces stability of mitochondrial mutant tRNAIle // Nucleic Acids Research. — 2000-10-01. — Т. 28, вып. 19. — С. 3779–3784. — ISSN 1362-4962. — doi:10.1093/nar/28.19.3779. Архивировано 12 сентября 2024 года.
- ↑ Joep de Ligt, Joris A Veltman, Lisenka ELM Vissers. Point mutations as a source of de novo genetic disease (англ.) // Current Opinion in Genetics & Development. — 2013-06. — Vol. 23, iss. 3. — P. 257–263. — doi:10.1016/j.gde.2013.01.007. Архивировано 10 сентября 2024 года.
- ↑ Sourav Pan. Point mutation – Definition, Causes, Types, Examples ((англ. )) : website. — 2024. Архивировано 12 сентября 2024 года.
- ↑ David N. Cooper, Michael Krawczak. The mutational spectrum of single base-pair substitutions causing human genetic disease: patterns and predictions (англ.) // Human Genetics. — 1990-06-01. — Vol. 85, iss. 1. — P. 55–74. — ISSN 1432-1203. — doi:10.1007/BF00276326. Архивировано 12 сентября 2024 года.
Ссылки
[править | править код]- Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. — М.: «Мир», 1993. — Т. 2. — С. 98. — 415 с. — 12 000 экз. — ISBN 5-03-001775-5.
- MeSH Point+Mutation (англ.)