Rhenium(VII)-oxid
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
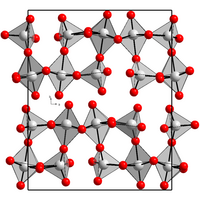 | ||||||||||||||||
| _ Re7+ _ O2− | ||||||||||||||||
| Kristallsystem | orthorhombisch | |||||||||||||||
| Raumgruppe | P212121 (Nr. 19) | |||||||||||||||
| Gitterparameter | a = 1250 pm, b = 1520 pm und c = 540 pm[1] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Rhenium(VII)-oxid | |||||||||||||||
| Andere Namen | Rheniumheptaoxid | |||||||||||||||
| Verhältnisformel | Re2O7 | |||||||||||||||
| Kurzbeschreibung | gelber, fast geruchloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 484,40 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 6 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | 363 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | −1128 kJ·mol−1 [4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Rhenium(VII)-oxid Re2O7 ist eine chemische Verbindung und zählt zu den Oxiden des Rheniums. Es ist ein gelber hygroskopischer Feststoff. Im Vergleich zum instabilen und explosiven Mangan(VII)-oxid ist Rhenium(VII)-oxid deutlich stabiler.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Rhenium(VII)-oxid entsteht beim Erhitzen von Rhenium oder Rheniumverbindungen an der Luft.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Rhenium(VII)-oxid kristallisiert in einer orthorhombischen Kristallstruktur mit der Raumgruppe P212121 (Raumgruppen-Nr. 19). Die Gitterkonstanten sind a = 1250 pm, b = 1520 pm und c = 540 pm. Im Kristall bildet Rhenium(VII)-oxid ReO4-Tetraeder und ReO6-Oktaeder, die sich einander abwechseln und über die Ecken verknüpft sind.[1]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Rhenium(VII)-oxid ist sehr hygroskopisch und löst sich gut in Wasser. Beim Lösen bildet sich die starke Säure Perrheniumsäure. Rhenium(VII)-oxid wird durch Wasserstoff bei 300 °C zu Rhenium(IV)-oxid reduziert.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Rhenium(VII)-oxid ist ein Zwischenprodukt bei der Gewinnung von elementarem Rhenium. Es entsteht beim Rösten von rheniumhaltigen Manganerzen. Das Rhenium(VII)-oxid wird nach der Abtrennung vom übrigen Flugstaub in Wasser gelöst. Aus der dabei entstandenen Perrheniumsäure wird das Rhenium als Ammoniumperrhenat ausgefällt und mit Wasserstoff zum Element reduziert.
Rhenium(VII)-oxid kann als Katalysator in verschiedenen Reaktionen der organischen Chemie verwendet werden. So können mit Hilfe von Rhenium(VII)-oxid Alkane in Carbonsäuren überführt werden.[5] Weitere durch Rhenium(VII)-oxid katalysierte Reaktionen sind Metathese-Reaktionen von Olefinen.[6] Aus Rhenium(VII)-oxid kann der Katalysator Methyltrioxorhenium (MTO) gewonnen werden.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b B. Krebs, A. Müller und H. Beyer: The Crystal Structure of Rhenium(VII) Oxide. In: Inorg. Chem., 1969, 8, 3, S. 436–443.
- ↑ a b c d e f g Datenblatt Rhenium(VII)-oxid bei Merck, abgerufen am 25. Dezember 2019.
- ↑ a b c Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1616.
- ↑ A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 2. Band: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049590-4, S. 1921 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ M. Kirillova et al.: Group 5–7 transition metal oxides as efficient catalysts for oxidative functionalization of alkanes under mild conditions. In: Journal of Catalysis, 2007, 248, S. 130–136.
- ↑ M. Onaka, T. Oikawa: Olefin Metathesis over Mesoporous Alumina-supported Rhenium Oxide Catalyst. In: Chemistry Letters 2002, 850-851.
- ↑ W. Herrmann et al.: Kostengünstige, effiziente und umweltfreundliche Synthese des vielseitigen Katalysators Methyltrioxorhenium (MTO). In: Angew. Chem., 2007, 119, S. 7440–7442.
Literatur
[Bearbeiten | Quelltext bearbeiten]- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1628–1629.


