Ester


En chimie, la fonction ester désigne un groupement caractéristique formé d'un atome lié simultanément à un atome d'oxygène par une double liaison et à un groupement alkoxyle. Lorsque l'atome lié est un atome de carbone, on parle d'ester carboxylique, dont la forme générale est R-COO-R'. Cependant, ce peut être aussi un atome de soufre (par exemple dans les esters sulfuriques, sulféniques, etc.), d'azote (esters nitriques, etc.), de phosphore (esters phosphoriques, phosphoniques, phosphéniques, etc.), etc. En fait, tout oxoacide organique, inorganique ou minéral a la capacité de former des esters.
Les esters carboxyliques sont des dérivés des acides carboxyliques, ils résultent très généralement de l'action d'un alcool sur ces acides avec élimination d'eau. Les fonctions esters se retrouvent dans de nombreuses molécules biologiques, notamment les triglycérides. Les esters carboxyliques ont souvent une odeur agréable et sont souvent à l'origine de l'arôme naturel des fruits. Ils sont aussi beaucoup utilisés pour les arômes synthétiques et dans la parfumerie.
Nomenclature
[modifier | modifier le code]En tant que groupe prioritaire
[modifier | modifier le code]Le nom d'un ester comporte deux termes :
- le premier désigne la chaîne principale qui provient de l'acide carboxylique dans laquelle on remplace la terminaison -oïque de l'acide par -oate. Elle est liée au carbone du groupe carboxyle et est numérotée quand c'est nécessaire à partir de celui-ci.
- le second, qui se termine en -yle, est le nom du groupe alkyle provenant de l'alcool. Cette chaîne est numérotée à partir de l'atome de carbone lié à l'atome d'oxygène de la fonction ester.

- à gauche, le groupement pentanoate (chaîne de 5 atomes de carbone, le premier au centre de la figure étant doublement lié à un atome d’oxygène en groupement oxyle) ; ce carboxyle provient de l’estérification de l’acide pentanoïque ;
- à droite, le groupement éthyle (chaîne de 2 atomes de carbone, le premier au centre de la figure étant simplement lié à un atome d’oxygène qui assure aussi la liaison faible entre les deux groupements) ; cet alkyle provient de l’estérification de l’éthanol.
Nomenclature systématique - Cas général Classe Formule*
du groupe caractéristiqueSuffixe Acides carboxyliques -(C)OOH
-COOHacide ...-oïque
acide ...-carboxyliqueEsters d'acides carboxyliques -(C)OOR**
-COOR**...-oate de R
...-carboxylate de R
- Exemples :
- Heptanoate d'éthyle : CH3(CH2)5-COO-C2H5 (ester de l'acide heptanoïque CH3(CH2)5-COOH ; R = groupe éthyle -C2H5)
- Cyclopentanecarboxylate d'éthyle :
 -COO-C2H5 (ester de l'acide cyclopentanecarboxylique)
-COO-C2H5 (ester de l'acide cyclopentanecarboxylique)
Pour les dérivés de l'acide formique, de l'acide acétique, les noms traditionnels sont utilisés alors que pour les autres acides, le nom systématique est recommandé, ce qui donne :
| Alcane | Acide carboxylique | Ester | Exemple |
|---|---|---|---|
| méthane | acide formique | formiate de R-yle | formiate de méthyle |
| acide méthanoïque | méthanoate de R-yle | méthanoate de méthyle | |
| éthane | acide acétique | acétate de R-yle | acétate de méthyle |
| acide éthanoïque | éthanoate de R-yle | éthanoate de méthyle | |
| propane | acide propionique | propionate de R-yle | propionate de méthyle |
| acide propanoïque | propanoate de R-yle | propanoate de méthyle | |
| butane | acide butyrique | butyrate de R-yle | butyrate de méthyle |
| acide butanoïque | butanoate de R-yle | butanoate de méthyle | |
| pentane | acide pentanoïque | pentanoate de R-yle | pentanoate de méthyle |
| acide 2-méthylbutanoïque | 2-méthylbutanoate de R-yle | 2-méthylbutanoate d'éthyle | |
| acide 3-méthylbutanoïque | 3-méthylbutanoate de R-yle | 3-méthylbutanoate d'éthyle | |
| hexane | acide hexanoïque | hexanoate de R-yle | hexanoate de méthyle |
Les noms en gras du tableau ci-dessus ceux de la nomenclature IUPAC.
Les noms de la nomenclature systématique sont donnés quand ils sont différents de ceux de l'IUPAC.
En italique : d'autres noms qui ne relèvent ni de la nomenclature systématique ni de l'IUPAC mais qui sont néanmoins, pour l'acide propionique et l'acide butyrique, acceptés par l'UICPA[3], leurs esters reprenant obligatoirement les noms systématiques.
En tant que groupe secondaire
[modifier | modifier le code]Si un autre groupe caractéristique a la priorité, il y a deux possibilités pour désigner un ester :
- groupe ester secondaire rattaché à la structure principale par le carbonyle (R-O-CO-) : par l'utilisation du préfixe R-oxycarbonyl-. Exemple : acide 3-propoxycarbonylpentanoïque.
- groupe ester secondaire rattaché à la structure principale par l'oxygène (R-CO-O-) : par l'utilisation du préfixe acyloxy-. Exemple : acide 3-propanoacyloxypentanoïque.
Synthèse
[modifier | modifier le code]La méthode de synthèse la plus simple et la plus courante est appelée estérification. Il s'agit de la condensation d'un acide carboxylique ou de l'un de ses dérivés (chlorure d'acyle, anhydride d'acide) avec un alcool, donnant l'ester et un autre composé (eau, acide chlorhydrique ou acide carboxylique).
Dans le cas de la réaction d'un acide carboxylique avec un alcool, on parle de réaction ou estérification de Fischer :
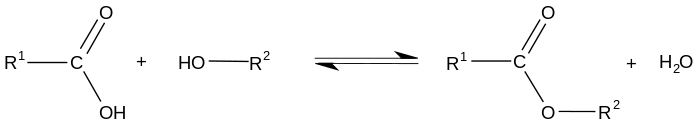
Cette réaction est lente, presque athermique (légèrement exothermique en fait) et réversible (la réaction inverse appelée rétro-estérification est une hydrolyse acide de l'ester), ce qui la rend limitée. Son rendement dépend particulièrement de la classe de l'alcool utilisé (rendement moyen à bon pour des alcools primaires et secondaires, mauvais rendement pour des alcools tertiaires). Il est possible d'améliorer la cinétique de cette réaction (qui sinon met plusieurs mois à atteindre son équilibre) en chauffant (ce qui n'a pas d'influence sur le rendement), ou en la catalysant par un acide. Le rendement quant à lui peut être amélioré par exemple en mettant un réactif en excès ou en enlevant l'eau produite lors de la réaction avec un appareil de Dean Stark.
Une autre possibilité est d'utiliser des dérivés d'acides pour synthétiser des esters :
- à partir des chlorures d'acyles :

- à partir des anhydrides d'acide :
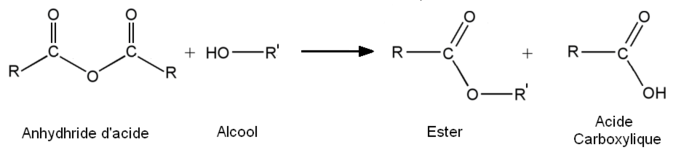
Ces réactions, contrairement à l'estérification de Fischer présentent l'avantage d'être rapides et totales.
Il est aussi possible de synthétiser un ester à partir d'un autre ester et d'un alcool. On parle alors de transestérification.

Cette réaction est utilisée dans l'industrie pour la fabrication du polyester et du biodiesel. Elle est aussi présente en biologie ; c'est entre autres le mécanisme qui permet l'épissage des introns lors de la maturation des ARNm.
Utilité
[modifier | modifier le code]Outre le fait d'obtenir un ester, utile dans l'industrie agroalimentaire, en parfumerie ou d'autres secteurs industriels, l'estérification est utile de par son caractère réversible (pour les acides carboxyliques et les alcools, tout du moins), dans le cadre de la protection de fonctions.
Puisque la transformation est réversible, elle permet de protéger soit la fonction alcool, soit la fonction acide carboxylique, soit les deux. En effet, si on veut protéger un alcool, on le fait réagir avec un acide carboxylique pour former un ester ; on fait la réaction que l'on voulait effectuer ; une fois celle-ci finie, on renverse la réaction d'estérification pour retrouver l'alcool.
Il existe deux méthodes pour renverser l'estérification :
- utiliser la même réaction (rétro-estérification) en jouant sur les quantités de matière pour que l'équilibre soit favorable à l'acide carboxylique + l'alcool.
- utiliser la réaction de saponification ou hydrolyse en milieu basique des esters.
Les esters sont aussi un constituant de base dans l'industrie des plastiques. Ils sont à la base d'un des plastiques les plus utilisés, le polyester.
Il s'agit d'un moyen de former les lactones : estérification intramoléculaire à partir d'un hydroxyacide carboxylique.
Les esters peuvent être réduits :
- en alcools primaires par l'action du tétrahydruroaluminate de lithium (LiAlH4), dans l'éther diéthylique (éther) ou le THF (tétrahydrofurane)
- en aldéhydes par l'action du DIBAL, dans un solvant non polaire (toluène par exemple), à basse température (−60 °C).
- Quelques esters
Quelques esters et leur odeur
[modifier | modifier le code]| Ester | Odeur | |
|---|---|---|
| Méthanoate ou Formiate | de méthyle | Éthérée |
| d'éthyle | Odeur de rhum, et partiellement des framboises | |
| de butyle | Fruitée | |
| Éthanoate ou Acétate | de méthyle | Fruitée |
| d'éthyle | Dissolvant ou fruitée | |
| de propyle | Poire | |
| de butyle | Banane ou pomme | |
| de pentyle | Poire | |
| d'hexyle | Poire | |
| d'heptyle | Florale | |
| d'octyle | Orange | |
| de linalyle | Lavande, bergamote ou banane | |
| de 2-phényléthyle | Rose | |
| de benzyle | Jasmin | |
| de vinyle | Fruitée, agréable à faible concentration devient vite âcre et irritante à plus forte concentration | |
| d'isoamyle ou de 3-méthylbutyle | Banane | |
| d'isobutyle ou β-méthylpropyle | Fruitée et florale | |
| Propanoate ou Propionate | d'éthyle | Fraise |
| de propyle | Fruitée | |
| de butyle | Pomme | |
| d'isoamyle | Abricot, ananas | |
| d'isobutyle | Éthérée | |
| d'isopropyle | Fruitée | |
| Butanoate ou Butyrate | de méthyle | Pomme |
| d'éthyle | Ananas | |
| d'isoamyle | Pomme | |
| Isopentanoate ou Isovalérate | de méthyle | Fruitée |
| Salicylate | de méthyle | Thé des bois, Winter-green |
| de phényle | Aromatique | |
| d'hexyle | Azalée | |
| Benzoate | de méthyle | Orientale (très raffinée : « essence de Niobé ») |
| d'éthyle | Cerise | |
| de benzyle | Aromatique | |
Voir aussi
[modifier | modifier le code]Notes et références
[modifier | modifier le code]- R. Panico, J.-C. Richer - Nomenclature UICPA des composés organiques - Masson 1994, pp. 70, 129 à 131 ( (ISBN 2-225-84479-8)). Un tableau des suffixes (et préfixes) utilisés pour désigner quelques groupes caractéristiques importants en nomenclature substitutive est consultable dans une référence IUPAC en ligne (en anglais) : Suffixes and prefixes for some important characteristic groups in substitutive nomenclature.
- Les hydrures fondamentaux incluent les hydrocarbures
- « Table 28(a) Carboxylic acids and related groups. Unsubstituted parent… », sur acdlabs.com (consulté le ).
