Procédé de polymérisation

La synthèse des polymères, ou polymérisation, peut mettre en jeu des réactions différentes : polymérisation en chaîne ou polymérisation par étapes et se faire dans des conditions différentes. Selon le milieu de réaction, on distingue la polymérisation en masse, en solution ou en milieu dispersé. Ces différents procédés, ou techniques de polymérisation, dépendent des caractéristiques du produit désiré, des applications envisagées, de considérations financière et écologiste.
Polymérisation en masse
[modifier | modifier le code]Principe
[modifier | modifier le code]Dans ce cas il n'y a ni solvant, ni diluant. Le monomère est directement polymérisé sous l'action de la chaleur, de radiations ou d'un amorceur. On a une augmentation de la viscosité (effet Trommsdorff), de la chaleur et consommation du monomère. Selon la solubilité du polymère à synthétiser, la polymérisation en masse peut être :
- homogène : le polymère est soluble dans son monomère, le milieu peut alors se solidifier. C'est le cas du polystyrène (PS) à partir du styrène ;
- hétérogène : le polymère n'est pas soluble dans son monomère, le polymère peut alors précipiter à partir d'un certain degré de polymérisation. C'est le cas du poly(chlorure de vinyle) (PVC) à partir du chlorure de vinyle (gazeux) sous pression.
Avantages et limites
[modifier | modifier le code]Les polymères obtenus sont relativement purs et peuvent avoir une masse molaire élevée. Il est possible de faire une polymérisation en masse directement dans un moule, avec le polyuréthane par exemple.
Par contre, un des problèmes est de mélanger et de chauffer de manière uniforme[1] (milieu visqueux). Ces réactions exothermiques présentent un risque d'emballement qui peut mener à l'explosion[2]. Pour éviter l'emballement, on peut commencer en masse et finir la polymérisation avec une autre méthode. Une autre limite est la relative polydispersité des chaînes obtenues. De plus, la proximité des chaînes peut favoriser les réactions de transfert interchaînes, donc des ramifications.
Utilisations
[modifier | modifier le code]Les polymérisations par étapes sont souvent réalisées en masse. Le monomère et le polymère sont fondus, la température pouvant être assez élevée. Il y a un risque de dégradation des réactifs et la dépense énergétique peut constituer un frein. C'est également utilisé (mais plus rarement) en polymérisation ionique. En polymérisation radicalaire, on synthétise par exemple le PVC. Le polymère obtenu est sous forme de poudre qui peut s'agglomérer à cause d'une mauvaise agitation[3].
Polymérisation en solution
[modifier | modifier le code]Description
[modifier | modifier le code]Dans ce cas, la polymérisation se fait en présence d'un solvant ou d'un diluant. Selon la solubilité du polymère à synthétiser, la polymérisation en solution peut être :
- homogène : le polymère est soluble dans le solvant, le milieu peut alors se solidifier. C'est le cas du polyisobutène dans le chlorure de méthyle.
- hétérogène : le polymère n'est pas soluble dans le solvant, le polymère peut alors précipiter à partir d'un certain degré de polymérisation. C'est le cas du PVC dans le benzène.
En phase homogène, la cinétique est la même que pour la polymérisation en masse, mais la vitesse de propagation est diminuée. En effet, en polymérisation en chaîne, elle est de la forme : vp = kp [monomère] [polymère en croissance]. Les concentrations sont diminuées par rapport à la polymérisation en masse à cause de la présence de solvant et la vitesse est donc inférieure[4].
Avantages et inconvénients
[modifier | modifier le code]Avec ce procédé, il est plus facile de contrôler le dégagement de chaleur (réactions exothermiques) que dans la polymérisation en masse, l'effet Trommsdorff ne pose plus problème, la viscosité non plus. On peut obtenir des polymères relativement purs et également de masse molaire élevée mais un peu moins qu'en masse[5]. Selon les applications, la solution obtenue peut être utilisée directement (colles, peintures, etc.).
Un problème est le solvant, souvent toxique et potentiellement complexe et coûteux à éliminer. Le solvant étant présent en grande quantité, le risque de transfert au solvant augmente d'autant[4]. Comme dit plus haut, la polymérisation est aussi plus lente.
Exemple
[modifier | modifier le code]L'éthylène (gazeux) est dissous dans du solvant en présence d'amorceur sous pression assez élevée pour qu'il reste dissous et à température suffisante pour dissoudre le polymère.
Polymérisation en milieu dispersé
[modifier | modifier le code]Cela regroupe plusieurs procédés dans lesquels le milieu de réaction est compartimenté. Les principales sont l'émulsion, la suspension et la dispersion, même si elles peuvent être directes ou inverses, macro ou micro. La technique de choix est la polymérisation radicalaire dans ce cas.
- Les avantages de la polymérisation en milieu dispersé sont[6] :
- le contrôle aisé de la température par échange de la chaleur de réaction avec la phase continue ;
- la faible viscosité du milieu réactionnel ;
- la conversion élevée ;
- la récupération en fin de réaction des polymères sous une forme « prête à l’emploi ».
- Les inconvénients de la polymérisation en milieu dispersé sont :
- la contamination du polymère par le tensioactif.
Polymérisation en suspension
[modifier | modifier le code]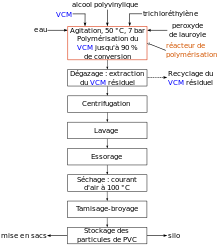
On a :
- une phase dispersée : monomère + amorceur ;
- une phase dispersante : eau + un stabilisant.
Le stabilisant est présent pour éviter la coalescence des gouttelettes. Le stabilisant est un polymère tensioactif préalablement dissous comme l'alcool polyvinylique. Chaque gouttelette est un microréacteur, avec la même cinétique qu'en polymérisation en masse, mais sans les inconvénients (pas d'échauffement). Les gouttes sont en général assez grosses (10 μm à 1 mm de diamètre) et sont filtrables à la fin de la réaction[5]. On peut obtenir de cette manière le PVC[4] ou le PEHD, par exemple.
Polymérisation en émulsion
[modifier | modifier le code]
Suivant les conditions expérimentales, plusieurs mécanismes peuvent avoir lieu simultanément et dans des proportions variables[7]. Dans tous les cas, le monomère doit être pratiquement insoluble dans le milieu de réaction : l'eau. Il est introduit sous vive agitation et forme des gouttes de taille relativement importante stabilisées par un tensioactif ajouté dans le milieu. L'amorceur est par ailleurs soluble en phase aqueuse. Lorsqu'on décompose l'amorceur, thermiquement par exemple, il forme des radicaux libres dans l'eau, où se trouve une faible fraction de monomère dissous. La rencontre des deux provoque l'amorçage et un début de polymérisation de quelques motifs. On obtient ainsi des oligoradicaux dans l'eau.
- Au-dessus de la concentration micellaire critique, un tensioactif forme des micelles dans l'eau. Ces dernières sont alors présentes en grand nombre. Elles sont de petite taille devant les gouttelettes de monomère mais leur surface spécifique est très supérieure. Dans ce cas les radicaux ou les oligoradicaux formés ont statistiquement plus de chance d'entrer dans les micelles que dans les gouttelettes de monomère et ne restent pas en solution. Leur affinité avec l'eau est en effet de moins en moins grande au fur et à mesure que leur taille augmente.
- Si le tensioactif est introduit à une concentration inférieure à la CMC, il n'y a pas de micelles et les oligoradicaux (enchaînement de quelques unités monomères dont le dernier maillon porte un radical) finissent par précipiter en solution.
Ces deux mécanismes de nucléation, appelés « micellaire » et « homogène » respectivement, sont prépondérant en polymérisation par émulsion classique. Il est possible de favoriser l'un ou l'autre de ces mécanismes en contrôlant les conditions opératoires[8].
- Un troisième mécanisme de nucléation est possible, mais il n'est prédominant qu'en polymérisation en miniémulsion ou microémulsion. Les oligoradicaux entrent alors directement dans les gouttes de monomère, plus petites et bien plus nombreuses, rendant plus probable cette entrée qu'en émulsion classique. C'est la nucléation en gouttes. En mini et micro émulsion, le latex obtenu est plus fin et nécessite d'utiliser plus de tensioactif.
On utilise parfois un latex préformé pour ensemencer, c'est-à-dire amorcer le processus.
La croissance des particules se fait ensuite par transfert de monomère à travers la phase aqueuse depuis les gouttes. Le monomère en phase aqueuse est consommé progressivement pour accroître la taille des oligoradicaux dans les micelles ou précipités en solution. Au fur et à mesure, cela entraine la dissolution des gouttelettes de monomère qui sont ainsi consommés progressivement par déplacement d'équilibre. La croissance des particules primaires peut également avoir lieu par coagulation de particules. On obtient à la fin de la réaction un latex de polymère, c'est-à-dire une émulsion stable de particules de polymère dont la taille peut varier de 0,05 à 5 μm typiquement. Ce latex peut être utilisé tel quel ou coagulé.
La polymérisation en émulsion est mise en œuvre industriellement de manière courante comme dans le cas de la fabrication du poly(acétate de vinyle). Elle peut être menée de manière discontinue, semi-continue ou continue.
Comparaison des polymérisations en suspension et en émulsion
[modifier | modifier le code]| Polymérisation | Avantages | Inconvénients |
|---|---|---|
| Suspension |
|
|
| Émulsion |
|
|
Polymérisation en dispersion
[modifier | modifier le code]Dans ce type de polymérisation, proche de la polymérisation par précipitation, il n'y a pas de phase dispersée au départ. La phase continue contient tout ce qu'il faut pour que la polymérisation ait lieu: amorceur, monomère et stabilisant. Le polymère précipite progressivement lorsqu'il se forme et forme des particules stabilisées stériquement par de l'alcool polyvinylique par exemple. Les particules obtenues ont un rayon de 0,1 à 10 μm[9].
Notes et références
[modifier | modifier le code]- (en) Stanley R Sandler et Wolf KaroRobert, Polymer syntheses, Boston/San Diego/New York etc., Gulf Professional Publishing, , 332 p. (ISBN 0-12-618511-5 et 9780126185119, lire en ligne)
- (en) Andrew J. Peacock et Allison R. CalhounSandlerWolf, Polymer chemistry : properties and applications, Hanser Verlag, , 397 p. (ISBN 1-56990-397-2 et 9781569903971, lire en ligne)
- (en) Description de la polymérisation en masse
- Fabrication des polymères, sur scientificsentence.net
- (en) A. S.r Mujumda, Handbook of industrial drying, Boca Raton (Fla.), CRC Press, , 1280 p. (ISBN 978-1-57444-668-5 et 1-57444-668-1, lire en ligne)
- Thierry Hamaide, Clara Bourdelet, Jean Lager, Hervé Schaal et Jean Baptiste Thibaut, « La synthèse des polymères dans l'eau, une réponse ancienne pour une nouvelle éco-conception », Actual Chim., mai 2014, no 385
- Christopher D. Anderson et Eric S Daniels, Emulsion Polymerisation and Latex Applications, Smithers Rapra Publishing, , 160 p. (ISBN 1-85957-381-9 et 9781859573815, lire en ligne)
- George Odian (trad. de l'anglais), La polymérisation – Principes et applications [« Principles of polymerization »], Paris, Polytechnica, , 823 p. (ISBN 2-84054-028-2). La nucléation homogène est favorisée par une meilleure solubilité du monomère dans l'eau et par une plus faible concentration en tensioactif. Pour la nucléation micellaire, c'est l'inverse.
- (en) Krzysztof Matyjaszewski et Thomas P. Davis, Handbook of Radical Polymerization, Wiley-IEEE, , 920 p. (ISBN 0-471-46157-1 et 9780471461579, lire en ligne)