碱金属

碱金属是指在元素周期表中同属第1族(舊稱ⅠA族[1])的六个金属元素:锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)[2],其中钫具有強烈的放射性。
碱金属均有一个属于s轨道的最外层电子,[3][4][5],因此这一族属于元素周期表的s区。[6]碱金属的化学性质显示出十分明显的同族元素相似性,是化学元素周期性的例证之一。[3]尽管氢也同属于第1族[2][7],但其显现的化学性质和碱金属相差甚远,[8]因此通常不被认为是碱金属。[9][10]
碱金属有很多相似的性质;它们都是银白色的金属、密度小、熔点和沸点都比较低、标准状况下有很高的反应活性。[3]它们易失去价电子形成带一个单位正电荷的阳离子。[11]:28 它们一般质地较为柔软,可以用刀切开,露出银白色的剖面;由于能和空气中的氧气反应,剖面暴露于空气中将很快失去光泽。[3]由于碱金属化学性质都很活泼,贮存时一般将它们放在礦物油中,或封于稀有气体中保存,以防止其与空气或水发生反应。[12]在自然界中,碱金属元素只有化合态,不能以游离态存在。[12] 碱金属都能和水发生激烈的反应,生成碱性的氢氧化物,其反应能力与剧烈程度随着原子序数的增大而越强。 [3][13]
所有已发现的碱金属均天然存在于自然界中。按照化學元素豐度顺序,自然界化学丰度最高的是钠,其次是钾,接下来是锂、铷、铯,最后是钫。钫的放射性很强,半衰期很短,十分不穩定,因此只能作为天然衰變鏈的产物,在自然界中痕量存在。[14][15]已有实验试图合成可能的第七个碱金属Uue,但截至目前均以失败告终。[16]此外,由于相对论效应会极大影响包括Uue在内的超重元素的性质,因此Uue可能不是碱金属;[17]即使它真的是碱金属,它的物理性质和化学性质也可能会和其它六个碱金属有较大差异。[18]:1729–1733
碱金属有多种用途。铷或铯的原子钟是游离态碱金属元素最著名的应用实例之一,[19]其中以铯原子钟最为精准。[20][21]钠化合物较为常见的一种用途是制作钠灯,一种高效光源。[22][23] 人类对食盐(氯化钠)的使用可追溯到古代。钠和钾是生物体中的电解质,具有重要的生物学功能,属于膳食矿物质。[24][25]尽管其它碱金属并非膳食矿物质,它们同样会对身体产生或有益或有害的影响。[26][27][28][29]
性质
[编辑]化学性质
[编辑]
这一族的核外电子结构(特别是最外层电子)模式特殊,因此它们的化学性质呈规律性变化:
| Z | 元素 | 核外电子构型 | 电子排布[注解 1] |
|---|---|---|---|
| 3 | 锂 | 2, 1 | [He] 2s1 |
| 11 | 钠 | 2, 8, 1 | [Ne] 3s1 |
| 19 | 钾 | 2, 8, 8, 1 | [Ar] 4s1 |
| 37 | 铷 | 2, 8, 18, 8, 1 | [Kr] 5s1 |
| 55 | 铯 | 2, 8, 18, 18, 8, 1 | [Xe] 6s1 |
| 87 | 钫 | 2, 8, 18, 32, 18, 8, 1 | [Rn] 7s1 |
由于具有强烈的放射性,钫可展现的化学性质十分有限,因此它的化学性质并未得到深入研究。[3]对碱金属元素的化学性质研究主要针对这一族的前五个元素。
已知的碱金属元素均为活泼金属,至今尚未发现碱金属的天然单质。[30] 因此,碱金属通常泡在矿物油或煤油中保存。 [12] 碱金属和卤素剧烈反应生成卤化物,为白色的离子晶体,除氟化锂外均可溶于水。[3] 碱金属和水反应生成强碱性的氢氧化物溶液,因此应当妥善保存。原子量越大(越“重”)的碱金属,反应越为剧烈:比如铯加入水中引发的爆炸比钾更剧烈,就是一个例子。[3][13] [20]
由于拥有较低的有效核电荷,且只需失去一个电子就能达到稀有气体电子结构,[3]碱金属元素的第一电离能是同周期元素中最低的。[5]与之相对的是,碱金属的第二电离能普遍很高,因为失去一个电子的碱金属离子为稀有气体电子结构,而且电子和原子核的距离下降了。这一能量差异导致碱金属在反应中通常失去一个电子,形成一价正离子。[11]:28
化学家起初认为碱金属不会形成负离子,但后来的研究发现了一类含负一价碱金属离子的不稳定化合物,称作碱化物。碱化物中的碱金属负离子有充满的s亚层,这使得它更加稳定。“反氢化钠”,H+Na-,是这类化合物中一个引人注目的例子。通常的氢化钠应当是Na+H-,[31]反氢化钠具有与之相反的电荷分布。因此,反氢化钠的能量高,纯净物很不稳定,但它的几种衍生物已被预测为稳定或亚稳定的。[31][32]根据目前已知的信息,除锂之外的碱金属都能形成碱化物。[33][34][35]碱化物的化学性质和电子盐(一种以束缚电子为负离子的盐)类似。[36]由于拥有不同寻常的化学计量和低电离电位,碱化物有很高的理论研究价值。
锂离子(Li+)的半径很小(76pm),会极化化合物中的阴离子,使化合物具有一定共价性;[3] 因此,锂的化学性质和这一族中的其他元素有一些差异。例如,氟化锂是唯一不溶于水的碱金属卤化物;[3]氢氧化锂是唯一不潮解的碱金属氢氧化物。[3]锂和镁存在对角线规则,[3]锂的某些化学性质和镁相近。比如说,锂可以形成稳定的氮化物,这一性质在镁所在的碱土金属中很普遍,但在碱金属中则显得独特。[37]此外,在各自所在的族中,只有锂和镁可以形成共价有机金属化合物。[38]此外,高氯酸锂和其它含有无法被极化的大阴离子的锂盐比类似的碱金属盐稳定,可能是因为 Li+ 有高溶剂化能。[11]:76此效应也使最简单的锂盐基本以水合物的形式存在,因为无水物极易潮解:这也是氯化锂和溴化锂可以用作除湿器和空调的原因。[11]:76 根据推测,钫和其它碱金属也会有一些性质差异。钫的原子量很高,它的电子运动较快,会引发更明显的相对论效应,钫具有的7s电子因而会更稳定。根据推测,钫的电负性、电离能会比铯更高,这和碱金属从上到下电负性和电离能的变化趋势相反。此外,钫的原子半径可能会反常地低。[18]:1729[39]已经考虑到相对论效应而预测钫的几个特性是电子亲和能 (47.2 kJ/mol)[40] 和 Fr2 分子的键解离能 (42.1 kJ/mol)。[41] CsFr 分子的极性为 Cs+Fr−,显示钫的 7s 壳层比铯的 6s 壳层更受到相对论效应的影响。[42] 此外,超氧化钫 (FrO2) 预测有可观的共价性,这和其它碱金属超氧化物不同。这是由于钫的6p 电子成键导致的。[42]
化合物及反应
[编辑]和水的反应(碱金属氢氧化物)
[编辑]
所有的碱金属都可和冷水剧烈反应——乃至产生爆炸——生成强碱性的碱金属氢氧化物水溶液,释放氢气。[43]沿这一族从上到下,反应逐渐加剧:锂和水反应平缓进行,伴有冒泡现象;钠和钾与水反应可产生燃烧;铷和铯沉入水中,迅速产生大量氢气并产生冲击波,足以将玻璃容器击碎。[3]碱金属放入水中时产生的爆炸分为两个独立阶段:首先,金属和水反应,产生氢气。这一步中,反应性更强的重碱金属元素能更快地产生氢气。接下来,反应第一阶段产生的热量通常会点燃新产生的氢气,使其在空气中爆炸性燃烧。这一氢气爆炸可在水面上产生可见的火焰,而刚开始的金属和水的反应主要在水下进行,因此不产生火焰。[13]
但是碱金属在水中发生爆炸原因仍存在争议。2015年国外的一份文献中称,碱金属与水反应在其接触水的一瞬间就被决定了,碱金属与水反应中碱金属会瞬间释放自己的电子,使之无法束缚自己内部的正电荷继而引发爆炸。[44]
和第14族(第IVA族,碳族)元素的反应
[编辑]锂和钠可与碳反应生成乙炔化合物(Li2C2和Na2C2),这类化合物也可由金属与乙炔反应制得。钾、钠、铷和铯可与石墨反应,碱金属原子嵌入到六边形的石墨层中,形成石墨层间化合物MC60(深灰色、近乎黑色)、MC48(深灰色、近乎黑色)、MC36(蓝色)、MC24(钢蓝色)、MC8(铜黄色)。它们的导电性比纯石墨强200倍,说明碱金属的价电子转移到石墨层中,形成M+Cx-的化合物。[45]加热KC8时,钾原子发生脱嵌。随着加热时间的增长,逐渐形成KC24、KC36、KC48直到KC60。KC8是强还原剂,可自燃,接触水则爆炸。[46][47]和石墨反应时,较大的碱金属原子(钾、铷、铯)开始时形成KC8,而小的碱金属原子开始时形成KC6。[48]
碱金属和碳族其它的元素反应时,生成含笼状结构的离子化合物。例如硅化物M4Si4(M=K,Rb,Cs),含有M+和四面体Si44−离子。[45]碱金属锗化物中含有简单的Ge4-离子,以及其它的簇合(津特耳相)离子,Ge42−, Ge94−, Ge92−, 以及 [(Ge9)2]6−,其化学性质和相应的硅化物相近。[11]碱金属锡化物主要为离子化合物。阴离子有Sn4-离子,[49]有时有更复杂的簇合离子,例如K4Sn9 中的 Sn94−, [50]简单的铅阴离子(Pb4-)尚未发现;碱金属铅化物均含有复杂的簇合离子。[11]
和第15族(第VA族,氮族)元素的反应
[编辑]
锂是唯一在标准状况下和氮气反应的碱金属,它的氮化物也是唯一稳定的碱金属氮化物。破坏N2分子中的N-N三键需要很高的能量,因而N2显惰性。形成碱金属氮化物需要消耗能量,从而将碱金属电离生成M+离子,破坏N2分子的三键并形成N3-离子;这些能量由形成碱金属氮化物释放的晶格能进行补偿。离子半径越小,电荷越高,晶格能越大;而碱金属无法形成高电荷离子,因而碱金属氮化物的晶格能只取决于金属离子的半径。所以,只有半径最小的锂能够释放足够的晶格能,让形成氮化物的反应成为一个放热反应,形成Li3N。而其它的碱金属无法释放足够的晶格能,形成氮化物的反应是吸热的,因而在标准条件下不生成氮化物。[37] Na3N和K3N极不稳定,容易分解为原来的组成元素(氮气和碱金属)。[52][53]空间位阻禁止了氮化铷和氮化铯的存在。[11]:417 不过,钠和钾可以形成无色的叠氮化物,包含线性的 N−
3 。由于碱金属阳离子很大,它们是热力学稳定的,融化时仍未分解。[11]:417
碱金属均易于和磷、砷反应,生成M3P/M3As. P3- 和As3-的半径更大,形成化合物需要提供的能量更低,因而不需要很高的晶格能。[45] M3P/M3As不是仅有的碱金属磷化物或砷化物。钾有9种不同的已知磷化物:K3P, K4P3, K5P4, KP, K4P6, K3P7, K3P11,KP10.3 以及 KP15。 [54]大多数金属可生成砷化物,而只有碱金属、碱土金属可生成离子型砷化物。Na3As的结构很复杂:其中的Na-Na距离为328-330pm,比金属钠单质中的Na-Na距离更短。这说明即使和低电负性的碱金属形成的化学键也不是纯粹的离子键。[11]已发现M3As以外的碱金属砷化物。比如LiAs,它带有金属光泽和强导电性,说明其中可能存在金属键。[11]碱金属锑化物中的Sb3-离子是强还原剂,因此碱金属锑化物不稳定,易发生反应。碱金属锑化物和酸反应形成不稳定的剧毒气体SbH3。[55]铋化物不完全为离子性,而是含有部分离子键和部分金属键的金属互化物。[56] 实际上,它们具有某些金属性质,化学计量比MSb的碱金属锑化物包含以螺旋Zintl结构键合的锑原子。 [57] 铋化物甚至不是完全离子化的;它们是含有部分金属键和部分离子键的金属间化合物。 [58]
和第16族(VIA族,氧族)元素的反应
[编辑]9O
2 簇合物, 由两个共面的 正八面体 组成
标准状况下,碱金属均可和氧气剧烈反应,形成多种多样的氧化物。比如简单氧化物(含O2-离子),过氧化物(含O2−
2 离子,氧原子间存在单键),超氧化物(含O−
2离子)等。锂在空气中燃烧生成氧化锂;钠和氧气反应生成氧化钠和过氧化钠的混合物;钾则形成过氧化钾和超氧化钾的混合物;铷和铯只形成超氧化物。锂、钠和钾在空气中仅仅是燃烧,而铷和铯可在空气中自燃,这也说明碱金属从上到下反应性增强。[37] 半径小的碱金属离子趋向于极化复杂的负离子(过氧化物和超氧化物),将复杂离子中的电子吸引到其中的一个氧原子中,形成一个O2-离子和一个氧原子。因此,锂在室温下和氧气反应只生成简单氧化物;而钠和钾的半径更大,极化效应更弱,因而可以形成较不稳定的过氧化物。这一族中最下方的铷和铯半径很大,可以形成最不稳定的超氧化物。形成超氧化物释放的能量最多,因此较大的碱金属原子和氧气反应更趋向于生成超氧化物。铷和铯的简单氧化物和过氧化物确实存在,但是无法在标准状况下由碱金属和氧气反应制得。[37]不过如果控制反应条件,除钫之外的所有碱金属都能形成简单氧化物,过氧化物和超氧化物。碱金属过氧化物和超氧化物是强氧化剂。过氧化钠和超氧化钾可与二氧化碳反应,形成碱金属碳酸盐和氧气,因而在潜艇的空气净化器中被使用。呼出气体中的水蒸气可使超氧化钾除去二氧化碳的反应更加高效。[45][59]
铷和铯可形成比超氧化物更复杂的氧化物。铷在空气中被氧化可生成Rb6O和Rb9O2.铯生成的氧化物种类丰富得多,比如臭氧化物CsO3, [60][61]以及几种色彩鲜明的低氧化物,如Cs
7O, Cs
4O, Cs
11O
3, Cs
3O (深绿色[62]), CsO, Cs
3O
2,[63]以及Cs
7O
2.[64][65]真空下加热Cs
7O
2可生成Cs
2O.[66]
碱金属可和较重的氧族元素(硫、硒、碲、钋)发生类似反应。除钫之外,所有的M2Ch(M为碱金属,Ch=S、Se、Te、Po)都是已知的。碱金属和过量的氧族元素反应生成M2Chx,其中的氧族元素原子连接成链状。比如,钠可和硫反应生成硫化钠(Na2S)以及各种多硫化钠(Na2Sx, x=2~6),其中含有S2−
x 离子。[45] Se2-和Te2-的碱性使得碱金属硒化物水溶液和碲化物水溶液呈碱性。碱金属和硒、碲直接反应时,除生成M2Se或M2Te之外,还生成多硒化物和多碲化物。[67]碱金属在300-400 °C下和钋直接反应,形成含Po2-离子的碱金属钋化物,后者化学上十分稳定。[11][68][69]
和第17族(VIIA族,卤素)元素,以及氢气的反应
[编辑]碱金属是元素周期表中电负性最低的元素,因而趋向于和电负性最高的鹵素形成离子键,产物为碱金属卤化物。氯化钠,也就是通常所说的食盐,就是其中之一。碱金属和卤素的反应性呈规律性变化:从锂到铯,反应性越来越强;从氟到碘,反应性越来越弱。碱金属卤化物化学式均为MX(M为碱金属,X为卤素),均为白色离子晶体,常温下为固态。[3][37]除氟化锂之外,碱金属卤化物均可溶于水。氟化锂中的Li+和F-的半径都很小,二者间静电相互作用很强,因而氟化锂的晶格能很高,因此不溶于水。[3]
碱金属也和氢反应,形成离子型氢化物,其中的氢负离子可作为拟卤素。它们可用作还原剂,合成氢化物、氢配合物和氢气。[11]:83[45] 其它拟卤化物也是已知的,其中最著名的是氰化物。除了氰化锂,它们的晶体结构类似真正的碱金属卤化物,而氰离子可以自由旋转。[11]:322 三元碱金属卤氧化物,像是 Na3ClO、K3BrO (黄色)、 Na4Br2O、 Na4I2O和 K4Br2O也是已知的。[11]:83 碱金属多卤化物不稳定,尽管超大的铷和铯通过极弱的极化性来稳定这些化合物。[11]:835
配位化合物
[编辑]碱金属的半径很大,而电荷仅有+1,所以碱金属通常不和简单的路易斯碱生成配合物。半径最小的Li+有最多的配合物,随着离子半径增大,形成的配合物越来越少。水溶液中,碱金属离子以八面体的六水合离子([M(H2O)6]+)存在;由于锂离子半径小,因而形成的是正四面体的四水合离子[Li(H2O)4]+.由于水分子的极性,二者由静电力相互吸引,形成水合离子。因此,含碱金属离子的无水盐常被用做干燥剂。[45]同样由于静电相互作用的原因,碱金属易于和冠醚、穴醚形成配合物。比如,Li+可和12-冠-4形成配合物,Na+与15-冠-5形成配合物,K+与18-冠-6形成配合物。[45]
氨溶液
[编辑]和大多数金属不同,碱金属在液氨中缓慢溶解,生成氢气和碱金属氨基化合物(MNH2).使用催化剂可加速这一过程。形成的氨基化合物不溶于液氨,从体系中析出;剩余的液体是有明显颜色的碱金属液氨溶液。这类溶液中含有溶剂化电子,因而颜色明显,具有强导电性。浓度小于3mol/L时,溶液呈深蓝色,导电性是氯化钠水溶液的10倍;浓度大于3mol/L时,溶液显铜黄色,导电性能和液态金属(如汞)相近。[11][45][71]除了氨基化合物与溶剂化电子,溶液中还有碱金属离子(M+),碱金属原子(M),碱金属双原子分子(M2)和碱金属负离子(M-)。后三种粒子均不稳定,最终生成热力学稳定的碱金属氨基化合物和氢气。氨合电子为强还原剂,常在化学合成中使用。[45]
金属有机化学
[编辑]
锂形成的有机金属化合物种类最多,相对最为稳定,成键为共价键。有机锂试剂为不导电的固体或液体,熔点低,易挥发,趋向于生成化学式为(RLi)x的多聚物(R为有机基团)。以甲基锂为例,其化学式为(CH3Li)x,x=4或6,结构分别为正四面体型和正八面体型。[45][72]有机钠化物和有机钾化物也是多聚的。[73]锂的电负性低,因而锂-碳键的电荷密度主要集中在碳原子上,可有效形成碳负离子;因此,有机锂化合物是非常强力的碱,也是强力的亲核试剂。丁基锂常被用做强碱,已经投入商业化生产。
有机钠试剂在化学中的应用较为有限。相比较而言,有机锂试剂已投入商业化生产,且反应性能更易于使用。有些有机钠试剂具有商业意义,其中最主要的是环戊二烯基钠。四苯硼钠也可归类为有机钠化物,因为在固态下这一化合物中的钠和芳基形成化学键。更重的碱金属形成的有机金属化合物反应性更强,应用更为受限。施洛瑟碱是这类化合物中的一种重要试剂。它是正丁基锂和叔丁醇钾的混合物,可和丙烯反应,生成丙烯钾(KCH2CHCH2)。 顺-2-丁烯和反-2-丁烯在和碱金属接触时实现化学平衡。所用的碱金属为锂和钠时,这一异构化反应进行得较快;而使用钾、铷、铯时进行得较慢。钾、铷、铯更倾向高位阻的构象。[74]有机钠、有机钾、有机铷和有机铯化合物成键以离子性为主,在非极性溶剂中几乎不可溶。[45]
物理性质
[编辑]铯有金色光泽,其它的碱金属均为银白色。[75]碱金属都很软,具有较低的密度、熔点以及沸点。[3]
下表总结了碱金属的物理性质和原子性质。标有问号的数据尚未确定,或者是由元素周期律推断所得,并非实际测量结果。
| 碱金属 | 标准原子量 (u)[注解 2][77][78] | 熔点 | 沸点[5] | 密度 (g/cm3) | 电负性 (鲍林标度) | 第一电离能 (kJ•mol−1) | 原子半径 (pm) | 焰色反应 | |
|---|---|---|---|---|---|---|---|---|---|
| 锂 | 6.94(1)[注解 3] | 453.69 K, 180.54 °C, 356.97 °F | 1615 K, 1342 °C, 2448 °F | 0.534 | 0.98 | 520.2 | 152 | 红色[3][79] | |
| 钠 | 22.98976928(2) | 370.87 K, 97.72 °C, 207.9 °F | 1156 K, 883 °C, 1621 °F | 0.968 | 0.93 | 495.8 | 186 | 橙黄色[3][79] | |
| 钾 | 39.0983(1) | 336.53 K, 63.38 °C, 146.08 °F | 1032 K, 759 °C, 1398 °F | 0.89 | 0.82 | 418.8 | 227 | 紫丁香色 或粉色[3][79] | |
| 铷 | 85.4678(3) | 312.467 K, 39.31 °C, 102.76 °F | 961 K, 688 °C, 1270 °F | 1.532 | 0.82 | 403.0 | 248 | 红色或紫红色[3][79] | |
| 铯 | 132.9054519(2) | 301.59 K, 28.44 °C, 83.19 °F | 944 K, 671 °C, 1240 °F | 1.93 | 0.79 | 375.7 | 265 | 蓝色或紫色[3][79] |  |
| 钫 | [223][注解 4] | ? 300 K, ? 27 °C, ? 80 °F | ? 950 K, ? 677 °C, ? 1250 °F[80] | ? 1.87 | ? 0.7 | 380 | ? | ? | |
元素周期律
[编辑]元素周期表中,碱金属族是族内元素性质最为相近的一族。[3]沿着周期表从上到下,碱金属元素的原子半径逐渐升高,[81] 电负性逐渐降低,[81] 反应性逐渐升高,[3]熔沸点逐渐降低。[81]总体而言,碱金属的密度从上到下逐渐升高;钾是一个例外,它的密度比上面的钠略低。[81]
原子半径和离子半径
[编辑]
沿周期表从上到下,已知的碱金属原子半径逐渐升高。[81]由于屏蔽效应,当一个原子有多于一个电子层时,每个电子被原子核吸引的同时都受到其他电子的排斥。[82]碱金属价电子只受到一个+1的净电荷的作用,因为部分有效核电荷被内层电子(除去最外层的所有电子)所抵消,而碱金属内层电子的数量永远比核电荷数少一个。因此,碱金属原子半径只和电子层数有关;电子层数随周期数增加而增加,因此碱金属原子半径从上到下逐渐增大。[81]
碱金属的离子半径比原子半径小得多。失去最外层电子后,碱金属离子比碱金属少一层电子,因而半径更小。此外,碱金属离子的有效核电荷升高了,原子核对核外电子的吸引更强烈,导致半径减小。[3]
第一电离能
[编辑]
元素或分子的第一电离能指将最容易解离的电子从气态原子/分子中解离出来,形成带+1电荷的气态离子所需的能量。第一电离能受有效核电荷数、内层电子的屏蔽效应、最易解离的电子(对主族元素而言,通常是最外层电子)到原子核距离的影响。核电荷数与屏蔽效应影响作用于易解离电子的有效电荷。作用于碱金属最外层电子的有效电荷相同(均为+1),因此影响第一电离能的只有最外层电子到原子核的距离。沿这一族从上到下,外层电子到原子核的距离逐渐升高,核对最外层电子的吸引逐渐减弱, 第一电离能因而逐渐降低。[81]钫是这一趋势的特例。由于相对论效应的作用和7s轨道的收缩,钫的价层电子比非相对论模型的预测值更为接近原子核,价电子受到更多的吸引力,因此钫的第一电离能比铯略高。[18]:1729由于碱金属原子的最外层电子只受到一个有效电荷作用,且失去一个电子后能形成稳定的稀有气体电子构型,因此碱金属的第一电离能是同周期元素中最低的。
碱金属元素的第二电离能远高于第一电离能,因为第二易解离的电子位于一个全充满的电子轨道中,因此难以解离。[3]
反应活性
[编辑]沿周期表从上到下,碱金属反应性逐渐升高,这是碱金属的第一电离能和原子化能共同作用的结果。由于碱金属的第一电离能从上到下逐渐降低,外层电子逐渐易于在反应中解离,反应性逐渐升高。 原子化能被用来衡量元素的金属键强度,随着碱金属从上到下原子半径上升,金属原子核间距上升,金属键的离域电子到原子核的距离上升,原子化能下降。将原子化能与第一电离能相加,可以得到一个数值,它和碱金属参与反应所需的活化能密切相关(但不相等)。从上到下,这个数值逐渐降低,碱金属的反应活化能也逐渐降低。因此,化学反应可以更快进行,反应性因而从上到下逐渐增加。[43]
电负性
[编辑]
电负性描述原子或官能团吸引电子的能力。[87]假如氯化钠中氯和钠之间形成的是共价键,由于氯的电负性更高,两个原子间的共用电子对会被吸引到靠近氯的一侧。由于氯和钠的电负性相差实在太大,共用电子对过于靠近氯,实际上已经可以看做钠上的电子被氯夺走,因此在氯化钠固体中实际形成的是离子键。如果将钠换成锂的话,电子对就不会离氯这么近。由于锂原子半径小,电子对与锂的有效核电荷的距离更近,碱金属原子和共用电子对之间的吸引力增强了。由此得出,半径较大的碱金属原子吸引共用电子对的能力更差,电负性越低。[81]
由于锂的电负性较高,锂的某些化合物显共价性。比如,碘化锂可溶于有机溶剂中,大多数共价化合物拥有这一性质;[81] 氟化锂是唯一不溶于水的碱金属卤化物;[3] 以及氢氧化锂是唯一不潮解的碱金属氢氧化物。[3]
熔沸点
[编辑]
加热金属至其熔点时,原本将金属原子束缚在一起的金属键变弱,原子因而可以自由移动;加热至沸点时,金属键完全断裂。[81][89]因此,碱金属熔沸点的变化规律说明碱金属的金属键强度从上到下逐渐变弱。[81]金属原子由原子核与离域电子之间的静电引力束缚在一起。[81][89]从上到下碱金属的原子半径升高,离域电子和原子核的距离增大,金属键因而变弱,导致熔沸点降低。[81]由于内层电子的屏蔽效应,核电荷的变化可忽略。[81]
密度
[编辑]碱金属晶体均为体心立方结构。[11],因此影响密度的只有两个因素:单位体积可容纳的原子数,以及单一原子的质量。单位体积可容纳的原子数由原子半径决定,因此如果知道碱金属的原子半径和原子量数值,就可计算碱金属的密度。由结果来看,碱金属的密度从上到下依次增高,钾是一个例外。由于拥有同一周期中最小的原子量和最大的原子半径,碱金属是同一周期中密度最低的金属。[81]锂、钠、钾是仅有的三个密度小于水的金属元素。[3]
原子核稳定性
[编辑]| Z | 碱金属 | 稳定同位素 | 原生核素 | 斜体字表示不稳定核素 奇数-奇数同位素以粉色表示 | ||
|---|---|---|---|---|---|---|
| 3 | 锂 | 2 | — | 7 Li | 6 Li | |
| 11 | 钠 | 1 | — | 23 Na | ||
| 19 | 钾 | 2 | 1 | 39 K | 41 K | 40 K |
| 37 | 铷 | 1 | 1 | 85 Rb | 87 Rb | |
| 55 | 铯 | 1 | — | 133 Cs | ||
| 87 | 钫 | — | — | 无原生核素 | ||
碱金属的原子序数均为奇数,因此它们的同位素只可能为奇数-奇数核素(质子数和中子数均为奇数,质量数为偶数)或奇数-偶数核素(质子数为奇数,中子数为偶数,质量数为奇数)。奇数-奇数原生核素较为罕见——这类核素通常会发生β衰变,衰变产物为偶数-偶数核素,后者拥有更高的束缚能,因而更加稳定。 [90]
由于奇数-奇数核素十分罕见,碱金属几乎所有的主要同位素均是奇数-偶数核素。碱金属奇数-奇数同位素中,锂-6是稳定的,钾的放射性同位素钾-40也有较长的寿命。对一个给定的奇数质量数,只能有一种β衰变稳定同位素(不产生β衰变的同位素)。和偶数-偶数核素与奇数-奇数核素间的束缚能差距相比,奇数-偶数核素与偶数-奇数核素的束缚能几乎没有差距,因此和β衰变稳定同位素质量相等的其它核素(同量素)会产生β衰变,生成能量最低的核素。总之,质子数和/或中子数为奇数的核素相对不稳定,这就导致拥有奇数原子序数的元素——例如碱金属—— 拥有的稳定同位素数量比原子序数为偶数的元素少。26种单一同位素元素中,除铍之外的所有成员的质子数均为奇数,中子数均为偶数。(铍的质子数为偶数,中子数为奇数)[90]
钠、钾、铷、钫拥有天然存在的放射性同位素: 钠-22和钠-24为宇生的痕量放射同位素 [91],钾-40和铷-87有很长的 半衰期,得以在自然界中存在,[92]钫的所有同位素均具有放射性。[92] 20世纪初,人们认为铯是放射性的,[93][94]尽管它没有天然放射性同位素。[92][注解 13]钾的天然放射性同位素K-40约占自然界中的钾的0.012%,因此自然界的钾存在微弱的放射性。[95]正是钾产生的这一微弱辐射,导致1925年有人错误地声称发现了87号元素。[96][97]
铯-137是一种β放射源,也是一种强γ放射源。它的半衰期为30.17 年,是两种主要的中等寿命裂变产物之一(另一种为锶-90)。这两种裂变产物是核燃料棒使用完毕后数年到数百年产生的辐射的主要来源。137
Cs
经过高能β衰变,最终生成稳定的钡-137。137
Cs
捕获中子的速度很慢,因而不能通过中子照射的方法进行处理,只能任其衰变。[98]在水文学研究中,137
Cs
被用做示踪物,和氚在这方面的应用类似。[99]几乎所有的核试验都会向环境中释放少量的铯-134与铯-137。某些核事故也会释放这两种同位素,比如切尔诺贝利核事故和福岛第一核电站事故。截至2005年,铯-137仍是切尔诺贝利核电厂附近隔离区的主要辐射源。[100]
延伸
[编辑]
尽管目前只发现了6个碱金属元素,目前已有研究预测比钫更重的碱金属元素的物理性质与化学性质。据推测,钫之后的第一个碱金属元素是目前尚未发现的第119号元素Uue。它是第八周期的第一个元素,性质和可能同族的其它元素类似。[18]:1729–1730它的化学性质可能更接近钾[102]或铷[18]:1729–1730;而根据元素周期律,Uue的性质应当与铯或钫更为相近,乃至比它们更易反应。Uue的价电子运动速度高,产生相对论效应,导致Uue的第一电离能升高,金属半径和离子半径降低,反应性下降。[102]目前已发现相对论效应对钫的性质产生了类似影响。[18]:1729–1730相对论效应可能导致Uue元素不像其它碱金属那样反应。[17] Uue的8s轨道因相对论效应而变得稳定,导致 Uue的电子亲合能升高——远高于铯和钫的电子亲合能,甚至比其它所有的碱金属元素都高。 相对论效应同样会导致Uue的极化性大幅下降。[18]:1729–1730另一方面, Uue的熔点可能仍符合碱金属元素的熔点变化规律,也就是比钫更低。据推测,Uue的熔点可能在0 °C 到 30 °C之间。[18]:1724

Uue的价层电子稳定性导致8s轨道的收缩,继而导致原子半径降低。据预测Uue的原子半径为240 pm,[18]:1729–1730,比铷原子(247 pm)略小。[3] 因此,+1氧化态的Uue的化学性质应当更接近铷,而不是钫。与之相反,据预测Uue+ 的离子半径比Rb+大。Uue+的最外层7p轨道不稳定,因而比低层数的p轨道更大。除碱金属特征的+1氧化态之外,Uue还可能拥有其它碱金属没有的+3氧化态。[11]:28[18]:1729–1730 Uue中7p3/2亚层不稳定且有膨胀,导致7p3/2亚层的最外电子的电离能比其他方式的预测值低,因此可能解离更多电子产生+3氧化态。[11]:28[18]:1729–1730 很多Uue化合物中可能有7p3/2电子参与成键,这些化合物因而显现部分共价性[42]
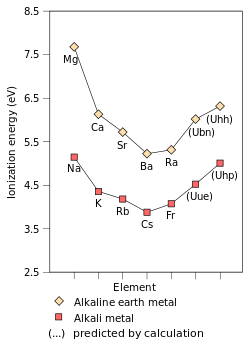
关于比Uue更重的碱金属元素的预测研究相对较少。根据元素周期表向下推测,下一个碱金属应该是第169号元素Uhn;而根据狄拉克-福克方法计算,下一个碱金属应当是第165号元素Uhp,其核外电子排布为[Uuo] 5g18 6f14 7d10 8s2 8p1/22 9s1.[18]:1729–1730[101] 深入的计算显示Uhp的电离能会比Uup、钫、铯更高,与钠相近。Uhp的原子半径也会符合自铯开始的递减趋势:它的原子半径可能和钾相近。 [18]:1729–1730除9s电子外,Uhp的7d电子也可能一道参与化学反应,形成比+1更高的氧化态,因而比起碱金属Uhp可能和硼族元素的行为更加接近。[18]:1732–1733
截至2012年,尚未有关于Uhp以后的碱金属性质的研究。第八周期之后的元素拥有强烈的相对论效应和层结构效应,由较轻元素性质变化规律做出的外推因而变得完全不准确。 相对论效应使s轨道稳定,层结构效应使层数高的电子层的p,d,f,g轨道变得不稳定,二者产生的效果相反。因此,对第八周期之后的元素而言,相对论计算和非相对论计算得出的结果差距更加明显。[18]:1732–1733由于碱金属和碱土金属均为s区元素,对Uue和Uhp性质及变化趋势做出的预测可能同样适用于相应的碱土金属: Ubn和Uhh.[18]:1729–1733
具有部分类似性质的其它元素或基团
[编辑]很多物质和碱金属一样倾向于形成一价阳离子。类似拟卤素,这些物质有时称作“拟碱金属”。它们包括一些元素和更多的原子团,这些原子团在大小和极化性的方面和碱金属类似。[103]
氢
[编辑]
氢拥有一个核外电子,通常出于方便起见将其放在元素周期表第1族的最上侧。然而,氢通常不被看做是一个碱金属元素。[9] 一般条件下,氢以双原子分子(H2)的形式存在;[104] 然而,碱金属只有在高温下变成气态后才能形成双原子分子(如Li2)。[105]
和碱金属一样,氢拥有一个价电子[8],易于和卤素反应,[8]但是氢和碱金属的相似性也只有这些了。[8] [8]将氢放在锂上方,主要是由于它的电子构型和碱金属相似,并非出于化学性质的考虑。[9][8]有时它被放在碳的上方,因为氢和碳的电负性相近;[106]有时会放在拥有某些相似化学性质的氟上方。[8][106]
氢的第一电离能为 (1312.0 kJ/mol),远高于碱金属的第一电离能。[83][84]由于只需一个电子就可形成稀有气体构型,氢的行为有时更接近卤素。和卤素一样,氢可以形成-1价的氢负离子。[8]尽管在碱化物中,碱金属也可形成负离子,然而这类产物很不稳定,只用于实验室研究。[31][32]在极端高压的作用下(比如木星核心和土星核心的高压),氢发生相变生成金属氢,性质和碱金属类似。[107] 反对这种放置的论点是,与卤素放热形成卤化物的反应不同,氢形成氢化物的反应是吸热的。 H− 阴离子的大小也违反卤素离子越往下大小越大的趋势。实际上,H -的扩散性很强,因为它的单个质子不能轻易控制两个电子。 [57]:15–6 当它们经受非金属过渡到金属的作用时,在3000 K下的液体金属氢的电阻率约等于在2000 K压力下的铷和铯的液体的电阻率。[108]
氢的 1s1 电子构型类似碱金属 (ns1),不过由于不存在 1p 亚层,氢的这个构型很特殊。 它可以失去一个电子,形成氢正离子 H+,或是再获得一个电子,形成氢负离子 H−。[11]:43 前者可以说明氢和碱金属类似,而后者显示氢和卤素相似。不过,由于 1p 轨道不存在,不管归类到碱金属或是卤素都不能完美解决问题。[11]:43 在热力学性质如电离能和电子亲和能方面,碳族元素也很合适,但是氢不能以四价存在。 所以,没有一种排法是令人满意的, 尽管碱金属是最常见的放置位置(如果选择一个放置位置),因为在所有单原子氢物种中,水合氢离子目前为止是最重要的,它是酸碱化学的基础。 [106] 氢因其异常的电子构型和小尺寸,产生的非正统性质的一个例子是氢离子非常小(半径约为0.15 pm,而大多数其他原子和离子的大小为50-220pm),因此除了与其他原子或分子缔合以外,它在缩合体系中不存在。 实际上,质子在化学物质之间的转移是酸碱理论的基础。 [11]:43 氢形成氢键的能力也是独特的,这是电荷转移,静电和电子相关贡献现象的影响。 [106] 虽然类似的锂键是已知的,但它们大多是有静电的。 [106] 然而,在某些分子晶体中,氢可以起到与碱金属相同的结构作用,并且与轻的碱金属(尤其是锂)有着密切的关系。 [109]
铵及其衍生物
[编辑]铵离子(NH+
4)的性质像是一种介于钾和铷之间的“中间碱金属”[103][110],经常被看做碱金属的近亲。[111][112][113]举例来说,绝大多数的碱金属盐易溶于水,绝大多数的铵盐也溶于水。[114]根据推测,在极高压下,铵可以形成稳定的金属铵(由NH+
4离子和游离电子构成)。这一反应可能在天王星和海王星的内部进行,这两颗行星的内部磁场可能受到了该反应的显著影响。[112][113]据估计,从氨气与氢气的混合物转变为金属铵所需的压强为25 GPa 左右,低于将游离态物质转化为金属态通常所需的压强100 GPa[112]
其它“拟碱金属”包括铵的烷基衍生物,其中铵的一些氢原子被替换成烷基或芳基。季铵盐(NR+
4)可用于替代昂贵的Cs+来稳定又大又容易极化的阴离子(如 HI−
2)。[11]:812–9季铵氢氧化物和碱金属氢氧化物一样是强碱,会和空气中的二氧化碳反应,生成碳酸盐。[57]:256此外,铵的氮原子可以被更重的氮族元素取代,生成鏻(PH+
4)或𬬹(AsH+
4)阳离子,它们的氢原子也可以被烷基或芳基取代。四氢锑阳离子(SbH+
4)本身仍未被发现,但它的衍生物已获得表征。[103]
二茂钴和其衍生物
[编辑]二茂钴, Co(C5H5)2,是一种茂金属,是 二茂铁的钴类似物。 它是一种暗紫色固体。 二茂钴有 19 个价电子,比有机过渡金属化合物的常见价电子数量—18个多一个。它非常稳定的类似物二茂铁有18个电子,符合18电子规则。 该额外的电子占据一个于Co-C键的反键轨道。 因此, Co(C5H5)2 的很多化学反应都倾向于失去这个多余的电子, 形成极度稳定的 18电子阳离子二茂钴阳离子。 许多二茂钴盐与铯盐会共沉淀,而氢氧化二茂钴是可以吸收大气中二氧化碳,形成碳酸二茂钴的强碱。 [57]:256 与碱金属一样,二茂钴是一种强还原剂,由于十个甲基的诱导效应,十甲基二茂钴的还原性更强。 [115] 钴可以被其较重的同类物铑取代,从而得到更强的还原剂二茂铑。 [116] 二茂铱(用 铱代替钴)可能会更强,但由于其不稳定性,因此并未得到很好的研究。 [117]
铊
[编辑]
和所有的碱金属一样,铊拥有+1氧化态。[11]:28Tl+的离子半径为164 pm,和K+ (152 pm)、Ag+(129 pm)相仿,因此含Tl+的铊化合物性质通常和相应的钾化合物或银化合物相近。[118][119]在铊被发现后的数年里,欧洲大陆认为铊是一种碱金属;[119]:126在尤利乌斯·洛塔尔·迈耶尔1868年编制的周期表以及门捷列夫1869年编制的元素周期表中,铊被当做第六个碱金属,位置与铯相邻。[120]后来两人都对周期表进行了修改。在迈耶尔1870年的周期表和门捷列夫1871年的周期表中,铊被放在了硼族,也就是如今它所在的位置;而铯下方的一格为空缺。[120]不过铊同样有+3氧化态,而已知的碱金属都不具备这一氧化态。[11]:28 [注解 14]如今人们认为钫是第六个碱金属元素。[2]
第11族元素
[编辑]11族元素(又称货币金属)铜,银和金,由于它们可以形成具有不完整d轨道的离子,因此通常归类为过渡金属。 在物理上,它们相对于其它过渡金属,有较低的熔点和较高的电负性值,更像是后过渡金属。 Cu,Ag和Au被填充的d轨道和自由s电子形成它们的高电导率和热导率。第11族左侧的过渡金属会经历s电子和部分填充的d壳层之间的相互作用,从而降低电子迁移率。[121] 化学上,第11族金属的行为类似于主族金属,处于+1价态,因此在某种程度上与碱金属有关:这是其先前被标记为IB族,与碱金属的 IA族有关的原因。它们有时被分类为后过渡金属。[122] 它们的光谱类似于碱金属。[123] 它们的一价正离子是顺磁性的,并且与碱金属的盐一样,它们的盐没有颜色(除非阴离子有颜色)。[124]
在门捷列夫 1871年元素周期表中,铜、银和金被列出了两次,一次在VIII族下(铁系元素和铂族金属),另一次在IB族下。 尽管如此,IB族里的它们还是用括号括了起来,指出它是暂定的。 门捷列夫对元素进行分配的主要标准是元素的最大氧化态:在此基础上,由于当时已知存在二价铜和三价金化合物,因此无法将第11族元素归为IB族。[123] 但是,消除IB族将使IA族成为唯一缺乏A–B分叉的主族(VIII族被标记为过渡族)。[123] 此后不久,大多数化学家选择对IB族中的这些元素进行分类,并将它们从VIII族中删除,以得到对称性:这是主要的分类方法,直到现代的中长18列元素周期表的出现使碱金属和第11族金属分离。[123]
传统上,第11族金属被视为碱金属的一部分,因为它们具有碱金属特征性的 s1电子构型(第1族:p6s1;第11族:d10s1)。 然而,相似性主要限于两组的+1化合物的化学计量数,而不是它们的化学性质。[11]:1177 这是由于被完全填充的d壳层比被完全填充的p壳层对最外层s电子的屏蔽作用弱得多,因此第11族金属比相应的碱金属具有更高的第一电离能和更小的离子半径。[11]:1177 此外,它们具有较高的熔点,硬度和密度,并且在液氨中具有较低的反应性和溶解度,在其化合物中具有更大的共价性。[11]:1177 最后,碱金属在标准电极电势表的顶部,而第11族金属几乎在底部。[11]:1177 第11族元素的d壳层比碱金属的p壳层更容易被破坏,因此第二和第三电离能更低,能够实现比+1高的氧化态和更丰富的配位化学,从而使第11族金属的性质更像过渡金属。[11]:1177 特别值得一提的是与铷和铯可以和金形成离子化合物,在其中形成金离子(Au-)。金离子以溶剂化形式出现在液氨溶液中:此处的金的表现为拟卤素,因为它的5d106s1构型比准封闭壳5d106s2少一个电子,也就是很稳定的汞的电子构型。[11]:1177
历史
[编辑]碱金属族的出现
[编辑]1865年左右,约翰·纽兰兹发表了一系列论文,列出了这些元素,以原子量增加和物理化学性质相似的顺序出现,第一个元素会和第八个元素的性质类似。他将这种周期性比作音乐的八度。在这种情况下,分开了一个八度的音符具有相似的音乐功能。[125][126] 他将所有已知的碱金属(锂到铯)以及铜,银和铊(它们表示出碱金属的+1氧化态特征)放入当时的元素周期表,一起成为一个族。他的周期表把氢归类为卤素。[120]

1869年后,德米特里·伊万诺维奇·门捷列夫提出了他的元素周期表,将锂放在钠,钾、铷、铯和铊形成的族的顶部。[127] 两年后,门捷列夫修改了元素周期表,将第1族中的氢置于锂上方,并且将铊移至硼族元素。 在此版本,铜、银和金被放置了两次,一次是11族元素的一部分,另一次是包含当今 8至11族元素的VIII族。[123][注解 15] 引入18列元素周期表后,第11族元素移动到了d区中的当前位置,而碱金属则留在了 IA组中。后来该组的名称在1988年更改为第1族。[1] 碱金属这个名称来自以下事实:当碱金属溶于水中时,它们所形成的氢氧化物均为强碱。[3]
锂
[编辑]
1800年,巴西化学家若澤·博尼法西奧·德·安德拉達在瑞典的于特岛上发现了透锂长石(LiAlSi4O10)[128][129][130]然而直到1817年,正在贝采里乌斯的实验室工作的约翰·奥古斯特·阿韦德松才在分析透锂长石时发现了一种新元素。[131][132]这种新元素形成的化合物和钠、钾的化合物相似;它的碳酸盐和氢氧化物在水中的溶解度比钠、钾的对应化合物低。[133]贝采里乌斯将这一未知的材料命名为"lithion/lithina",这一名称来自希腊语的λιθoς (lithos,意为“岩石”)。当时已知的另外两种碱金属中,钠因在动物血液中含量丰富而知名,钾是在植物灰烬中发现的,因此lithos这一名称体现了这种材料的独特来源——矿石。贝采里乌斯将这一材料中的金属命名为"lithium".[30][129][132]
钠
[编辑]
人类从远古时期开始就知道钠的化合物了。食盐(氯化钠)是人类活动的重要物资。罗马历史学家老普林尼在他的《博物志》海水部分的一处旁注中提到:“在罗马……士兵的薪饷曾经是食盐,‘薪水’(salarium)这个词就来自‘盐’(sal)”。[134]受拉丁语影响的语言中的“薪水”一词多是salarium的变形,比如英语中的salary,意大利语和西班牙语中的salario. 钠的英文名Sodium来自苏打(soda),而苏打的名称源自阿拉伯语的suda (صداع),意为“头痛”。人们很早知道碳酸钠有缓解头痛的功效,苏打因此得名。[135] 1807年,汉弗莱·戴维用之前分离钾的类似方法电解熔融苛性钠(氢氧化钠),首次将钠分离出来。[136]
钾
[编辑]
从古代起人们就使用白草木灰了,然而它的使用史的大部分时间中,人们并不了解草木灰和钠矿物盐是完全不同的物质。1702年,格奥尔格·恩斯特·斯塔尔获取了一些实验证据,提出草木灰和矿物盐有本质上的差异,[137]到了1736年 亨利·路易·杜默·德·孟梭证明了这一差异。[138]而那时人们仍然不知道钾、钠化合物的准确化学组成,也不知道钾、钠这两种元素。因此,安托万-洛朗·德·拉瓦锡并没有将碱金属收录进他1789年编制的元素表中。[139][140]纯钾的首次分离发生在1807年,由汉弗莱·戴维爵士在英国完成。戴维用当时新发明的伏打电堆电解熔融的苛性钾,得到了这一元素。钾是首个用电解法分离出的元素。[141]同年,戴维宣布用相似的方法从苛性钠中分离出金属钠,从而说明了两种元素及相应化合物的本质差异。[136]
铷
[编辑]
铷在1861年由罗伯特·本生和古斯塔夫·基尔霍夫在德国的海德堡发现。本生和基尔霍夫最早提出用光谱学方法寻找新的元素;他们用分光镜分析鳞云母矿石时发现了铷。铷的名称rubidium来自拉丁语的rubidus,意为“深红”或“鲜红”,这一名称来自铷的发射光谱中的亮红色谱线。[142][143]铷的发现紧随铯的发现,而铯同样是由本生和基尔霍夫用分光镜发现的。[144]
铯
[编辑]1860年,罗伯特·本生和古斯塔夫·基尔霍夫在德国巴德迪尔克海姆的矿泉水中发现了铯。铯的名称caesium来自拉丁语的caesius,意为“天蓝色”。这一名称来自铯的发射光谱中的蓝色谱线。[142][注解 16][146]铯在本生和基尔霍夫发明分光镜仅一年后即被发现,是首个通过光谱学方法发现的元素。[144]
钫
[编辑]1939年之前,第87号元素被错误或者不完整地发现了至少四次。[96][97][147][148] 1939年,居里研究所的玛格丽特·佩里在巴黎提纯一份锕-227样品时真正发现了钫。锕-227的衰变能为220 keV,然而佩里发现其中一些衰变粒子的能量低于80 keV。佩里认为这是一种之前未被分辨出的衰变产物,于是在提纯过程中将其分离出来,但是后来在提纯的后锕-227中又产生了这种物质。后续的大量实验证明这种未知物质不可能是钍、镭、铅、铋或者铊,而显现出可碱金属相近的化学性质(比如和铯盐形成共沉淀)。佩里因而认为这种未知物是第87号元素,由锕-227的α衰变产生。[15]于是佩里试图测定锕-227中α衰变与β衰变的比率。她的第一次实验测定的α衰变比率为0.6%,后来她将这一数值修正为1%。[149]钫是最后一种在自然界中发现的元素。[注解 17]
钫下元素(Eka-钫)
[编辑]钫下方的元素(Eka-Francium, 类钫)极有可能是第119号元素Uue;[18]:1729–1730然而相对论效应使得这一结论存在一些不确定性。[17]合成Uue的首次尝试发生在1985年:科学家在美国加州伯克利的超重离子直线加速器(superHILAC)中用钙-48轰击锿-254,结果未鉴别出任何原子。因而其收率限制为300nb。[16][150]
这一反应选择了254Es做为原料。254Es的质量数大,半衰期相对较长(270天),可获得性高(数毫克),因此常被用来合成超重元素。[152]然而这一反应近期极不可能生成Uue原子,因为很难生产足够多的锿-254来制作一个尺寸足够大的靶,从而将实验的灵敏度提升到所需级别。[16]锿尚未在自然界中发现,只能在实验室制取。不过,由于Uue是扩展元素周期表第8周期的第一个元素,未来极有可能用其它反应来制取它。德国达姆施塔特的GSI亥姆霍兹重离子研究中心正在尝试用钛核轰击锫制取Uue.[153]目前还没有发现位于第8周期的元素;而且由于液滴不稳定性,或许只有原子序数较低的第8周期元素(原子序数低于128)在物理上可能存在。[102][154]比Uue更重的碱金属原子序数太高,因此尚未有合成尝试。[18]:1737–1739
存在范围
[编辑]太阳系
[编辑]
奥多-哈尔金斯规则说明:除氢以外,质子数为偶数的元素比质子数为奇数的元素更为常见——后者拥有未成对的质子,趋向于捕获另一个质子,原子序数因此增加。而偶数原子数的元素中的质子均为成对质子,自旋彼此抵消,使得原子更加稳定。[156][157][158]所有的碱金属的原子序数均为奇数,它们在太阳系中的丰度低于邻近的两族元素(稀有气体和碱土金属)。铷之后的碱金属只能在超新星中生成,而不能由恒星核合成获得,所以较重的碱金属比轻的碱金属稀有。锂的丰度低于钠、钾,因为它在太初核合成和恒星中都极少生成——大爆炸只能生成痕量的锂、铍和硼,因为这些元素缺少稳定的5核子或8核子核素;而恒星核合成反应会通过3氦过程生成碳来通过这一瓶颈。[155]
地球
[编辑]
地球是由形成太阳的物质云构成的,但是在太阳系的形成和演化过程中,行星获得了不同的组成。此外,地球的自然史导致地球某些部分拥有不同的元素分布。地球质量约为5.98×1024 kg. 其中主要的成分是铁(32.1%,质量分数,下同), 氧 (30.1%), 硅 (15.1%), 镁 (13.9%), 硫 (2.9%), 镍 (1.8%), 钙 (1.5%)以及铝 (1.4%);另外的1.2%为剩下的所有元素。由于质量层化,地球的核心区可能主要由铁构成(88.8%),此外可能还有镍(5.8%)、硫(4.5%),以及剩余0.9%的其它元素。[159]
由于反应活性很高的缘故,碱金属在自然界不以单质形式存在。它们属于亲石元素,极易和氧结合,因而和二氧化硅紧密关联,形成不会沉入地球核心的低密度矿物,因而停留在地球表面附近。钾、铷、铯属于地球化学中的不相容成分,因为它们的离子半径大,不能进入矿物中的阳离子聚集区域。[160]
钠和钾在土壤中十分丰富。[14][161] 钠在地壳中的质量分数约为2.6%,是地壳中丰度排在第六的元素;[162]钾的质量分数约为1.5%,排在第七。[162]许多矿物中都含有钠,其中最常见的是大量溶解在海水中食盐(氯化钠)。很多固态矿物中也含有钠,比如岩盐、角闪石、冰晶石、钠硝石、沸石等。[162]
锂的反应活性相对较低,因而可以在海水中大量发现。据估计锂在海水中的质量分数约为0.14~0.25ppm[163][164] ,若以體積莫爾濃度表示就是25μM.[165]
铷的丰度和锌大抵相同,比铜要高,可在白榴石、铯榴石、光鹵石、铁锂云母和透锂长石中找到。[166]铯的丰度低于铷,但比很多为人们所熟知的元素(比如镉、锡、锑、钨)更高。[20]
钫-223是钫的唯一一种天然存在的同位素。[77][78]它是锕-227的α衰变产物,在铀和钍的矿物中极少量存在。[167] 在铀矿石中,大概有1018 个铀原子才会出现一个钫原子。[168][169] 钫的半衰期极短,为22分钟;因此据估计地壳中最多只会有30 g的钫。[170][171]
制备与分离
[编辑]制取纯的碱金属较为困难。碱金属的反应活性很高,这导致它们极易和常见的物质(例如水、空气)反应,且无法用其他元素置换制备。因此,碱金属只能用电解一类的高能方法分离。[3][45]锂和钠通常用电解熔融氯化物的方法获得,为了降低熔点,通常会在混合物中加氯化钙。其它几种较重的碱金属一般用还原剂(通常是镁或者钙)还原的方法制备。用还原反应可获得液态或气态的碱金属,产物经分馏可获得纯化的碱金属。[45]
锂盐必须从矿物泉水中、 卤水池或者卤水矿产生的卤水中提取。电解熔融的氯化锂和氯化钾混合物,便可以得到金属锂。[172]
钾存在于多种矿物中,例如钾石盐(氯化钾)等。[3]有时会用分解氯化钾来制取金属钾,但钾更常见的制备方法是电解氢氧化钾,[173] 和19世纪末20世纪初制取钠的方法类似。[174]氢氧化钾矿物广泛存在于加拿大、俄罗斯、白俄罗斯、德国、以色列、美国和约旦等地。含钾矿物也可以从海水中提取。 钠主要存在于海水和干涸的海床中。[3]现在的制备方法是用唐士电解池电解,过程中会加入一些钙、锶、钡盐,以将氯化钠的熔点降至700 °C以下。[175][176] 超纯钠可通过叠氮化钠分解制备。[177]

在20世纪50年代到60年代的数年间,铷主要从碱金属混合碳酸盐(英語:Alkarb)中提取。碱金属混合碳酸盐是钾生产过程中的一种副产物,包含21%的铷,剩余部分是钾和少量的铯。[178]如今通常用分级结晶法将铷和钾、铯分开:将一种含铷和铯的矾(Cs,Rb)Al(SO4)2•12H2O经30步反应处理,可得到纯净的铷矾,从而进一步制取铷。[179][180]铷的生产方法有限,矿物丰度低,导致含铷化合物的产量只有每年2到4吨。[179] 然而铯并不是用这一反应分离制取的。铯主要从 铯榴石矿中提取,有三种常见的提取方法:酸消化、碱分解以及直接还原。 [179][181]
钫-223是唯一一种存在于自然界的钫的同位素,[77][78]由锕-227的α衰变生成。据计算地壳中最多只会有30g的钫[170],极为稀少。因此钫主要通过核反应制备:197Au + 18O → 210Fr + 5 n,产物可以是钫-209、钫-210、钫-211.[182]至今最大的一份钫样品含有300,000个钫中性原子,[183]合成方法正是上述的核反应。 [183]
所有的碱金属都可以从硅酸盐中用同样的步骤获得:首先用硫酸将铝和所需的碱金属从矿石中溶出;溶液中加碱将铝离子以氢氧化铝的形式沉淀出来,将铝和碱金属分离。将剩余的碱金属离子以碳酸盐的形式选择性沉淀出来,再用盐酸溶解沉淀;浓缩所得溶液可得碱金属氯化物,将其电解即得碱金属。[45]
应用
[编辑]除钫以外的碱金属均有很多种商业应用。锂常被用做电池材料,氧化锂可用来处理二氧化硅。锂还可用来制作润滑脂,处理空气,对铝的生产也有辅助作用[184]
纯钠可用于制作钠灯,一种十分高效的光源;[22][23] 还可以用来抛光其它金属的表面。[185][186]钠化合物也有十分广泛的用途,比如常见的食盐就是氯化钠;常用的肥皂是钠或钾的脂肪酸盐。[187]
钾是植物重要的营养元素,因此钾的化合物常被用做化肥。[11]:73[188] 氢氧化钾是一种强碱,被用来控制各种体系的pH值。[189][190]
铷和铯常用于制作原子钟。[19]铯原子钟极其精确,如果一台铯原子钟从8千万年前的恐龙时代开始运行到今天,它的偏差不会超过4秒。[20]因此铯原子被用来定义“秒”单位。[21]铯常添加在石油工业所用的钻井液中。[20][191]铷离子常用于制作紫色焰火。[192]
钫没有商业应用,[168][169][193]但钫的原子结构相对简单,因而在光谱学实验中有广泛应用。钫的光谱学研究可以提供和能级、次原子粒子间的耦合常数相关的信息。[194]科学家研究激光束缚的钫-210粒子发射的光,获得了原子能级跃迁的准确数据,和量子论的预测相近。[195]
生物学作用及防护
[编辑]
通常在生物系统中只有痕量的锂。锂没有已知的生物学作用,但是摄入锂确实对身体有影响。[26] 精神病学中常用每天0.5 到 2 克的碳酸锂,做为精神稳定剂治疗双极性情感疾患(躁郁症),不过这种治疗有一些副作用。[26]摄入过量的锂会导致呆滞、言语不清、呕吐等症状,[26]乃至引发中枢神经中毒。[26]而用于治疗躁郁症的锂用量仅仅略低于中毒剂量。[26][196] 锂在人体中的天然生物学功能尚待研究;不过从生物化学特性、被人体处理的方式以及在老鼠、山羊身上的实验结果来看,锂是一种必要的稀有元素。[197][198]
钠和钾存在于一切已知的生物学系统中,通常作为细胞内外的电解质存在。[24][25] 钠是控制血容量、血压、渗透平衡和pH的必须营养素,人类对钠的最小生理需求量为每天500毫克。[199] 氯化钠——也就是俗称的食盐——是食物中主要的钠源,用作调味品和食物处理(比如泡菜、腊肉)。氯化钠主要来自处理过的食物。[200]钠的DRI为每天1.5g,[201]然而根据2010年的调查,中国城市居民平均每日摄入的钠相当于13.5g食盐(5.31 g钠)。[202]而每天摄入的钠超过2.3克就会提高患高血压的几率。[203] 由钠摄入过量导致的高血压每年在全球导致了760万例早逝。[204]
钾是细胞内的主要阳离子,[24]而钠是动物细胞外的主要阳离子。[24][25] 这两种带电粒子的浓度差异导致了细胞内外的电势差,也就是膜电势。细胞膜两侧的钠钾浓度平衡由细胞膜内的离子泵维持。[205]由钠钾浓度差产生的膜电势让细胞可以产生动作电位——一次急剧的细胞放电过程。细胞放电的能力是很多种身体机能(神经传导、肌肉收缩、心脏功能等)的基础。[205]

铷没有已知的生物学作用,不过或许可能促进代谢。[27][206][207]由于钾、铷、铯的化学性质相似,铷和铯有可能取代身体中的钾离子引发低钾血症,因此它们具有轻微的毒性。[27][207][28]绝大多数人极少摄入铯。摄入大量的铯会导致剧烈过敏和痉挛,但通常不可能通过自然途径摄入这种剂量的铯,因此铯不属于主要化学污染物。[208] 氯化铯在小鼠身上的LD50为2.3 g 每千克体重,和氯化钾、氯化钠的LD50相仿。[209]一些癌症替代疗法用氯化铯作为治疗药物,[210]这种未经科学证实的疗法可能和至少50名患者的死亡有联系。[211] 铯的放射性同位素需要格外小心处理,若对铯-137γ放射源处理不当,可能导致这种放射性核素泄露,引发辐射伤害。最著名的例子是1987年的戈亚尼亚事故:巴西戈亚尼亚的一处废品堆积场中扫出了一台放疗仪,这台放疗仪属于一家废弃的诊所,未经妥善处理。放疗仪中发光的铯盐被卖给了好奇又缺乏教育的买家。事件造成了4人死亡及大量的辐射伤害。铯-137是切尔诺贝利核事故释放的对健康威胁最大的四种放射性同位素之一(另外三种为铯-134、碘-131和锶-90)。[100]
钫没有生物学功能。[212]其强放射性可能引发辐射中毒,因此钫极可能有毒。 [29] 然而至今为止最大的钫样品只有约300,000个中性钫原子,[183]因此绝大多数人不可能摄入钫。
参看
[编辑]注解
[编辑]- ^ 为了简洁,用稀有气体标记法表示核外电子排布:先写出之前一个稀有气体元素的符号,再继续写下除去该稀有气体元素之外的电子排布。
- ^ 括号中给出的数据为原子量的不确定度。这一数字表示的是该数值有效数字末位的变化范围。比如,1.00794(7) 表示 1.00794±0.00007,而 1.00794(72) 表示 1.00794±0.00072.[76]
- ^ 列出的这一数值为便于商业和贸易使用的通用值。实际值范围在6.938和6.997之间,具体数值取决于样品的同位素丰度。[78]
- ^ 这一元素没有稳定核素, 方括号中标出的是该元素寿命最长的同位素的原子量。[77][78]
- ^ 单位为 皮米 (pm)。单元格背景从红色到黄色,表示的半径逐渐增高。 原子半径和离子半径的颜色标度一致。
- ^ 单元格背景从红色到黄色,表示的电离能逐渐降低。
- ^ 另有来源提供数据为 4.0712 ± 0.00004 eV (392.811(4) kJ/mol).[39]
- ^ 单元格背景从红色到黄色,表示的电负性降低,。
- ^ 鲍林推断钫的电负性在鲍林标度上为0.7,和铯相同[85] 此后铯的电负性数值被修正为0.79,然而由于缺乏相应的实验数据,无法对钫的电负性数值进行修正。[86] 由于相对论效应的作用,钫的电离能为392.811(4) kJ/mol ,比铯(375.7041(2) kJ/mol )略高,[39] 这说明铯的电负性应当比钫更低。
- ^ 单元格背景从红色到黄色,表示的熔点/沸点逐渐降低。熔点和沸点的颜色标度不同。
- ^ 11.0 11.1 曾有计算显示钫的熔点为 27 °C (80 °F, 300 K).[88] 然而,因为钫的稀缺和强放射性,它的熔点仍未确定。因此,估计的沸点数值也是不确定的,一种说法为677 °C (1250 °F, 950 K). 由于放射性元素会产生热量,如果有足够多的钫,它在标准状况下几乎一定是液体。
- ^ 单元格背景从红色到黄色,表示的密度逐渐升高。
- ^ 那时还没有发现钫。
- ^ 研究显示第七个碱金属Uue可能拥有+3氧化态,但它尚未被发现。[18]:1729–1730
- ^ 在1869年,门捷列夫的元素周期表中,铜和银与氢和汞排在同一族中,而金暂定在铀和当时未发现的铝下元素之下,属于硼族元素。
- ^ 本生此处引用了奥卢斯•格利乌斯在《阿提卡之夜》第二卷第26章中记载的说法,文中提到尼基狄乌斯•费古卢斯用caesia形容天蓝色:Nostris autem veteribus "caesia" dicta est, quae a Graecis glaukopis, ut Nigidius ait, "de colore caeli quasi caelia".(翻译:“……此外,我们的早期作家用caesia一词作为希腊语γλαυκῶπις的同义词,就像尼基狄乌斯曾说:‘来自天空的颜色,就像它原本就是caelia一样’”)[145]
- ^ 一些元素——如锝和钚——起初由人工制得,后来在自然界中发现了。
- ^ 星号表示激发态。
参考文献
[编辑]- ^ 1.0 1.1 Fluck, E. New Notations in the Periodic Table (PDF). Pure Appl. Chem. (IUPAC). 1988, 60 (3): 431–436 [24 March 2012]. doi:10.1351/pac198860030431. (原始内容存档 (PDF)于2012-03-25).
- ^ 2.0 2.1 2.2 国际纯粹与应用化学联合会 (2005). 无机化学命名法 (IUPAC 2005年推荐). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. pp. 51. 电子版。.
- ^ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 3.11 3.12 3.13 3.14 3.15 3.16 3.17 3.18 3.19 3.20 3.21 3.22 3.23 3.24 3.25 3.26 3.27 3.28 3.29 3.30 3.31 3.32 3.33 3.34 Royal Society of Chemistry. Visual Elements: Group 1 – The Alkali Metals. Visual Elements. Royal Society of Chemistry. [2012-01-13]. (原始内容存档于2012-08-05).
- ^ Periodic Table: Atomic Properties of the Elements (PDF). nist.gov. National Institute of Standards and Technology. September 2010 [2012-02-17]. (原始内容存档 (PDF)于2012-08-09).
- ^ 5.0 5.1 5.2 5.3 5.4 5.5 5.6 Lide, D. R. (编). CRC Handbook of Chemistry and Physics 84th. Boca Raton, FL: CRC Press. 2003.
- ^ Leach, Mark R. The Internet Database of Periodic Tables. meta-synthesis.com. 1999–2012 [2012-05-20]. (原始内容存档于2014-08-10).
- ^ IUPAC Periodic Table of the Elements (PDF). iupac.org. International Union of Pure and Applied Chemistry. 2011-01-21 [2012-02-22]. (原始内容存档 (PDF)于2012-02-27).
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 8.7 Vinson, Greg. Hydrogen is a Halogen. HydrogenTwo.com. 2008 [2012-01-14]. (原始内容存档于2012-01-10).
- ^ 9.0 9.1 9.2 International Union of Pure and Applied Chemistry > Periodic Table of the Elements. IUPAC. [2011-05-01]. (原始内容存档于2018-09-27).
- ^ Folden, Cody. The Heaviest Elements in the Universe (PDF). Saturday Morning Physics at Texas A&M. 2009-01-31 [2012-03-09]. (原始内容 (PDF)存档于2014-08-10).
- ^ 11.00 11.01 11.02 11.03 11.04 11.05 11.06 11.07 11.08 11.09 11.10 11.11 11.12 11.13 11.14 11.15 11.16 11.17 11.18 11.19 11.20 11.21 11.22 11.23 11.24 11.25 11.26 11.27 11.28 11.29 11.30 11.31 Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- ^ 12.0 12.1 12.2 The OpenLearn team. Alkali metals. OpenLearn. The Open University. 2012 [2012-07-09]. (原始内容存档于2014-11-29).
- ^ 13.0 13.1 13.2 Gray, Theodore. Alkali Metal Bangs. Theodore Gray. [2012-05-13]. (原始内容存档于2014-10-31).
- ^ 14.0 14.1 Abundance in Earth's Crust. WebElements.com. [2007-04-14]. (原始内容存档于2007-03-09).
- ^ 15.0 15.1 Adloff, Jean-Pierre; Kaufman, George B. (2005-09-25).Francium (Atomic Number 87), the Last Discovered Natural Element (页面存档备份,存于互联网档案馆). The Chemical Educator 10 (5). Retrieved on 26 March 2007.
- ^ 16.0 16.1 16.2 Lougheed, R.W.; Landrum, J.H.; Hulet, E.K.; Wild, J.F.; Dougan, R.J.; Dougan, A.D.; Gäggeler, H.; Schädel, M; Moody, K.J.; Gregorich, K.E.; Seaborg, G.T. Search for superheavy elements using 48Ca + 254Esg reaction. Physical Review C. 1985, 32 (5): 1760–1763. Bibcode:1985PhRvC..32.1760L. doi:10.1103/PhysRevC.32.1760.
- ^ 17.0 17.1 17.2 Gäggeler, Heinz W. Gas Phase Chemistry of Superheavy Elements (PDF). Lecture Course Texas A&M. 5–7 November 2007 [2012-02-26]. (原始内容 (PDF)存档于2012-02-20).
- ^ 18.00 18.01 18.02 18.03 18.04 18.05 18.06 18.07 18.08 18.09 18.10 18.11 18.12 18.13 18.14 18.15 18.16 18.17 18.18 18.19 18.20 18.21 Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria. Transactinides and the future elements. Morss; Edelstein, Norman M.; Fuger, Jean (编). The Chemistry of the Actinide and Transactinide Elements 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006. ISBN 1-4020-3555-1.
- ^ 19.0 19.1 Cesium Atoms at Work. Time Service Department—U.S. Naval Observatory—Department of the Navy. [2009-12-20]. (原始内容存档于2015-02-23).
- ^ 20.0 20.1 20.2 20.3 20.4 Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. Mineral Commodity Profile: Cesium (PDF). United States Geological Survey. 2004 [2009-12-27]. (原始内容存档 (PDF)于2009-11-22).
- ^ 21.0 21.1 The NIST reference on Constants, Units, and Uncertainty. National Institute of Standards and Technology. [2013-10-19]. (原始内容存档于2018-07-26).
- ^ 22.0 22.1 Lindsey, Jack L. Applied illumination engineering. 1997: 112. ISBN 978-0-88173-212-2.
- ^ 23.0 23.1 Kane, Raymond; Sell, Heinz. Revolution in lamps: A chronicle of 50 years of progress. 2001: 241. ISBN 978-0-88173-351-8.
- ^ 24.0 24.1 24.2 24.3 Winter, Mark. WebElements Periodic Table of the Elements | Potassium | biological information. WebElements. [2012-01-13]. (原始内容存档于2012-01-21).
- ^ 25.0 25.1 25.2 Winter, Mark. WebElements Periodic Table of the Elements | Sodium | biological information. WebElements. [2012-01-13]. (原始内容存档于2012-01-20).
- ^ 26.0 26.1 26.2 26.3 26.4 26.5 Winter, Mark. WebElements Periodic Table of the Elements | Lithium | biological information. Webelements. [2011-02-15]. (原始内容存档于2011-03-07).
- ^ 27.0 27.1 27.2 Winter, Mark. WebElements Periodic Table of the Elements| Rubidium | biological information. Webelements. [2011-02-15]. (原始内容存档于2011-06-28).
- ^ 28.0 28.1 Winter, Mark. WebElements Periodic Table of the Elements | Caesium | biological information. WebElements. [2012-01-13]. (原始内容存档于2012-02-11).
- ^ 29.0 29.1 Francium – Element information, properties and uses | Periodic Table. Visual Elements Periodic Table. Royal Society of Chemistry. 2012 [2012-06-27]. (原始内容存档于2012-06-02).
- ^ 30.0 30.1 Krebs, Robert E. The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. 2006. ISBN 0-313-33438-2.
- ^ 31.0 31.1 31.2 M. Y. Redko, M. Vlassa, J. E. Jackson, A. W. Misiolek, R. H. Huang RH, J. L. Dye. "Inverse sodium hydride": a crystalline salt that contains H+ and Na−. J. Am. Chem. Soc. 2002, 124 (21): 5928–5929. doi:10.1021/ja025655.
- ^ 32.0 32.1 Agnieszka Sawicka, Piotr Skurski, and Jack Simons. Inverse Sodium Hydride: A Theoretical Study (PDF). J. Am. Chem. Soc. 2003, 125: 3954–3958 [2013-09-17]. (原始内容存档 (PDF)于2013-02-09).
- ^ J. L. Dye, J. M. Ceraso, Mei Lok Tak, B. L. Barnett, F. J. Tehan. Crystalline salt of the sodium anion (Na−). J. Am. Chem. Soc. 1974, 96 (2): 608–609. doi:10.1021/ja00809a060.
- ^ F. J. Tehan, B. L. Barnett, J. L. Dye. Alkali anions. Preparation and crystal structure of a compound which contains the cryptated sodium cation and the sodium anion. J. Am. Chem. Soc. 1974, 96 (23): 7203–7208. doi:10.1021/ja00830a005.
- ^ J. L. Dye. Compounds of Alkali Metal Anions. Angew. Chem. Int. Ed. Engl. 1979, 18 (8): 587–598. doi:10.1002/anie.197905871.
- ^ M. Y. Redko, R. H. Huang, J. E. Jackson, J. F. Harrison, J. L. Dye. Barium azacryptand sodide, the first alkalide with an alkaline Earth cation, also contains a novel dimer, (Na2)2−. J. Am. Chem. Soc. 2003, 125 (8): 2259–2263. PMID 12590555. doi:10.1021/ja027241m.
- ^ 37.0 37.1 37.2 37.3 37.4 Clark, Jim. Reaction of the Group 1 Elements with Oxygen and Chlorine. chemguide. 2005 [2012-06-27]. (原始内容存档于2012-03-16).
- ^ Shriver, Duward; Atkins, Peter. Inorganic Chemistry. W. H. Freeman. 2006: 259 [2012-11-10]. ISBN 978-0716748786. (原始内容存档于2013-02-09).
- ^ 39.0 39.1 39.2 Andreev, S.V.; Letokhov, V.S.; Mishin, V.I.,. Laser resonance photoionization spectroscopy of Rydberg levels in Fr. Phys. Rev. Lett.. 1987, 59: 1274–76. Bibcode:1987PhRvL..59.1274A. PMID 10035190. doi:10.1103/PhysRevLett.59.1274.
- ^ Landau, A.; Eliav, E.; Ishikawa, Y.; Kaldor, U. Benchmark calculations of electron affinities of the alkali atoms sodium to eka-francium (element 119). J. Chem. Phys. 2001, 115 (6): 2389 [2021-03-21]. Bibcode:2001JChPh.115.2389L. doi:10.1063/1.1386413. (原始内容存档于2020-07-31).
- ^ Jones, Cameron; Mountford, Philip; Stasch, Andreas; Blake, Matthew P. s-block Metal-Metal Bonds. Liddle, Stephen T. (编). Molecular Metal-Metal Bonds: Compounds, Synthesis, Properties. John Wiley and Sons. 22 June 2015: 23–24. ISBN 978-3-527-33541-1.
- ^ 42.0 42.1 42.2 Thayer, John S. Chemistry of heavier main group elements. 2010: 81, 84. doi:10.1007/9781402099755_2.
- ^ 43.0 43.1 Clark, Jim. Reaction of the Group 1 Elements with Water. chemguide. 2005 [2012-06-18]. (原始内容存档于2012-05-31).
- ^ 疯狂化学. 北京: 人民邮电出版社. 2015年: 第二章 化学之烈 35页. ISBN 978-7-115-39166-7.
- ^ 45.00 45.01 45.02 45.03 45.04 45.05 45.06 45.07 45.08 45.09 45.10 45.11 45.12 45.13 45.14 Averill, Bruce A.; Eldredge, Patricia. 21.3: The Alkali Metals. Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry 1st. Prentice Hall. 2007 [24 June 2013]. ISBN 978-0-8053-3799-0. (原始内容存档于2013-05-26).
- ^ Catherine E. Housecroft; Alan G. Sharpe. Chapter 14: The group 14 elements. Inorganic Chemistry, 3rd Edition. Pearson. 2008: 386. ISBN 978-0-13-175553-6.
- ^ NIST Ionizing Radiation Division 2001 - Technical Highlights. [2013-09-17]. (原始内容存档于2014-11-29).
- ^ N. Emery; et al. Review: Synthesis and superconducting properties of CaC6. Sci. Technol. Adv. Mater. (free download pdf). 2008, 9 (4): 044102. Bibcode:2008STAdM...9d4102E. doi:10.1088/1468-6996/9/4/044102.
- ^ S.M. Kauzlarich,(1994), Zintl Compounds, Encyclopedia of Inorganic Chemistry, John Wiley & sons, ISBN 978-0-471-93620-6
- ^ Tetrapotassium nonastannide, K4Sn9,C. Hoch, M. Wendorff and C. Röhr, Acta Cryst. (2002). C58, i45-i46 doi:10.1107/S0108270102002032
- ^ Duncan H. Gregory, Paul M. O'Meara, Alexandra G. Gordon, Jason P. Hodges, Simine Short, and James D. Jorgensen. Structure of Lithium Nitride and Transition-Metal-Doped Derivatives, Li3−x−yMxN (M = Ni, Cu): A Powder Neutron Diffraction Study. Chem. Mater. 2002, 14 (5): 2063–2070. doi:10.1021/cm010718t.
- ^ Fischer, D., Jansen, M. Synthesis and structure of Na3N. Angew Chem. 2002, 41 (10): 1755. doi:10.1002/1521-3773(20020517)41:10<1755::AID-ANIE1755>3.0.CO;2-C.
- ^ Fischer, D.; Cancarevic, Z.; Schön, J. C.; Jansen, M. Z. Synthesis and structure of K3N. Z. anorg allgem Chemie. 2004, 630 (1): 156. doi:10.1002/zaac.200300280.. 'Elusive Binary Compound Prepared' (页面存档备份,存于互联网档案馆) Chemical & Engineering News 80 No. 20 (20 May 2002)
- ^ H.G. Von Schnering, W. Hönle Phosphides - Solid-state Chemistry Encyclopedia of Inorganic Chemistry Ed. R. Bruce King (1994) John Wiley & Sons ISBN 978-0-471-93620-6
- ^ Kahlenberg, Louis. Outlines of Chemistry – A Textbook for College Students. READ BOOKS. 2008: 324–325. ISBN 1-4097-6995-X.
- ^ Welcome to Arthur Mar's Research Group. University of Alberta. University of Alberta. 1999–2013 [2013-06-24]. (原始内容存档于2012-12-04).
- ^ 57.0 57.1 57.2 57.3 King, R. Bruce. Inorganic Chemistry of Main Group Elements. Wiley-VCH. 1995. ISBN 978-0-471-18602-1.
- ^ Welcome to Arthur Mar's Research Group. University of Alberta. University of Alberta. 1999–2013 [24 June 2013]. (原始内容存档于2012-12-04).
- ^ Lindsay, D. M.; Garland, D. A. ESR spectra of matrix-isolated lithium superoxide. The Journal of Physical Chemistry. 1987, 91 (24): 6158–61. doi:10.1021/j100308a020.
- ^ Vol'nov, I. I.; Matveev, V. V. Synthesis of cesium ozonide through cesium superoxide. Bulletin of the Academy of Sciences, USSR Division of Chemical Science. 1963, 12 (6): 1040–1043. doi:10.1007/BF00845494.
- ^ Tokareva, S. A. Alkali and Alkaline Earth Metal Ozonides. Russian Chemical Reviews. 1971, 40 (2): 165–174. Bibcode:1971RuCRv..40..165T. doi:10.1070/RC1971v040n02ABEH001903.
- ^ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. The Crystal Structure of Tricesium Monoxide. Journal of Physical Chemistry. 1956, 60 (3): 345–347. doi:10.1021/j150537a023.
- ^ Okamoto, H. Cs-O (Cesium-Oxygen). Journal of Phase Equilibria and Diffusion. 2009, 31: 86. doi:10.1007/s11669-009-9636-5.
- ^ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. Characterization of Oxides of Cesium. The Journal of Physical Chemistry B. 2004, 108 (33): 12360–12367. doi:10.1021/jp036432o.
- ^ Brauer, G. Untersuchungen ber das System Cäsium-Sauerstoff. Zeitschrift für anorganische Chemie. 1947, 255: 101. doi:10.1002/zaac.19472550110.
- ^ Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. Mineral Commodity Profile: Cesium (PDF). United States Geological Survey. 2004 [2009-12-27]. (原始内容存档 (PDF)于2007-02-07).
- ^ House, James E. Inorganic chemistry. Academic Press. 2008: 524. ISBN 0-12-356786-6.
- ^ Moyer, Harvey V., Chemical Properties of Polonium, Moyer, Harvey V. (编), Polonium, Oak Ridge, Tenn.: United States Atomic Energy Commission: 33–96, 1956 [2013-09-17], doi:10.2172/4367751, TID-5221, (原始内容存档于2019-07-01)
- ^ Bagnall, K. W., The Chemistry of Polonium, Adv. Inorg. Chem. Radiochem., 1962, 4: 197–229, ISBN 978-0-12-023604-6
- ^ Alberto, R.; Ortner, K.; Wheatley, N.; Schibli, R.; Schubiger, A. P. Synthesis and properties of boranocarbonate: a convenient in situ CO source for the aqueous preparation of [99mTc(OH2)3(CO)3]+. J. Am. Chem. Soc. 2001, 121 (13): 3135–3136. doi:10.1021/ja003932b.
- ^ Cotton, F.A; G. Wilkinson. Advanced Inorganic Chemistry. John Wiley and Sons Inc. 1972. ISBN 0-471-17560-9.
- ^ Brown, T. L.; Rogers, M. T. The Preparation and Properties of Crystalline Lithium Alkyls. Journal of the American Chemical Society. 1957, 79 (8): 1859–1861. doi:10.1021/ja01565a024.
- ^ William Clegg, Ben Conway, Alan R. Kennedy, Jan Klett, Robert E. Mulvey, Luca Russo "Synthesis and Structures of [(Trimethylsilyl)methyl]sodium and -potassium with Bi- and Tridentate N-Donor Ligands" Eur. J. Inorg. Chem. 2011, 721–726. doi:10.1002/ejic.201000983
- ^ Manfred Schlosser. Superbases for organic synthesis. Pure and Appl. Chem. 1988, 60 (11): 1627–1634. doi:10.1351/pac198860111627.
- ^ Gray, Theodore. Facts, pictures, stories about the element Cesium in the Periodic Table. The Wooden Periodic Table Table. [2012-01-13]. (原始内容存档于2014-01-28).
- ^ Standard Uncertainty and Relative Standard Uncertainty. CODATA reference. National Institute of Standards and Technology. [2011-09-26]. (原始内容存档于2011-10-16).
- ^ 77.0 77.1 77.2 77.3 Wieser, Michael E.; Berglund, Michael. Atomic weights of the elements 2007 (IUPAC Technical Report) (PDF). Pure Appl. Chem. (IUPAC). 2009, 81 (11): 2131–2156 [2012-02-07]. doi:10.1351/PAC-REP-09-08-03. (原始内容存档 (PDF)于2012-11-02).
- ^ 78.0 78.1 78.2 78.3 78.4 Wieser, Michael E.; Coplen, Tyler B. Atomic weights of the elements 2009 (IUPAC Technical Report) (PDF). Pure Appl. Chem. (IUPAC). 2011, 83 (2): 359–396 [2012-02-11]. doi:10.1351/PAC-REP-10-09-14. (原始内容存档 (PDF)于2012-02-11).
- ^ 79.0 79.1 79.2 79.3 79.4 Clark, Jim. Flame Tests. chemguide. 2005 [2012-01-29]. (原始内容存档于2017-12-04).
- ^ 80.0 80.1 Klehr, Wolfram. Francium. apsidium.com. 2007-05-21 [2012-04-25]. (原始内容存档于2008-05-09).
- ^ 81.00 81.01 81.02 81.03 81.04 81.05 81.06 81.07 81.08 81.09 81.10 81.11 81.12 81.13 81.14 Clark, Jim. Atomic and Physical Properties of the Group 1 Elements. chemguide. 2005 [2012-01-30]. (原始内容存档于2014-10-09).
- ^ L. Brown, Theodore; H. Eugene LeMay, Jr.; Bruce E. Bursten; Julia R. Burdge. Chemistry: The Central Science 8th. US: Pearson Education. 2003 [2013-10-24]. ISBN 0-13-061142-5. (原始内容存档于2015-05-02).
- ^ 83.0 83.1 J.E. Huheey, E.A. Keiter, and R.L. Keiter in Inorganic Chemistry : Principles of Structure and Reactivity, 4th edition, HarperCollins, New York, USA, 1993.
- ^ 84.0 84.1 A.M. James and M.P. Lord in Macmillan's Chemical and Physical Data, Macmillan, London, UK, 1992.
- ^ Pauling, Linus. The Nature of the Chemical Bond Third. Cornell University Press. 1960: 93. ISBN 978-0-8014-0333-0.
- ^ Allred, A. L. Electronegativity values from thermochemical data. J. Inorg. Nucl. Chem. 1961, 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5.
- ^ 國際純化學和應用化學聯合會,化學術語概略,第二版。(金皮書)(1997)。在線校正版: (2006–) "Electronegativity"。doi:10.1351/goldbook.E01990
- ^ Francium. Los Alamos National Laboratory. 2003-12-15 [2012-02-19]. (原始内容存档于2016-11-28).
- ^ 89.0 89.1 Clark, Jim. Metallic Bonding. chemguide. 2000 [2012-03-23]. (原始内容存档于2017-07-25).
- ^ 90.0 90.1 Various authors. Lide, David R. , 编. Handbook of Chemistry & Physics 88th. CRC. 2002 [2008-05-23]. ISBN 0-8493-0486-5. OCLC 179976746. (原始内容存档于2018-04-30).
- ^ Universal Nuclide Chart. Nucleonica. Institute for Transuranium Elements. 2007–2012 [2011-04-17]. (原始内容存档于2020-11-11).
- ^ 92.0 92.1 92.2 Sonzogni, Alejandro. Interactive Chart of Nuclides. National Nuclear Data Center: Brookhaven National Laboratory. [2012-10-04]. (原始内容存档于2011-08-22).
- ^ Patton, I. Jocelyn; Waldbauer, L. J. The Radioactivity of the Alkali Metals. Chemical Reviews. 1926, 3: 81. doi:10.1021/cr60009a003.
- ^ McLennan, J. C.; Kennedy, W. T. On the radioactivity of potassium and other alkali metals. Philosophical Magazine. 6. 1908, 16 (93): 377–395. doi:10.1080/14786440908636519.
- ^ Potassium-40 (PDF). Human Health Fact Sheet. Argonne National Laboratory, Environmental Science Division. August 2005 [2012-02-07]. (原始内容 (PDF)存档于2012-03-07).
- ^ 96.0 96.1 Fontani, Marco. The Twilight of the Naturally-Occurring Elements: Moldavium (Ml), Sequanium (Sq) and Dor (Do). International Conference on the History of Chemistry. Lisbon: 1–8. 2005-09-10 [2007-04-08]. (原始内容存档于2006-02-24).
- ^ 97.0 97.1 Van der Krogt, Peter. Francium. Elementymology & Elements Multidict. 2006-01-10 [2007-04-08]. (原始内容存档于2010-01-23).
- ^ National Institute of Standards and Technology. Radionuclide Half-Life Measurements. [2011-11-07]. (原始内容存档于2016-08-12).
- ^ Radioisotope Brief: Cesium-137 (Cs-137). [2013-10-25]. (原始内容存档于2016-03-29).
- ^ 100.0 100.1 The Radiological Accident in Goiânia. IAEA. 1988 [2013-09-18]. (原始内容存档于2011-01-20).
- ^ 101.0 101.1 101.2 101.3 Pyykkö, Pekka. A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions. Physical Chemistry Chemical Physics. 2011, 13 (1): 161–8. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/c0cp01575j.
- ^ 102.0 102.1 102.2 Seaborg, G. T. transuranium element (chemical element). Encyclopædia Britannica. ca. 2006 [2010-03-16]. (原始内容存档于2010-11-30).
- ^ 103.0 103.1 103.2 Dietzel, P. D.; Kremer, R. K.; Jansen, M. Superoxide compounds of the large pseudo-alkali-metal ions tetramethylammonium, -phosphonium, and -arsonium.. Chemistry: An Asian Journal. 8 January 2007, 2 (1): 66–75. PMID 17441140. doi:10.1002/asia.200600306.
- ^ Emsley, J. The Elements. Oxford: Clarendon Press. 1989: 22–23.
- ^ Chemical Bonding, Mark J. Winter, Oxford University Press, 1994, ISBN 978-0-19-855694-7
- ^ 106.0 106.1 106.2 106.3 106.4 Cronyn, Marshall W. The Proper Place for Hydrogen in the Periodic Table (PDF). Journal of Chemical Education. 2003年8月, 80 (8): 947–951 [2013-09-19]. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947. (原始内容存档 (PDF)于2013-06-02).
- ^ Wigner, E.; Huntington, H.B. On the possibility of a metallic modification of hydrogen. Journal of Chemical Physics. 1935, 3 (12): 764. Bibcode:1935JChPh...3..764W. doi:10.1063/1.1749590.
- ^ Nellis, W. J.; Weir, S. T.; Mitchell, A. C. Metallization of fluid hydrogen at 140 GPa (1.4 Mbar) by shock compression. Shock Waves. 1999, 9 (5): 301–305 [2020-09-09]. Bibcode:1999ShWav...9..301N. doi:10.1007/s001930050189. (原始内容存档于2020-08-18).
- ^ Cousins, David M.; Davidson, Matthew G.; García-Vivó, Daniel. Unprecedented participation of a four-coordinate hydrogen atom in the cubane core of lithium and sodium phenolates. Chem. Commun. 2013, 49 (100): 11809–11811 [7 August 2014]. PMID 24217230. doi:10.1039/c3cc47393g
 . (原始内容存档于2020-07-29).
. (原始内容存档于2020-07-29). - ^ Mark R. Leach. 2002 Inorganic Chemist's Periodic Table. [2012-10-16]. (原始内容存档于2013-03-09).
- ^ Holleman, Arnold Frederik; Wiberg, Egon, Wiberg, Nils , 编, Inorganic Chemistry, 由Eagleson, Mary; Brewer, William翻译, San Diego/Berlin: Academic Press/De Gruyter, 2001, ISBN 0-12-352651-5
- ^ 112.0 112.1 112.2 Stevenson, D. J. Does metallic ammonium exist?. 自然 (Nature Publishing Group). 1975-11-20, 258 (5532): 222–223 [2012-01-13]. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0. (原始内容存档于2014-11-04).
- ^ 113.0 113.1 Bernal, M. J. M.; Massey, H. S. W. Metallic Ammonium (PDF). Monthly Notices of the Royal Astronomical Society (Wiley-Blackwell for the Royal Astronomical Society). 1954-02-03, 114: 172–179 [2020-09-15]. Bibcode:1954MNRAS.114..172B. (原始内容存档 (PDF)于2018-01-12).
- ^ Solubility Rules!. chem.sc.edu. [2020-07-11]. (原始内容存档于2015-07-13).
- ^ Connelly, Neil G.; Geiger, William E. Chemical Redox Agents for Organometallic Chemistry. Chemical Reviews. 1996, 96 (2): 877–910. PMID 11848774.
















