立体障害
 ウィキペディアから無料の百科事典
ウィキペディアから無料の百科事典

立体障害(りったいしょうがい, steric hindrance)とは、置換基がある空間を占めることでその反応性を低下させるような立体効果である[1]。 立体障害は化学では非常に大きな意味を持ち、(有機化学の試験で基質の反応性が違う理由の多くは立体障害、ほかには電子状態、溶媒効果、各種相互作用など)非常に重要である。一般の置換反応や付加反応における分子の反応中心への接近、LDAに代表される求核剤と塩基、アトロプ異性などのような結合周りの回転の制限や、不安定化合物の安定化、不斉合成における配位子設計など多くの場面に関わっている。
立体障害の大きな置換基としてはイソプロピル基、tert-ブチル基、メシチル基などが挙げられる。分子模型としてよく用いられている球棒モデル(原子を表す球と原子間の結合を表す棒からなる模型、右図右)ではあまり実感がわかないが、CPKモデル(右図左)を用いると立体障害がいかに大きな意味を持つかがよく分かる。
E2反応
[編集]
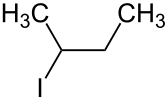
立体障害は脱離反応の生成物の割合に関係する。Zaitsev則を用いることで簡便に脱離の主生成物を推測できるが、これは必ずしも正しい結果を与えるとは限らない。tert-ブタノール下で2-ブロモ-2-メチルブタンとtert-ブトキシドイオンを反応させると、2-メチル-2-ブテンと2-メチル-1-ブテン(右画像上)を得られる。 安定性は前者の方が良いが、この反応における主生成物は2-メチル-1-ブテンである。これは、2-メチル-2-ブテンがかさ高く、引き抜かれる水素が接近しにくい位置にあることと、求核剤のtert-ブトキシドイオンもかさ高いことが理由である[2]。このように、ハロゲン化アルキルがかさ高く、かつ塩基のほうも充分かさ高い場合は不安定な化合物が主に得られる。言い換えると、より不安定な化合物が主生成物として現れるには多くの立体障害を要する[2]。実際に、反応物として2-ブロモ-2-メチルブタンではなく、2-ヨードブタン(右画像下)を用いるとZaitsev則通り、2-ブテンが主生成物、1-ブテンが副生成物として得られる。
SN2反応
[編集]その立体障害性から、一般的にハロゲン化メチル、第一級ハロゲン化アルキル、第二級ハロゲン化アルキル、第三級ハロゲン化アルキル、の順でSN2反応性が低くなっていく。ただし、SN2反応性は中心炭素のアルキル基の数だけはなく、そのサイズにも左右される。例えば、ブロモエタンと1-ブロモプロパンはいずれも第一級ハロゲン化アルキルであるが、比較すると置換基の大きい前者の方がSN2反応性は2倍高い。これは、1-ブロモプロパンのプロピル基が求核攻撃を受ける際に背面攻撃に対してより大きい立体障害を生じるからである[1]。
関連項目
[編集]脚注
[編集]出典
[編集]- ^ a b “9章1節 SN2反応の機構”. ブルース有機化学. 上 (7 ed.). 化学同人. (2014年11月30日). p. 467. ISBN 978-4-7598-1584-9. OCLC 939460827
- ^ a b c d “10章2節 E2反応は位置選択的である”. ブルース有機化学. 上 (7 ed.). 化学同人. (2014年11月30日). p. 514. ISBN 978-4-7598-1584-9. OCLC 939460827