Zeeman-effekt

Zeeman-effekten består i en oppsplitting av spektrallinjene fra et atom når det plasseres i et magnetfelt. Den skyldes vekselvirkningen av dette feltet med det magnetiske momentet til elektronene i atomet. I et elektrisk felt vil spektrallinjene splittes på en tilsvarende måte ved Stark-effekten.
Effekten ble først påvist i 1896 av den nederlandske fysiker Pieter Zeeman og gitt en teoretisk forklaring av hans landsmann Hendrik Antoon Lorentz kort tid etterpå. Han forutsa at hver linje kunne splittes opp i to eller maksimalt tre nye linjer. Begge mottok i 1902 Nobelprisen i fysikk for oppdagelsen.
Mer nøyaktige eksperiment viste snart at den magnetiske oppsplittingen av spektrallinjene var mer komplisert enn hva Lorentz' klassiske teori kunne forklare. Den kan kun benyttes for det som senere omtales som den normale Zeeman-effekten. Mer vanlig er den anomale Zeeman-effekten hvor en spektrallinje splittes opp i et tilsynelatende vilkårlig antall komponenter. Dette fenomenet fikk først en forklaring med etableringen av kvantemekanikken som ga en enhetlig beskrivelse av hvordan et atom påvirkes av et magnetfelt.
Zeeman-effekten var viktig i etableringen av moderne atomfysikk og spesielt for forståelsen av kvantemekanisk spinn. I dag har den en sentral rolle i spektroskopi og danner grunnlaget for kjernemagnetisk resonans som blant annet benyttes ved MR for diagnose av forskjellige sykdommer.
Oppdagelse og første forklaring
[rediger | rediger kilde]Pieter Zeeman arbeidet ved Universitetet i Leiden hvor han undersøkte hvordan lys kunne påvirkes av et ytre magnetfelt. I september 1896 oppdaget han at når lyset fra en flamme som inneholder natrium går gjennom et magnetfelt og analyseres med et spektrometer, vil de to dominerende, gule D-linjene bli bredere. Magneten han brukte, var ikke kraftig nok til å vise en oppsplitting.[1]
I slutten av oktober samme år offentliggjorde han oppdagelsen og bare et par dager senere hadde hans kollega Hendrik Antoon Lorentz en teoretisk forklaring. Han tenkte seg at et atom inneholdt elektrisk ladete partikler som tilsvarer ionene som var tidligere observert i elektrolyse. En spektrallinje med vinkelfrekvens ω0 vil da oppstå ved at en slik partikkel oscillerer med denne frekvensen.[2] Har den hastigheten v, vil denne bevegelsen i et ytre magnetfelt B bli påvirket av Lorentz-kraften e v×B der e er partiklene elektriske ladning. Har den i tillegg en masse m, sier Newtons andre lov at partikkelen er beskrevet ved bevegelsesligningen
hvor vektoren r = (x, y, z) angir dens posisjon slik at hastigheten er gitt som den deriverte v = d r/dt. Definerer man retningen til B som z-aksen, vil svingningene i denne retningen ikke påvirkes av feltet. I de to retningen vinkelrett til dette, er da bevegelsen beskrevet ved de to koblede differensialligningene
De kan løses ved å anta at den nye bevegelsen er en ny oscillasjon x = cosωt sammen med y = sinωt hvor ω er en modifisert frekvens.Ved innsettelse i ligningene følger da at
hvor ωL = eB/2m er Larmor-frekvensen. Da amplitudene til oscillasjonene i x- og y-retning må være like store, vil partikkelens bevegelse tilsvare en rotasjon om magnetfeltet med vinkelfrekvensen ω. Er denne negativ, vil det bare bety at rotasjonen foregår i den andre retningen slik at det utsendte lyset får motsatt polarisasjon. Man kan derfor i praksis regne med bare positive frekvenser. Hvis man i tillegg benytter at den indre kraften i atomet representert ved ω0 må være mye større enn den magnetiske kraften uttrykt ved ωL, vil det utsendte lyset fra atomet i magnetfeltet opptre med de to frekvensene
skapt av den sirkulære bevegelsen i xy-planet, sammen med frekvensen ω0 generert av den uforstyrrete oscillasjonen i z-retning.
Egenskaper
[rediger | rediger kilde]
Fra denne modellen til Lorentz følger det derfor at man i allminnelighet skal se tre spektrallinjer i Zeeman-effekten. Den ene linjen har den opprinnelige frekvensen ω0 og vil være «lineært polarisert» da den er skapt av en oscillasjon langs z-aksen. De to andre linjene har frekvenser som ligger like over og under denne i en avstand gitt ved Larmor-frekvensen ωL. Avhengig av hvordan lyset fra atomet blir observert relativt til retningen til B-feltet, vil disse to linjene vanligvis være «elliptisk polarisert». Men analyseres lyset langs feltretningen, vil det være «sirkulært polarisert». I denne retningen vil det ikke sendes noe lys fra svingningene i z-retning slik at bare disse to linjene kan observeres.[2]
Ved bruk av kraftigere magnetfelt kunne Zeeman noen få uker senere påvise at lyset fra de bredere D-linjene i natrium ble polarisert på denne måten. Han anså dermed teorien til Lorentz som bekreftet.[3] I samme publikasjon oppgir han også verdien han hadde funnet for forholdet e/m. Siden størrelsen av elementærladningen e var godt kjent fra elektrolyse, kunne den ha blitt brukt til å bestemme massen m til partikkelen som utførte oscillasjonene i atomet. Han ville da ha funnet ut at den var mye mindre enn massen til et typisk ion. På den måten hadde Zeeman og Lorentz vært de aller første til å oppdage elektronet.
Året etter observerte Zeeman at en spektrallinje i kadmium ble splittet i tre separate linjer akkurat som Lorentz hadde forutsagt. Denne observasjonen gjorde det også mulig å bestemme fortegnet til ladningen e som ble funnet å være negativ. Dette skjedde samme år som J. J. Thomson påviste frie elektroner i katodestråling.[1]
Etter at oppdagelsen til Zeeman var blitt kjent i 1897, ble det utført lignende målinger i mange andre laboratorier. Det ble snart klart at oppsplittingen av spektrallinjer i allminnelighet var mer komplisert enn hva som kunne forklares med teorien til Lorentz. Med bedre spektral oppløsning viste D1-linjen fra natrium å inneholde fire komponenter, mens den nærliggende D2-linjen ble splittet opp i seks linjer. Snart ble slike observasjoner omtalt som eksempel på anomal Zeeman-effekt. Utforskningen av denne kom til å bli av stor interesse i årene som fulgte.
Normal Zeeman-effekt
[rediger | rediger kilde]Selv om Lorentz hadde basert sin forklaring av Zeeman-effekten på feilaktige antagelser om atomet, viste det seg at hans resultat for oppsplitting av spektrallinjene også fulgte fra Bohrs atommodell og dens utvidelse med Bohr-Sommerfeld-kvantisering. I denne beskrivelsen går elektronene rundt en atomkjerne i bestemte baner med kvantiserte verdier for energien. Lys i form av fotoner sendes ut ved overgang fra en slik stabil bane til en annen med lavere energi. Frekvensen til lyset er ikke direkte relatert til omløpsfrekvens til elektronet i sin bane, men gitt ved differansen i energi mellom de to banene før og etter kvantespranget.
I Bohrs modell har elektronet i en bestemt bane en dreieimpuls L som er kvantisert med verdier L = ℓħ hvor ħ er den reduserte Planck-konstanten. Det asimutale kvantetallet kan ifølge mer moderne kvantemekanikk ha verdier ℓ = 0, 1, 2, ... opp til en maksimalt ℓmax = n - 1 der n er hovedkvantetallet. Det bestemmer størrelsen til banen og dermed energien til elektronet. Dreieimpulsen L står normalt til baneplanet og har en retning som er gitt ved projeksjonen Lz på en vilkårlig z-akse. Denne er også kvantitert med mulige verdier Lz = m ħ hvor det magnetiske kvantetallet m tar de 2ℓ + 1 forskjellige verdiene m = - ℓ, - ℓ + 1,..., - 1, 0, + 1, ... , ℓ - 1, ℓ. Dette omtales ofte som «romlig kvantisering» av atomets bevegelse.[4]
Magnetisk moment
[rediger | rediger kilde]
Hvis elektronet har elektrisk ladning q = - e og masse me, vil den kvantiserte dreieimpulsen L medfører at det har et magnetisk moment
som også er kvantisert. Plasseres atomet nå i et forholdsvis svakt magnetfelt B, vil hvert elektron få en tilleggsenergi
Ved å velge B-feltet langs z-aksen i rommet, vil dermed energien til elektronet forandres med en størrelse
hvor ωL = eB/2me igjen er Larmor-frekvensen til elektronet. Det betyr at det opprinnelige energinivået til elektronet splittes opp i 2ℓ + 1 undernivå avhengig av det magnetiske kvantetallet m og vil på den måten utgjøre en «multiplett». Avstanden mellom to nabonivå i multipletten er ħωL og er derfor den samme for alle spektrallinjer som viser en normal Zeeman-effekt, uavhengig av det asimutale kvantetallet ℓ.
Frekvensforskyvning
[rediger | rediger kilde]Ved en overgang av elektronet fra en bane med energi E til en lavere bane med energi E' , vil atomet sende ut lys med vinkelfrekvens bestemt av Bohr-betingelsen ħω = E - E'. I et magnetfelt vil begge disse energinivåene splittes opp slik at den opprinnelige spektrallinjen også splittes opp med en frekvensforskyvning
hvor Δm = m - m' er forandringen i det magnetiske kvantetallet ved overgangen. Dette kunne i utgangspunktet resultere i et stort antall nye linjer. Men Bohr kunne benytte sitt korrespondanseprinsipp til å vise at de dominerende overgangene måtte oppfylle utvalgsregelen Δm = 0, ±1. Dermed kan en spektrallinje splittes opp i maksimalt tre nye linjer. To av dem er på hver side av den opprinnelige linjen med en forskyvning ωL fra denne. Overganger med Δm = 0 gir lineært polarisert lys, mens de med Δm = ±1 skaper sirkulært polarisert lys langs B-feltet.
Denne forklaringen av Zeeman-effekten ble presentert av Arnold Sommerfeld og Peter Debye i 1916. Plancks konstant som karakteriserer en kvantemekanisk beregning, er forsvunnet fra resultatet. Det er i nøyaktig overensstemmelse med hva Lorentz hadde funnet nesten tyve år tidligere for den normale Zeeman-effekten basert på klassisk fysikk.
Anomal Zeeman-effekt
[rediger | rediger kilde]Den magnetiske oppsplittingen av de fleste spektrallinjene kunne ikke forklares ved den enkle modellen til Lorentz eller variasjoner av denne. Men det ble tidlig klart at det også her fantes klare regelmessigheter. Den irske fysiker Thomas Preston utførte meget nøyaktige målinger av denne anomale effekten omtrent samtidig med Zeeman og viste at den er likedan i tilsvarende linjer som tilhører samme spektralserie. Likedan arter den seg på lignende måte i atomer som ligger i samme kolonne i det periodiske systemet. Et eksempel på slike grunnstoff er alkalimetallene som litium, natrium, kalium og cesium.
I de forskjellige seriene med spektrallinjer kunne forskjellige linjer med nesten samme bølgelengde organiseres i «multipletter». Mens alkalimetallene oppviste bare dubletter bestående av to nærliggende linjer D1 og D2 i natrium, fantes det både tripletter og kvartetter av linjer i de fleste andre atom. Enkelte linjer fra noen atom kunne klassifiseres som singletter, og det var bare de som viste en normal Zeeman-effekt i et ytre magnetfelt.
Eksperimentelle arbeid av Friedrich Paschen på begynnelsen av 1900-tallet viste nye lovmessigheter. Sammen med matematikeren Carl Runge kunne disse resultatene i 1907 sammenfattes i den enkle loven
for frekvensforskyvningen. Her er r og s heltall med r definert som alltid positiv. Denne kompakte sammenfatningen av frekvensforskyvingen i den anomale Zeeman-effekten er kjent som Runges lov. Den gjelder også for den normale effekten. Da er r = 1 og s = 0, ± 1 som beskriver de tre komponentene til Lorentz. For dubletter er r alltid et oddetall, mens for singletter og tripletter er denne nevneren alltid et liketall. For D1-linjen er r = 3 og s = ± 2, ± 4 som tilsvarer en oppsplitting i fire komponenter. På samme måte splittes D2-linjen opp i seks komponenter med r = 3 og s = ± 1, ± 3 og ± 5.[5]
Landés g-faktor
[rediger | rediger kilde]Den anomale Zeeman-effekten ble først fullstendig forstått ved innføring av kvantemekanisk spinn for elektronet i 1925. Denne utviklingen begynte i 1921 ved at Alfred Landé viste ut fra eksperimentelle data at de magnetiske forskyvningene av energinivåene for slike atom kan sammenfattes i formelen
hvor g er et rasjonalt tall som kalles Landés g-faktor. For det normale Zeeman-effekten er g = 1. Videre er m igjen et magnetisk kvantetall, men det kan i mange tilfelle også ta halvtallige verdier. Det skyldes at elektronet har spinn s = 1/2.
Ved en overgang av atomet fra en tilstand med energi E til en annen tilstanden med lavere energi E' , vil det utsendte lyset i et ytre magnetfelt dermed få en frekvensforskyvning gitt ved ħΔω = EB - EB' eller
Her er g' Landés faktor for tilstanden av atomet med energi E' . Det magnetiske kvantetallet for denne sluttilstanden er m' og må igjen oppfylle utvalgsregelen Δm = m - m' = 0, ± 1 som for den normale Zeeman-effekten.[6]
To år senere i 1923 kunne Landé presentere en formel for g-faktoren ut fra kjennskap til kvantetallene han brukte for hvert energinivå. Uttrykt ved dagens kvantetall skrives den som
hvor ℓ = 0, 1, 2, ... er kvantetallet for orbital dreieimpuls L, mens s = 1/2 er kvantetallet for elektronets spinn S. Kvantetallet j = ℓ ± 1/2 angir størrelsen til den totale dreieimpulsen J = L + S med en kvantiseret z-komponent som er det magnetiske kvantetallet m. Det kan ta 2j + 1 forskjellige verdier som varierer i like stepp med lengde 1 fra - j til + j.
Hvis elektronet er i en s-tilstand karakterisert med ℓ = 0, vil kvantetallet j = 1/2. Selv om atomet derfor ikke har noen orbital dreieimpuls, har det likevel en total dreieimpuls og en tilsvarende g-faktor med verdien g = 2. Den skyldes ene og alene spinnet til elektronet som ikke kan forklares på en klassisk måte som rotasjon av en liten kule.
Allerede noen få år tidligere var denne verdien for g-faktoren blitt antydet i Einstein-de Haas-eksperimentet. På samme tid hadde også Stern-Gerlach-eksperimentet vist at elektronet hadde en romlig kvantisering i kun to retninger og derfor spinn 1/2. Men det var først de detaljerte undersøkelsene av den anomale Zeeman-effekten som beviste at denne egenskapen ved elektronet var riktig.[1] Spinnet gir et ekstra bidrag til elektronets energi i et ytre magnetfelt som nå kan skrives som
hvor den ekstra faktoren ge = 2 foran S er elektronets g-faktor. Det er denne vekselvirkningen som ligger til grunn for den moderne utregningen av Landés g-faktor.
For et atom hvor en spektrallinje kommer frem ved et samspill mellom flere elektroner, kan Zeeman-effekten beskrives på samme måte. Den eneste forskjellen er at kvantetallene ℓ, s og j for et elektron, må erstattes med de tilsvarende kvantetallene L, S og J som angir henholdsvis den totale, orbital dreieimpulsen L = ∑Li til elektronene, deres totale spinn S = ∑Si og deres totale dreieimpuls J = L + S.[6]
D-linjen i natrium
[rediger | rediger kilde]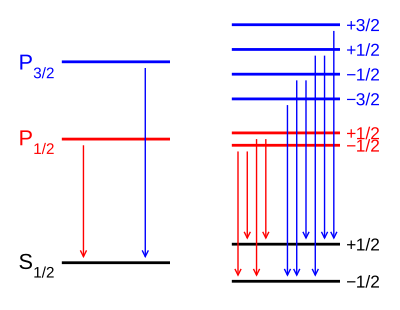
Den gule D-linjen i natrium fremkommer ved en overgang til en s-tilstand (ℓ = 0) fra en p-tilstand (ℓ = 1). Denne er splittet i to nærliggende nivå P1/2 og P3/2 på grunn av spinn-banekobling hvor indeksene angir kvantetallet j = 1/2 og 3/2. D1-linjen tilsvarer overganger fra P1/2 til grunntilstanden S1/2, mens D2-linjen skyldes overganger fra P3/2.
I et ytre magnetfelt vil grunntilstanden splittes i to, hver med g = 2 da den har ℓ = 0. På samme måte vil P1/2 med ℓ = 1 splittes i to, men med en g-faktor
Det øvre nivået P3/2 vil splittes i 2j + 1 = 4 undernivå med g-faktor
Med utvalgsregelen Δm = 0, ± 1 følger herav at D1-linjen vil splittes opp i fire komponenter og D2-linjen i seks. Størrelsen til de forskjellige frekvensforskyvningene kommer ut nøyaktig slik som observert mange år tidligere og sammenfattet i Runges lov.
Paschen-Back-effekt
[rediger | rediger kilde]Zeeman-effekten blir observert når det ytre magnetfelt har en moderat styrke. Det må ikke overstige det indre magnetfeltet i atomet som skyldes elektronenes bevegelse og gir opphav til spinn-banekoblingen. Men når dette skjer, forandres den anomale splittingen av spektrallinjene til et enklere mønster som består i en normal oppsplitting i kun tre komponenter som i den normale eller klassiske Zeeman-effekten. Denne oppdagelsen kalles nå Paschen-Back-effekten etter de to oppdagerne.[6]
Når spinn-banekoblingen kan neglisjeres i forhold til koblingen av elektronenes spinn til det ytre magnetfeltet, er ikke lenger det totale spinnet J = L + S en bevart størrelse som kan brukes til å klassifisere kvantetilstandene til atomet. De er derimot gitt ved egentilstandene for L og S hver for seg, karakterisert med kvantetallene ℓ og s = 1/2, med verdiene mℓ = -ℓ, ℓ + 1, ... , 0, +1, .. ℓ-1, ℓ og ms = ±1/2 for Lz og Sz i enheter av den reduserte Planck-konstanten ħ. Med B-feltet langs z-aksen, kan derfor forskyvningen av energinivåene til elektronet i atomet finnes direkte fra
når man uttrykker denne energien ved hjelp av en Bohr-magneton μB = eħ/2me.
På samme måte som for Zeeman-effekten vil denne energiforskyvningen også resultere i en forskyvning Δω av frekvensen til lyset som blir utsendt ved en kvanteovergang. Den kan nå skrives som
hvor Δmℓ = mℓ - m 'ℓ og Δms = ms - m's er forskjellene i kvantetallene ved overgangen. Men da dette lyset genereres ved en elektrisk dipolovergang, forandres ikke spinnet til elektronet slik at Δms = 0. Med den vanlige utvalgsregelen Δmℓ = 0, ±1 oppstår det derfor bare tre linjer ved Paschen-Back-effekten nøyaktig som ved den normale Zeeman-effekten. For atomer med flere elektroner finner man samme resultat ut fra en tilsvarende argumentasjon.
Spinn-banekoblingen gir i dette tilfellet en liten effekt sammenlignet med oppsplittingen som det ytre magnetfeltet skaper. Men den opptrer som en «perturbasjon» som gir en videre finstruktur i de tre hovedlinjene som feltet skaper.
Forklaringen av Paschen-Back-effekten spilte en viktig rolle for Wolfgang Pauli da han formulerte sitt eksklusjonsprinsipp i 1924. Sammen med egenskapene til den anomale Zeeman-effekten kunne ikke disse observasjonene forklares uten at elektronet ble gitt et nytt kvantetall som beskriver dets spinn. Hans fundamentale prinsipp sier at for enhver tillatt tilstand må alle kvantetallene være forskjellige.
Se også
[rediger | rediger kilde]Referanser
[rediger | rediger kilde]- ^ a b c A. Pais, Inward Bound: Of Matter and Forces in the Physical World, Clarendon Press, Oxford (1986). ISBN 0-19-851971-0.
- ^ a b A.J. Kox, The discovery of the electron: II. The Zeeman effect, Eur. J. Phys. 18, 139–144 (1997).
- ^ P. Zeeman, The Effect of Magnetisation on the Nature of Light Emitted by a Substance, Nature 55, 346 (1897).
- ^ M. Born, Atomic Physics, Blackie & Son Limited, Glasgow (1962).
- ^ A. Sommerfeld, Atombau und Spektrallinien, Fried. Wieweg & Sohn, Braunschweig (1919).
- ^ a b c H. Haken and H.C. Wolf, Atomic and Quantum Physics, Springer-Verlag, Berlin (1987). ISBN 0-387-17702-7.
Litteratur
[rediger | rediger kilde]- P.C. Hemmer, Kvantefysikk, Tapir akademisk forlag, Trondheim (2000). ISBN 82-519-1564-3.
- J.J. Brehm and W.J. Mullin, Introduction to the Structure of Matter, John Wiley & Sons, New York (1989). ISBN 0-471-61273-1.
Eksterne lenker
[rediger | rediger kilde]- HyperPhysics, The Sodium Doublet
















