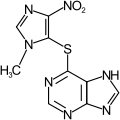
Azatiopryna

| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C9H7N7O2S | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 277,26 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Wygląd | jasnożółty proszek[1] | ||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||
| Numer CAS | 446-86-6 | ||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||||||||
| Stosowanie w ciąży | kategoria D | ||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||

Azatiopryna (łac. azathioprinum) – organiczny związek chemiczny, antymetabolit, lek o silnym działaniu immunosupresyjnym i cytotoksycznym, który jest metylonitroimidazolową pochodną 6-merkaptopuryny. Po podaniu ulega biotransformacji w wątrobie i nerkach do 6-merkaptopuryny i metylonitroimidazolu. Końcowym metabolitem jest kwas tiomoczowy, który ulega wydaleniu z moczem. W Polsce azatiopryna jako lek jest dostępna pod nazwą handlową Imuran i Azathioprine, w postaci niewielkich żółtych lub koloru morelowego, obustronnie wypukłych tabletek z otoczką. Bywa też podawana dożylnie.
Historia
[edytuj | edytuj kod]Azatiopryna została po raz pierwszy wprowadzona do praktyki klinicznej przez sir Roya Calne’a, pioniera brytyjskiej transplantologii. Opierając się na pracy sir Petera Medewara dotyczącej immunologicznych przyczyn odrzucania przeszczepu, zaproponował wprowadzenie 6-merkaptopuryny jako leku immunosupresyjnego przy przeszczepieniu nerki. Odkryta potem azatiopryna zastąpiła 6-merkaptopurynę dzięki swojej mniejszej toksyczności. Przez lata terapia azatiopryną w połączeniu z glikokortykosteroidami była standardem w zapobieganiu odrzucania przeszczepu. W 1978 roku została zastąpiona cyklosporyną, również wprowadzoną przez Calne’a.
Mechanizm działania
[edytuj | edytuj kod]Blokuje poprzez alkilację grupy sulfhydrylowe, a dzięki uwalnianiu 6-merkaptopuryny działa jak antymetabolit dla zasad purynowych (powoduje zaburzenie syntezy DNA) w limfocytach stymulowanych antygenem. Lek działa przede wszystkim na komórki dzielące się. Azatiopryna hamuje proliferację limfocytów T oraz w mniejszym stopniu także limfocytów B.
Obecnie nieznana jest aktywność i farmakodynamika metylonitroimidazolu u ludzi (przeprowadzono szczątkowe badania na szczurach)[6]. Przypuszcza się, że może on w pewien sposób wpływać na metabolizm i LADME powstającej 6-merkaptopuryny w porównaniu z klinicznie czystą 6-merkaptopuryną. Z badań medycznych wynika, że obecność komponenty metylonitroimidazolowej jest odpowiedzialna za dodatkową szkodliwość azatiopryny (włącznie ze znacznym zwiększeniem ryzyka raka skóry po ekspozycji na światło słoneczne) nawet w porównaniu z pochodnymi merkaptopuryny pozbawionymi podstawnika nitrowego, który wydaje się mieć kluczową rolę w jej zwiększeniu (sugerując się metabolizmem większości związków nitrowych, można podejrzewać, że metylonitroimidazol – powstały w organizmie z azatiopryny – jest w stanie spowodować znaczne namnażanie wolnych rodników, których szkodliwe działanie jest znane nawet wśród laików)[7].
Wskazania
[edytuj | edytuj kod]Azatioprynę stosuje się obecnie w zapobieganiu reakcji odrzucania przeszczepów i w leczeniu chorób autoimmunologicznych. Najczęstsze zastosowania leku to:
- transplantologia – w celu zapobiegania odrzucaniu przeszczepu
- reumatoidalne zapalenie stawów
- toczeń rumieniowaty układowy
- zapalenie skórno-mięśniowe
- zapalenie wielomięśniowe
- guzkowe zapalenie tętnic
- pęcherzyca zwyczajna
- autoimmunologiczna niedokrwistość hemolityczna
- plamica małopłytkowa
- autoimmunologiczne zapalenie wątroby
- wrzodziejące zapalenie jelita grubego
- Choroba Crohna
- zespół nerczycowy
- stwardnienie rozsiane
- kłębuszkowe zapalenie nerek.
- autoimmunologiczne zapalenie wątroby.
Przeciwwskazania
[edytuj | edytuj kod]Nie wolno stosować w następujących przypadkach:
- nadwrażliwość na lek
- u osób z niedoborem fosforybozylotransferazy hipoksantynowo-guaninowej
- u osób z niedoborem metylotransferazy tiopurynowej
Ostrożnie:
- osoby w podeszłym wieku
- upośledzona czynność wątroby lub nerek.
Działania niepożądane
[edytuj | edytuj kod]Azatiopryna jest hepatotoksyczna u ludzi i zwierząt, a także wykazuje właściwości mutagenne, co zostało wykazane w różnych badaniach medycznych[8][9].
Potencjał mutagenny azatiopryny jest wyższy niż w przypadku podobnych immunosupresantów; najprawdopodobniej przyczyną jest obecność grupy nitrowej, która w organizmie podlega przemianom metabolicznym (głównie redukcji) prowadzącym do nienormalnego podwyższenia liczebności wolnych rodników (m.in. ponadtlenkowych), a w następstwie do zjawiska stresu oksydacyjnego (także wraz z następującym poń uszkodzeniami mitochondrialnymi) zwłaszcza w tkankach najsilniej metabolizujących[10]. Notowano też obniżenie stężenia glutationu w wątrobie, co także można wytłumaczyć metabolizmem komponenty metylonitroimidazolowej.
Podczas przyjmowania leku należy unikać światła słonecznego, które może indukować raka skóry w wyniku fotosensybilacji azatiopryny[7]. Światło ultrafioletowe prowadzi do rozkładu azatiopryny połączonego z powstawaniem wolnych rodników[11].
Zaobserwowane niepożądane działania azatiopryny:
- upośledzenie/hamowanie czynności szpiku kostnego (działanie mielosupresyjne):
- granulocytopenia, rzadko agranulocytoza
- leukopenia
- małopłytkowość
- niedokrwistość
- rzadko: pancytopenia
- zwiększona podatność na zakażenia
- zaburzenia czynności wątroby (sama azatiopryna, jak i jej metabolity mogą wykazywać hepatotoksyczność – donoszono o rzadkich przypadkach zwłóknienia miąższu wątroby oraz zarastania naczyń wątrobowych, przy czym niektóre z tych zmian były odwracalne)
- zapalenie trzustki
- wypadanie włosów (aż do ich całkowitej utraty)
- złe samopoczucie
- zawroty głowy
- gorączka
- dreszcze
- biegunka
- bóle mięśni i stawów
- zaburzenia rytmu serca
- świąd skóry
- osutka
- zapalenie naczyń
- zaburzenia czynności nerek
- spadek ciśnienia tętniczego
- cholestaza
- nudności, wymioty
- jadłowstręt
- śródmiąższowe zapalenie płuc – bardzo rzadko.
U osób po przeszczepieniu narządów leczonych azatiopryną występuje zwiększona częstość zachorowań na choroby nowotworowe, a w przypadku łączenia dużych dawek azatiopryny z infliksymabem, także na wysoce zjadliwą odmianę skrajnie niebezpiecznego chłoniaka T-komórkowego.
Ryzyko takie wzrasta przy jednoczesnym stosowaniu kilku immunosupresantów naraz, co należy mieć na uwadze w przypadku podejmowania decyzji o rozpoczęciu takiej terapii.
Interakcje
[edytuj | edytuj kod]- pochodne kwasu aminosalicylowego (np. 5-ASA, olsalazyna, sulfasalazyna) hamują czynność metylotransferazy tiopurynowej, co powinno się wziąć pod uwagę w razie terapii skojarzonej (np. w autoimmunologicznych chorobach zapalnych jelit)
- zdecydowanie zaleca się unikać jakichkolwiek dawek alkoholu ze względu na skumulowanie efektu hepatotoksycznego
- łączenie z innymi immunosupresantami (glikokortykosterydami, cyklosporyną, infliksymabem) wiąże się z możliwością nadmiernego hamowania funkcji układu odpornościowego lub szpiku kostnego
- w testach in vitro furosemid zaburzał metabolizm azatiopryny w tkance wątrobowej, znaczenie kliniczne tej interakcji nie zostało jeszcze wyjaśnione.
Preparaty
[edytuj | edytuj kod]- Azathioprine
- Imuran
Przypisy
[edytuj | edytuj kod]- ↑ a b c d Farmakopea Polska VI, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2002, s. 1176, ISBN 83-88157-18-3.
- ↑ Azathioprine, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2012-02-21] (ang.).
- ↑ Azathioprine, [w:] DrugBank [online], University of Alberta, DB00993 (ang.).
- ↑ Department of Chemistry, The University of Akron: Azathioprine. [dostęp 2012-02-21]. (ang.).
- ↑ Azathioprine, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 103837 [dostęp 2011-03-16] (niem. • ang.).
- ↑ THE METABOLIC FATE OF THE METHYLNITROIMIDAZOLE MOIETY OF AZATHIOPRINE IN THE RAT | Journal of Pharmacology and Experimental Therapeutics [online], jpet.aspetjournals.org [dostęp 2017-11-22] (ang.).
- ↑ a b PHOTOCHEMICAL SENSITIZATION BY AZATHIOPRINE AND ITS METABOLITES. PART 3. A DIRECT EPR AND SPIN-TRAPPING STUDY OF LIGHT-INDUCED FREE RADICALS FROM 6-MERCAPTOPURINE AND ITS OXID...
- ↑ Reduktywna aktywacja nitroheterocyklicznych związków może być przyczyną ich stosunkowo wysokiej mutagenności.
- ↑ Azathioprine Acts upon Rat Hepatocyte Mitochondria and Stress-Activated Protein Kinases Leading to Necrosis: Protective Role of N-Acetyl-L-cysteine | Journal of Pharmacol... [online], jpet.aspetjournals.org [dostęp 2017-11-22] (ang.).
- ↑ Redirecting [online], linkinghub.elsevier.com [dostęp 2017-11-22].
- ↑ Generation of Radical Anions from Metronidazole, Misonidazole and Azathioprine by Photoreduction in the Presence of EDTA: International Journal of Radiation Biology and Relate... [online], informahealthcare.com [dostęp 2017-11-22] (ang.).
Bibliografia
[edytuj | edytuj kod]- Indeks leków Medycyny Praktycznej 2006. Kraków: Wydawnictwo Medycyna Praktyczna, 2006, s. 85. ISBN 83-7430-060-4.