Cancro do endométrio

| Cancro do endométrio | |
|---|---|
| Localização e desenvolvimento do cancro do endométrio. | |
| Sinónimos | Cancro do útero |
| Especialidade | Oncologia, ginecologia |
| Sintomas | Hemorragia vaginal, dor ao urinar ou durante as relações sexuais, dor pélvica[1] |
| Início habitual | Após a menopausa[2] |
| Fatores de risco | Obesidade, exposição excessiva a estrogénio, hipertensão arterial, diabetes, antecedentes familiares[1][3] |
| Método de diagnóstico | Biópsia[1] |
| Tratamento | Histerectomia abdominal, radioterapia, quimioterapia, terapia hormonal[4] |
| Prognóstico | Sobrevivência a 5 anos ~80% (EUA)[5] |
| Frequência | 3,8 milhões (2015)[6] |
| Mortes | 89 900 (2015)[7] |
| Classificação e recursos externos | |
| CID-10 | C54.1 |
| CID-9 | 182.0 |
| OMIM | 608089 |
| DiseasesDB | 4252 |
| MedlinePlus | 000910 |
| eMedicine | med/674 radio/253 |
| MeSH | D016889 |
Cancro do endométrio (português europeu) ou câncer endometrial (português brasileiro) é o cancro que tem origem no endométrio, o revestimento do útero.[1] A doença é o resultado do crescimento anormal de células com a capacidade de invadir ou de se alastrar para outras partes do corpo.[8] O primeiro sinal é geralmente uma hemorragia vaginal sem estar associada a um período menstrual; os outros sintomas incluem dor ao urinar ou durante o acto sexual ou dores pélvicas. O cancro do endométrio ocorre com maior frequência depois da menopausa.[2] Este cancro é muitas vezes referido como "cancro do útero", embora seja distinto de outras formas de cancros do útero, como o cancro do colo do útero, sarcoma uterino ou doença trofoblástica.[9]
Cerca de 40% dos casos estão relacionados com a obesidade. A doença está também associada a uma exposição excessiva ao estrogénio, hipertensão e diabetes.[1] Embora a ingestão de estrogénio isoladamente aumente o risco de cancro do endométrio, a ingestão de uma combinação de estrogénio com progesterona, como acontece na maioria das pílulas contraceptivas combinadas, diminui o risco. Entre 2 e 5% dos casos estão relacionados com genes herdados de um dos progenitores.[9] O tipo histopatológico mais comum de cancro do endométrio é o carcinoma endometrioide, que é responsável por mais de 80% dos casos.[3] O diagnóstico é geralmente realizado mediante uma biópsia endometrial ou pela recolha de uma amostra através de um procedimento denominado dilatação e curetagem. O teste de Papanicolau não costuma ser suficiente para confirmar a doença.[4] Não está recomendado o rastreio regular em pessoas de risco normal.[10]
A opção de primeira linha para o tratamento de cancro do endométrio é a histerectomia abdominal, que consiste na cirurgia de remoção integral do útero, a par da remoção das trompas de Falópio e dos ovários de ambos os lados, um procedimento denominado ooforectomia.[4] Em estágios mais avançados pode também ser recomendada a realização de radioterapia, quimioterapia ou terapia hormonal. Quando a doença é diagnosticada nos estágios iniciais, o prognóstico é favorável, com uma taxa de sobrevivência a cinco anos superior a 80%.[5]
Em 2012 houve 320 000 casos de cancro do endométrio que foram responsáveis por 76 000 mortes.[3] A doença é a terceira causa mais comum de morte por cancro entre os cancros que afectam apenas as mulheres, atrás do cancro do ovário e do cancro do colo do útero. É mais comum em países desenvolvidos e é o cancro do sistema reprodutor feminino mais comum entre países desenvolvidos.[4] Entre as décadas de 1980 e 2010, a prevalência de cancro do endométrio aumentou em vários países. Acredita-se que isto seja devido ao aumento do número de idosos e ao aumento da obesidade.[11]
Sinais e sintomas
[editar | editar código-fonte]Em 90% dos casos de cancro do endométrio após a menopausa verifica-se hemorragia vaginal ou metrorragia.[2][13][14] As hemorragias são particularmente comuns nos casos de adenocarcinomas, correndo em dois terços de todos os casos.[2][10] Antes da menopausa, a ocorrência de ciclos menstruais anormais ou extremamente longos e episódios de hemorragia frequentes ou intensos podem ser sinais de cancro do endométrio.[10]
Os restantes sintomas para além da hemorragia são poucos comuns. Entre estes sintomas estão secreções vaginais esbranquiçadas ou translúcidas em mulheres após a menopausa. À medida que a doença avança, os sintomas começam a ser mais perceptíveis ou aparecem sinais que podem ser observados num exame físico. O útero pode aumentar de tamanho ou o cancro alastrar-se, o que provoca dores no baixo abdómen ou cãibras na pelve.[10] A dor durante o ato sexual ou dor ao urinar são sinais pouco comuns.[9] O útero pode também encher-se de pus.[15] Entre as mulheres que manifestam estes sintomas menos comuns (secreções vaginais, dores pélvicas e pus), só 10-15% dos casos é que revelam ser cancro.[16]
Factores de risco
[editar | editar código-fonte]Os factores de risco para cancro do endométrio incluem obesidade, diabetes, cancro da mama, uso de tamoxifeno, nunca ter tido filhos, menopausa tardia, níveis elevados de estrogénio e uma idade avançada.[15][16] Os estudos migratórios revelam a existência de alguns componentes ambientais que influenciam o cancro do endométrio,[17] embora estes factores de risco ambientais ainda não estejam bem caracterizados.[18]
Hormonas
[editar | editar código-fonte]A maior parte dos factores de risco para o cancro do endométrio envolvem níveis elevados de estrogénios. Estima-se que 40% dos casos estejam relacionados com a obesidade.[3] Na obesidade, o excesso de tecido adiposo aumenta a conversão de androstenediona para estrona, que é um estrogénio. A quantidade excessiva de estrona no sangue causa a diminuição ou ausência de ovulação e expõe continuamente o endométrio a grandes quantidades de estrogénios.[11][19] A obesidade também faz com que haja menos estrogénio a ser removido do sangue. O síndrome do ovário policístico, que também causa ovulação irregular ou ausência de ovulação, está associado a uma maior incidência de cancro do endométrio pelo mesmo mecanismo da obesidade.[17] Tanto a obesidade como a diabetes tipo 2 e a resistência à insulina são factores de risco para a doença.[20] Esta condição aumenta em 3 ou 4 vezes o risco de cancro do endométrio.[21]
A terapia de reposição hormonal durante a menopausa, quando não é contrabalançada (ou oposta) com progestina, é outro factor de risco. As doses elevadas ou os períodos prolongados de terapia de estrogénios estão associados a um maior risco de cancro do endométrio.[19] Este risco é maior em mulheres de baixo peso.[3] Outro factor de risco é um período fértil alargado, quer devido a uma menarca precoce quer devido a uma menopausa tardia.[22] Quando não é contrabalançado, o estrogénio aumenta o risco individual de cancro do endométrio entre 2 a 10 vezes, dependendo do peso da mulher e da duração da terapia hormonal. Em transexuais masculinos que tomam testosterona e que não removeram o útero, a conversão de testosterona em estrogénio através da androstenediona pode aumentar o risco de cancro do endométrio.[23]
Genética
[editar | editar código-fonte]
Algumas anomalias genéticas podem também causar cancro do endométrio. As causas genéticas contribuem para 2 a 10% do total de casos da doença.[3][24] A síndrome de Lynch, uma doença genética autossómica dominante que causa principalmente cancro colorretal, pode também causar cancro do endométrio, principalmente antes da menopausa. As mulheres com síndrome de Lynch têm um risco de 40 a 60% de desenvolver cancro do endométrio.[17] 20% destas mulheres desenvolvem simultaneamente cancro do endométrio e cancro do ovário. Em quase todos os casos, o cancro do endométrio desenvolve-se primeiro, em média 11 anos antes.[18] A carcinogénese na síndrome de Lynch tem origem numa mutação dos genes MLH1 e/ou MLH2, os quais são responsáveis pela correcção de erros no ADN. As mulheres com síndrome de Lynch correspondem a entre 2 a 5% dos casos de cancro do endométrio.[21] O risco varia de acordo com o gene mutado. Em mutações do gene MLH1, o risco é de 54%; do gene MSH2 21%; e do gene MSH6, 16%.[25]
As mulheres com historial na família de cancro do endométrio apresentam risco acrescido.[9] Os dois genes frequentemente associados com outros cancros em mulheres, o BRCA1 e o BRCA2, não causam cancro do endométrio. Embora exista uma aparente ligação com estes genes, pode-se atribuir esta ligação ao uso de tamoxifeno nos cancros da mama e do ovário, um fármaco que aumenta o risco de cancro do endométrio.[17] A síndrome de Cowden, uma condição genética hereditária, pode também aumentar o risco de cancro do endométrio. As mulheres com esta condição apresentam um risco de entre 5 a 10% de desenvolver a doença ao longo da vida,[3] em comparação com um risco de 2 a 3% entre mulheres não afectadas.[18]
Descobriu-se também que a variação genética comum contribui para o risco de cancro do endométrio em estudos de associação do genoma em grande escala.[26][27] Dezasseis regiões genomicas foram associadas ao cancro do endométrio e as variantes comuns explicam até 7% do risco relativo familiar.[27]
Outros problemas de saúde
[editar | editar código-fonte]Algumas terapias para outros tipos de cancro aumentam o risco de desenvolver cancro do endométrio ao longo da vida.[18] O tamoxifeno, um fármaco usado no tratamento de cancro da mama ER+, tem sido associado com cancro do endométrio em cerca de 0,1% dos consumidores, principalmente em mulheres idosas. No entanto, os benefícios de sobrevivência do tamofixeno superam o risco de desenvolver cancro do endométrio.[28] A ingestão de tamofixeno ao longo de 1 a 2 anos duplica o risco de cancro do endométrio, enquanto uma terapia com a duração de cinco anos quadruplica o risco.[22] O raloxifeno, um fármaco semelhante, não aumenta o risco de cancro do endométrio.[29]
Ter tido anteriormente cancro do ovário é um factor de risco para o cancro do endométrio.[30] A imunodeficiência tem também implicações no risco de cancro do endométrio.[15] A hipertensão é também um factor de risco,[21] embora a associação se possa dever à obesidade.[25] Permanecer sentado por longos períodos de tempo está associado a uma mortalidade maior por cancro do endométrio. O risco não desaparece com o exercício físico, embora diminua.[31]
Factores protectores
[editar | editar código-fonte]Fumar e o uso de progestina oferecem protecção contra o cancro do endométrio. Fumar oferece protecção ao alterar o metabolismo do estrogénio e ao promover a perda de peso e a menopausa precoce. Este efeito protector permanece ao longo de bastante tempo, mesmo após deixar de fumar. Tanto a pílula contraceptiva oral combinada como o dispositivo intrauterino contêm progestina.[17][32] A diminuição do risco pelas pílulas combinadas é proporcional à duração do tempo ao longo do qual são tomadas: 56% após quatro anos, 67% após oito anos e 72% após doze anos. A diminuição do risco prolonga-se por pelo menos quinze anos após a interrupção da ingestão. As mulheres obesas podem necessitar de doses maiores de progestina para beneficiar do efeito protector. Ter tido mais de cinco filhos pode também ser um factor protector.[15] Ter tido pelo menos um filho diminui o risco em 35%. Amamentar por mais de 18 meses diminui o risco em 23%. O aumento da actividade física diminui o risco individual em 38–46%. Há indícios que o consumo de soja possa ter efeito protector.[29]
Fisiopatologia
[editar | editar código-fonte] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
O cancro do endométrio é formado quando há erros no crescimento normal das células do endométrio. Normalmente, quando as células envelhecem ou ficam danificadas, elas morrem e novas células ocupam o seu lugar. O cancro começa quando novas células se formam desnecessariamente e as células velhas e/ou danificadas não morrem como deveriam. A acumulação de células extra geralmente forma uma massa de tecido chamada tumor. Essas células cancerosas anormais têm muitas anomalias genéticas que as fazem crescer excessivamente.[9]
Em 10 a 20% dos casos de cancro do endométrio, principalmente de grau 3 (o grau histológico mais alto), ocorrem mutações num gene supressor de tumor, comummente o p53 ou PTEN. Em 20% das hiperplasias do endométrio e 50% dos cancros do endométrio, o PTEN sofre uma mutação por perda de função ou uma mutação nula, tornando-o menos eficaz ou completamente ineficaz.[34] A perda de função do PTEN leva à sobre-regulação da via PI3k/Akt/mTOR, causando o crescimento celular.[21] No cancro do endométrio, a via do p53 pode estar suprimida ou altamente activa. Quando uma versão mutante de p53 é superexpressa, o cancro tende a ser particularmente agressivo.[34] As mutações de P53 e a instabilidade cromossómica estão associadas a carcinomas serosos, que tendem a assemelhar-se a carcinomas do ovário e das trompas de falópio. Acredita-se que os carcinomas serosos se desenvolvam a partir de carcinomas intraepiteliais endometriais.[21]
As mutações de perda de função no PTEN e no p27 estão associadas a um prognóstico mais favorável, particularmente em mulheres obesas. O oncogene Her2/neu, associado a um prognóstico menos favorável, expressa-se em 20% dos carcinomas endometrióides e serosos. Em 14–44% dos cancros do endométrio observam-se mutações do CTNNB1 (beta-catenina; um gene de transcrição) e podem indicar um prognóstico favorável, mas os dados não são claros.[34] As mutações da beta-catenina são frequentemente encontradas em cancros do endométrio com células escamosas.[21] As mutações do FGFR2 são encontradas em aproximadamente 10% dos cancros do endométrio e o seu significado prognóstico não é claro.[34] O SPOP é outro gene supressor de tumor que sofreu mutação em alguns casos de cancro do endométrio: 9% dos carcinomas do endométrio de células claras e 8% dos carcinomas do endométrio serosos apresentam mutações neste gene.[35]
Os cancros do Tipo I e do Tipo II tendem a ter diferentes mutações envolvidas. O ARID1A, que geralmente sofre uma mutação pontual no cancro do endométrio Tipo I, também se encontra mutado em 26% dos carcinomas de células claras do endométrio e 18% dos carcinomas serosos. No cancro do endométrio Tipo I observa-se frequentemente silenciamento epigenético e mutações pontuais de vários genes.[3][33] No cancro do endométrio Tipo II são comuns mutações em genes supressores de tumor.[3] Em cancros do Tipo I e Tipo II o gene PIK3CA encontra-se frequentemente mutado.[33] Em mulheres com cancro do endométrio associado à síndrome de Lynch é comum a instabilidade de microsatélites.[21]
O desenvolvimento de uma hiperplasia do endométrio (crescimento excessivo de células endometriais) é um factor de risco significativo, uma vez que em muitos casos as hiperplasias evoluem para adenocarcinomas, embora o cancro se possa desenvolver sem a presença de uma hiperplasia.[19] No prazo de dez anos, entre 8 e 30% das hiperplasias do endomério atípicas evoluem para cancro, enquanto apenas 1–3% das hiperplasias não atípicas evoluem.[36] Uma hiperplasia atípica é aquela com anomalias visíveis nos núcleos. As hiperplasias do endométrio pré-cancerosas também são chamadas de neoplasia intraepitelial endometrial.[37] As mutações no gene KRAS podem causar hiperplasia do endométrio e, portanto, cancro do endométrio do Tipo I.[34] A hiperplasia do endométrio geralmente ocorre após os 40 anos de idade.[9] A displasia glandular endometrial ocorre com uma superexpressão de p53 e evolui para um carcinoma seroso.[15]
Diagnóstico
[editar | editar código-fonte]Exame
[editar | editar código-fonte]

O rastreio de rotina de pessoas assintomáticas não está indicado, uma vez que nos estádios iniciais sintomáticos a doença tem uma elevada taxa de cura. Em vez disso, as mulheres, especialmente as mulheres na menopausa, devem estar informadas dos sintomas e factores de risco do cancro do endométrio. Os testes de rastreio cervical, como o teste de Papanicolau, não são ferramentas de diagnóstico úteis para o cancro do endométrio porque em 50% dos casos o teste dará um resultado normal.[10] No entanto, o teste de Papanicolau permite detectar cancro que se tenha alastrado para o colo do útero.[9] Os resultados de um exame vaginal são frequentemente normais, sobretudo nos estádios iniciais da doença. Quando a doença está mais avançada, podem ocorrer mudanças no tamanho, forma ou consistência do útero ou das estruturas circundantes.[10] O estreitamento da abertura cervical é um sinal de cancro do endométrio quando se observa pus ou sangue depositados no útero (piometra ou hematometra).[13]
Recomenda-se que as mulheres com síndrome de Lynch comecem a fazer biópsia de rastreio anual a partir dos 35 anos. Algumas mulheres com síndrome de Lynch optam por uma histerectomia profilática e salpingo-ooforectomia para reduzir significativamente o risco de cancro do endométrio e do ovário.[10]
Nos Estados Unidos, tem sido cada vez mais usada a ecografia transvaginal para examinar a espessura do endométrio em mulheres com hemorragias pós-menopausa, de modo a auxiliar o diagnóstico de cancro do endométrio.[38] No Reino Unido, tanto a biópsia endometrial quanto a ecografia transvaginal, usadas em conjunto, são o tratamento padrão para o diagnóstico de cancro do endométrio.[15] A homogeneidade do tecido visível na ecografia transvaginal pode ajudar a indicar se a espessura é cancerosa. As descobertas da ecografia por si só não são conclusivas em casos de cancro do endométrio, pelo que deve ser usada em conjunto com outro método de rastreio (por exemplo, biópsia endometrial). Outros exames imagiológicos são de uso limitado. As TAC são usadas para imagens pré-operatórias de tumores que parecem avançados no exame físico ou têm um subtipo de alto risco (com alto risco de metástase).[39] Eles também podem ser usados para investigar doenças extrapélvicas.[15] Uma ressonância magnética pode ser útil para determinar se o cancro alastrou-se para o colo do útero ou se é um adenocarcinoma endocervical.[39] A ressonância magnética também é útil para examinar os nódulos linfáticos próximos.[15]
A dilatação e curetagem, ou a biópsia endometrial, são usadas para obter uma amostra de tecido para exame histológico. A biópsia endometrial é a opção menos invasiva, mas pode não fornecer resultados conclusivos por cada vez que é usada. A histeroscopia mostra apenas a anatomia macroscópica do endométrio, que muitas vezes não é indicativa de cancro e, portanto, não é usada a menos que em conjunto com uma biópsia.[39] Contudo, a histeroscopia pode ser usada para confirmar o diagnóstico de cancro. Novas evidências mostram que a dilatação e curetagem tem uma taxa de falsos negativos maior do que a biópsia endometrial.[21]
Antes de iniciar o tratamento são recomendadas uma série de outras investigações, como uma radiografia de tórax, testes de função hepática, testes de função renal,[21] e um teste para os níveis de CA-125, um marcador tumoral que pode estar elevado no cancro do endométrio.[9]
Classificação
[editar | editar código-fonte]Os cancro do endométrio podem ser tumores derivados de células epiteliais (carcinomas), tumores epiteliais e mesenquimais mistos (carcinossarcomas) ou tumores mesenquimais.[40]

A classificação tradicional de carcinomas endometriais é baseada em características clínicas e endócrinas (Tipo I e Tipo II) ou características histopatológicas (endometrióides, serosas e células claras). Alguns tumores são difíceis de classificar e têm características que se sobrepõem a mais de uma categoria. Os tumores endometrioides de alto grau, em particular, tendem a ter características do Tipo I e do Tipo II.[40]
Carcinoma
[editar | editar código-fonte]A grande maioria dos cancros do endométrio são carcinomas (geralmente adenocarcinomas), o que significa que têm origem na camada única de células epiteliais que revestem o endométrio e formam as glândulas endometriais. Embora existam muitos subtipos microscópicos de carcinomas endometriais, podem ser divididos em duas categorias – Tipo I e Tipo II – com base nas características clínicas e patogénese. Os dois subtipos são geneticamente distintos.[10]
Os carcinomas endometriais do Tipo I ocorrem com maior frequência antes e perto da menopausa. Nos Estados Unidos, são mais comuns em mulheres brancas, particularmente aquelas com histórico de hiperplasia endometrial. Os cancro do endométrio do Tipo I são frequentemente de baixo grau, minimamente invasivos na parede uterina subjacente (miométrio), dependentes de estrogénio e respondem bem ao tratamento.[10] Os carcinomas do Tipo I representam 75–90% dos cancros do endométrio.[15][42]
Os carcinomas endometriais do Tipo II geralmente afectam pessoas mais velhas, na pós-menopausa. Nos Estados Unidos são mais comuns em mulheres negras e não estão associados ao aumento da exposição ao estrogénio ou a uma história de hiperplasia endometrial. Os cancros do endométrio do Tipo II costumam ser de alto grau, com invasão profunda na parede uterina subjacente (miométrio), são do tipo seroso ou de células claras e apresentam um prognóstico pior. Na avaliação dos sintomas podem ser confundidos com cancro do ovário epitelial.[10][42] Os tumores do tipo II têm tendência a manifestar-se mais tarde que os do Tipo I e são mais agressivos, com maior risco de recidiva e/ou metástase.[15]
Adenocarcinoma endometrioide
[editar | editar código-fonte]No adenocarcinoma endometrioide, as células cancerosas crescem em padrões semelhantes ao do endométrio normal, com muitas novas glândulas formadas a partir do epitélio colunar com alguns núcleos anormais. Os adenocarcinomas endometrioides de baixo grau têm células bem diferenciadas, não invadiram o miométrio e são observados a par da hiperplasia endometrial. As glândulas do tumor formam-se muito próximas, sem o tecido estromal que normalmente as separa. Os adenocarcinomas endometrioides de alto grau têm menos células bem diferenciadas, têm mais camadas sólidas de células tumorais que não estão organizadas em glândulas, e estão associados a um endométrio atrofiado. Existem vários subtipos de adenocarcinoma endometrioides com prognósticos semelhantes, incluindo variantes de células viloglandulares, secretoras e ciliadas. Também existe um subtipo caracterizado pela diferenciação escamosa. Alguns adenocarcinomas endometrioides apresentam focos de carcinoma mucinoso.[43]
As mutações genéticas mais frequentemente associadas ao adenocarcinoma endometrioide estão nos genes PTEN, um supressor de tumor; PIK3CA, uma quinase; KRAS, uma GTPase que actua na transdução de sinais; e CTNNB1, envolvido na adesão e sinalização celular. A mutação do gene CTNNB1 (beta-catenina) é mais frequente no subtipo escamoso de adenocarcinoma endometrioide.[44]
Carcinoma seroso
[editar | editar código-fonte]O carcinoma seroso é um tumor endometrial Tipo II que representa 5–10% dos cancros do endométrio diagnosticados e é comum em mulheres pós-menopáusicas com endométrio atrofiado e mulheres negras. O carcinoma endometrial seroso é agressivo e frequentemente invade o miométrio e metastatiza dentro do peritónio (visto como aglomeração omental ) ou no sistema linfático. Histologicamente, aparece com muitos núcleos atípicos, estruturas papilares e, ao contrário dos adenocarcinomas endometrióides, células arredondadas em vez de células colunares. Aproximadamente 30% dos carcinomas serosos do endométrio também apresentam corpos de psammoma.[19][42] Os carcinomas serosos alastram-se de maneira diferente da maioria dos outros cancros do endométrio; eles podem alastrar-se para fora do útero sem invadir o miométrio.[19]
As mutações genéticas vistas no carcinoma seroso são instabilidade cromossómica e mutações no TP53, um importante gene supressor de tumor.[44]
Carcinoma de células claras
[editar | editar código-fonte]O carcinoma de células claras é um tumor endometrial Tipo II que representa menos de 5% dos cancros do endométrio diagnosticados. Assim como o carcinoma de células serosas, geralmente é agressivo e de mau prognóstico. Histologicamente, é caracterizado pelos traços comuns a todas as células claras: o citoplasma claro epónimo quando corado com H&E e visível, e membranas celulares distintas.[42] O sistema de sinalização de células p53 não está activo no carcinoma de células claras do endométrio.[15] Esta forma de cancro endometrial é mais comum em mulheres na pós-menopausa.[19]
Carcinoma mucinoso
[editar | editar código-fonte]Os carcinomas mucinosos são uma forma rara de cancro do endométrio, representando menos de 1–2% de todos os cancro do endométrio diagnosticados. Os carcinomas endometriais mucinosos são na maioria das vezes estágio I e grau I, o que lhes dá um bom prognóstico. Eles normalmente têm células colunares bem diferenciadas organizadas em glândulas com a mucina característica no citoplasma. Os carcinomas mucinosos devem ser diferenciados do adenocarcinoma cervical.[43]
Carcinoma misto ou indiferenciado
[editar | editar código-fonte]Os carcinomas mistos são aqueles que possuem células do Tipo I e do Tipo II, com uma delas constituindo pelo menos 10% do tumor.[43] Entre eles estão o tumor maligno misto de Müller, que deriva do epitélio endometrial e tem um mau prognóstico.[45]
Os carcinomas endometriais indiferenciados representam menos de 1–2% dos cancros do endométrio diagnosticados. Eles têm um prognóstico pior do que os tumores de grau III. Histologicamente, esses tumores mostram camadas de células epiteliais idênticas, sem padrão identificável.[43]
Outros carcinomas
[editar | editar código-fonte]O carcinoma de células escamosas não metastático e o carcinoma de células transicionais são muito raros no endométrio. O carcinoma de células escamosas do endométrio tem um mau prognóstico.[43] Foi relatado menos de 100 vezes na literatura médica desde a sua caracterização em 1892. Para que o carcinoma de células escamosas primário do endométrio (PSCCE) seja diagnosticado, não deve haver nenhum outro cancro primário no endométrio ou colo do útero e não deve estar conectado ao epitélio cervical. Devido à raridade desse tipo de cancro, não há directrizes sobre como ele deve ser tratado, nem qualquer tratamento típico. As causas genéticas comuns permanecem não caracterizadas.[46] Os carcinomas de células transicionais primárias do endométrio são ainda mais raros; 16 casos foram relatados até 2008. A sua fisiopatologia e tratamentos também ainda não foram caracterizados.[47] Histologicamente, o TCCE assemelha-se ao carcinoma endometrioide e é distinto de outros carcinomas de células transicionais.[48]
Sarcoma
[editar | editar código-fonte]
Em contraste com os carcinomas endometriais, os sarcomas do estroma endometrial incomuns são cancros que se originam no tecido conjuntivo não glandular do endométrio. Eles geralmente não são agressivos e, se ocorrerem, podem levar décadas. As metástases para os pulmões e cavidades pélvicas ou peritoneais são as mais frequentes.[19] Eles normalmente têm receptores de estrogénio e/ou progesterona.[49] O prognóstico para sarcoma do estroma endometrial de baixo grau é bom, com sobrevivência em cinco anos de 60–90%. O sarcoma endometrial indiferenciado de alto grau (HGUS) tem prognóstico pior, com altas taxas de recorrência e 25% de sobrevivência em cinco anos.[50] O prognóstico de HGUS é ditado pelo facto de o cancro invadir ou não as artérias e veias. Sem invasão vascular, a sobrevivência em cinco anos é de 83%, e cai para 17% quando é observada invasão vascular. A ESS estágio I tem o melhor prognóstico, com sobrevivência em cinco anos de 98% e sobrevida em dez anos de 89%. ESS representa 0,2% dos cancros uterinos.[51]
Metástase
[editar | editar código-fonte]O cancro do endométrio frequentemente metastatiza nos ovários e nas trompas de Falópio[30] quando o cancro está localizado na parte superior do útero, e no colo do útero quando o cancro está na parte inferior do útero. O cancro geralmente alastra-se primeiro para o miométrio e a serosa e, em seguida, para outras estruturas reprodutivas e pélvicas. Quando o sistema linfático está envolvido, os nódulos pélvicos e para-aórticos são geralmente os primeiros a ser envolvidos, mas sem um padrão específico, ao contrário do cancro cervical. Metástases mais distantes são disseminadas pelo sangue e geralmente ocorrem nos pulmões, bem como no fígado, cérebro e ossos.[52] O cancro endometrial metastatiza para os pulmões de 20 a 25% das vezes, mais do que qualquer outro cancro ginecológico.[53]
Histopatologia
[editar | editar código-fonte]Existe um sistema de três camadas para classificar histologicamente os cancros do endométrio, variando de cancros com células bem diferenciadas (grau I) até células muito pouco diferenciadas (grau III).[22] Os cancros de grau I são os menos agressivos e têm o melhor prognóstico, enquanto os tumores de grau III são os mais agressivos e com probabilidade de recorrência. Os cancros de grau II são intermediários entre os graus I e III em termos de diferenciação celular e agressividade da doença.[54]
A histopatologia dos cancros do endométrio é altamente diversa. O que é encontrado mais comummente é um adenocarcinoma endometrioide bem diferenciado,[45] que é composto por numerosas glândulas pequenas e aglomeradas com vários graus de atipia nuclear, actividade mitótica e estratificação. Isso geralmente aparece no plano de fundo da hiperplasia endometrial. O adenocarcinoma Frank pode ser distinguido da hiperplasia atípica pela descoberta de invasão estromal clara, ou glândulas "costas com costas" que representam a substituição não destrutiva do estroma endometrial pelo cancro. Com a progressão da doença, o miométrio é infiltrado.[55]
Estágios
[editar | editar código-fonte]O carcinoma endometrial é estadiado cirurgicamente usando o sistema de estadiamento de cancro FIGO . O sistema de preparação do FIGO de 2009 é o seguinte:[56][57]
| Etapa | Descrição |
|---|---|
| I A | O tumor está confinado ao útero com menos da metade da invasão miometrial |
| IB | O tumor está confinado ao útero com mais da metade da invasão miometrial |
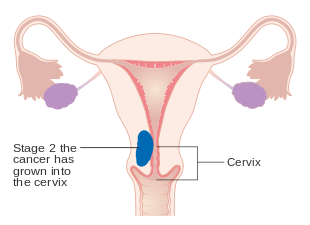
| II | O tumor envolve o útero e o estroma cervical |
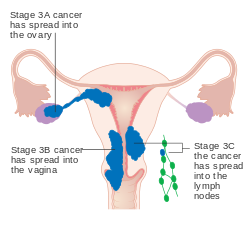
| IIIA | O tumor invade a membrana serosa ou anexos |
| IIIB | Envolvimento vaginal e/ou parametrial |
| IIIC1 | Envolvimento do linfonodo pélvico |
| IIIC2 | Envolvimento de linfonodos para-aórticos, com ou sem envolvimento de linfonodos pélvicos |
| IVA | O tumor invade a mucosa da bexiga e/ou mucosa do intestino |
| IVB | Metástases distantes, incluindo metástases abdominais e/ou linfonodos inguinais |
A invasão miometrial e o envolvimento dos linfonodos pélvicos e para-aórticos são os padrões de disseminação observados com maior frequência.[2] Às vezes, é incluído um Estágio 0, neste caso denominado "carcinoma in situ".[9] Em 26% dos cancros presumivelmente em estágio inicial, o estadiamento intraoperatório revelou metástases pélvicas e à distância, tornando necessário um estadiamento cirúrgico abrangente.[25]
- Cancro do endométrio em estágio IA e IB
- Cancro do endométrio em estágio II
- Cancro do endométrio em estágio III
- Cancro do endométrio em estágio IV
Gestão
[editar | editar código-fonte]Cirurgia
[editar | editar código-fonte]
O tratamento inicial para o cancro do endométrio é a cirurgia; 90% das mulheres com cancro do endométrio são tratadas com algum tipo de cirurgia.[22] O tratamento cirúrgico geralmente consiste em histerectomia, incluindo uma salpingo-ooforectomia bilateral, que é a remoção do útero, dos ovários e das trompas de Falópio. A linfadenectomia, ou remoção de linfonodos pélvicos e para-aórticos, é realizada para tumores de grau histológico II ou superior.[16] A linfadenectomia é realizada rotineiramente para todos os estágios do cancro do endométrio nos Estados Unidos, mas no Reino Unido, os gânglios linfáticos são tipicamente removidos apenas se se verificar doença de estágio II ou superior.[15] O tópico da linfadenectomia e quais os benefícios de sobrevivência que ela oferece no estágio I da doença ainda é objecto de debate.[21] Em mulheres com doença presumida em estágio I, uma revisão sistemática de 2017 não encontrou evidências de que a linfadenectomia reduz o risco de morte ou recidiva do cancro em comparação com a ausência de linfadenectomia.[58] Mulheres que se submetem à linfadenectomia têm uma maior probabilidade de apresentar morbidade sistémica relacionada à cirurgia ou formação de linfedema/linfocisto.[58] Nos cancros em estágio III e IV, a cirurgia citorredutora é a norma,[16] e uma biópsia do omento também pode ser incluída.[59] No estágio IV da doença, onde há metástases à distância, a cirurgia pode ser usada como parte da terapia paliativa.[21] A laparotomia, um procedimento de abdómen aberto, é o procedimento cirúrgico tradicional; no entanto, naquelas com cancro do endométrio primário presumido em estágio inicial, a laparoscopia está associada com morbidade operatória reduzida e sobrevivência geral e livre de doença semelhante.[59] A remoção do útero pelo abdómen é recomendada em vez da remoção do útero pela vagina porque dá a oportunidade de examinar e obter varrer a cavidade abdominal para detectar qualquer outra evidência de cancro. O estadiamento do cancro é feito durante a cirurgia.[60]
As poucas contra-indicações à cirurgia incluem tumor inoperável, obesidade maciça, uma operação de alto risco particular ou desejo de preservar a fertilidade.[60] Essas contra-indicações acontecem em cerca de 5–10% dos casos.[21] Mulheres que desejam preservar a sua fertilidade e têm cancro em estágio I de baixo grau podem ser tratadas com progestágenos, com ou sem terapia concomitante com tamoxifeno. Esta terapia pode ser continuada até que o cancro não responda ao tratamento ou até que a gravidez termine.[61] A perfuração uterina pode ocorrer durante uma D&C ou uma biópsia endometrial.[62] Os efeitos colaterais da cirurgia para remover o cancro do endométrio podem incluir especificamente disfunção sexual, incontinência temporária e linfedema, juntamente com os efeitos colaterais mais comuns de qualquer cirurgia, incluindo constipação.[9]
Terapias adicionais
[editar | editar código-fonte]Existem várias terapias adicionais possíveis. A cirurgia pode ser seguida de radioterapia e/ou quimioterapia em casos de cancro de alto risco ou alto grau. A isto é chamado de terapia adjuvante.[16]
Quimioterapia
[editar | editar código-fonte]A quimioterapia adjuvante é uma inovação recente, consistindo em alguma combinação de paclitaxel (ou outros taxanos como docetaxel ), doxorrubicina (e outras antraciclinas) e platinas (particularmente cisplatina e carboplatina). Foi descoberto que a quimioterapia adjuvante aumenta mais a sobrevivência no cancro em estágio III e IV do que a radioterapia adicionada.[16][21][22][63] Mutações em genes de reparo incompatíveis, como aqueles encontrados na síndrome de Lynch, podem levar à resistência contra as platinas, o que significa que a quimioterapia com platinas é ineficaz em pessoas com essas mutações.[64] Os efeitos colaterais da quimioterapia são comuns. Isso inclui perda de cabelo, baixos níveis de neutrófilos no sangue e problemas gastrointestinais.[16]
Nos casos em que a cirurgia não é indicada, a quimioterapia paliativa é uma opção; a quimioterapia em doses mais altas está associada a uma sobrevivência mais longa.[16][22][63] A quimioterapia paliativa, particularmente com capecitabina e gencitabina, também é frequentemente usada para tratar o cancro do endométrio recorrente.[63]
Evidências de baixa certeza sugerem que em mulheres com cancro do endométrio recorrente que fizeram quimioterapia, receber medicamentos que inibem a via mTOR pode reduzir o risco de agravamento da doença em comparação a receber mais quimioterapia ou terapia hormonal. Porém, os inibidores de mTOR podem aumentar a chance de desenvolver úlceras do trato digestivo.[65]
Radioterapia
[editar | editar código-fonte]A radioterapia adjuvante é frequentemente usada no cancro do endométrio em estágio inicial (estágio I ou II). Pode ser administrada através de braquiterapia vaginal (VBT), que está a tornar-se a via preferencial devido à sua toxicidade reduzida, ou radioterapia de feixe externo (EBRT). A braquiterapia envolve a colocação de uma fonte de radiação no órgão afectado; no caso do cancro do endométrio, uma fonte de radiação é colocada directamente na vagina. A radioterapia por feixe externo envolve um feixe de radiação voltado para a área afectada de fora do corpo. A VBT é usada para tratar qualquer cancro remanescente apenas na vagina, enquanto a EBRT pode ser usada para tratar o cancro remanescente em outra parte da pelve após a cirurgia. No entanto, os benefícios da radioterapia adjuvante são controversos. Embora a EBRT reduza significativamente a taxa de recidiva na pelve, a sobrevivência geral e as taxas de metástase não melhoram.[2] A VBT oferece melhor qualidade de vida do que a EBRT.[21]
A radioterapia também pode ser usada antes da cirurgia em certos casos. Quando a imagem pré-operatória ou avaliação clínica mostra um tumor a invadir o colo do útero, a radiação pode ser dada antes de uma histerectomia total ser realizada.[13] A braquiterapia e a EBRT também podem ser utilizadas, isoladamente ou em combinação, quando houver contra-indicação para histerectomia.[21] Ambos os métodos de administração de radioterapia estão associados a efeitos colaterais, particularmente no trato gastrointestinal.[2]
Terapia hormonal
[editar | editar código-fonte]A terapia hormonal só é benéfica em certos tipos de cancro do endométrio. Já foi considerado benéfico na maioria dos casos.[2][16] Se um tumor for bem diferenciado e tiver receptores de progesterona e estrogénio, as progestinas podem ser usadas no tratamento.[63] Não há evidências que apoiem o uso de progestágeno além da cirurgia para cancro do endométrio recém-diagnosticado.[66] Cerca de 25% dos cancro do endométrio metastáticos mostram uma resposta às progestinas. Além disso, os sarcomas do estroma endometrial podem ser tratados com agentes hormonais, incluindo tamoxifeno, caproato de hidroxiprogesterona, letrozol, acetato de megestrol e medroxiprogesterona.[19] Este tratamento é eficaz em sarcomas do estroma endometrial porque eles geralmente têm receptores de estrogénio e/ou progestágeno . Os receptores de progestina funcionam como supressores de tumor nas células cancerosas do endométrio.[67] Pesquisas preliminares e ensaios clínicos demonstraram que esses tratamentos têm uma alta taxa de resposta, mesmo na doença metastática.[49]
Em 2010, a terapia hormonal não tem efeito claro em pacientes com cancro do endométrio avançado ou recorrente.[68] Não há evidências suficientes para informar as mulheres que consideram a terapia de reposição hormonal após o tratamento para cancro do endométrio.[69]
Monitorização
[editar | editar código-fonte]O marcador tumoral CA-125 é frequentemente elevado no cancro do endométrio e pode ser usado para monitorizar a resposta ao tratamento, particularmente no cancro de células serosas ou doença avançada.[30][39][70] Ressonâncias magnéticas ou tomografias computorizadas periódicas podem ser recomendadas na doença avançada e mulheres com histórico de cancro do endométrio devem receber exames pélvicos mais frequentes durante os cinco anos após o tratamento.[70] Os exames realizados a cada três a quatro meses são recomendados nos primeiros dois anos após o tratamento, e a cada seis meses nos três anos seguintes.[21]
Mulheres com cancro do endométrio não devem ser submetidas a imagens de rotina para monitorizar o cancro, a menos que novos sintomas apareçam ou os marcadores tumorais comecem a subir. A obtenção de imagens sem essas indicações é desencorajada porque é improvável que detecte uma recorrência ou melhore a sobrevivência, e também porque tem os seus próprios custos e efeitos colaterais.[71] Se houver suspeita de recorrência, a varredura PET/CT é recomendada.[21]
Prognóstico
[editar | editar código-fonte]Taxas de sobrevivência
[editar | editar código-fonte]| Etapa | Taxa de sobrevivência de 5 anos |
|---|---|
| I A | 88% |
| IB | 75% |
| II | 69% |
| III-A | 58% |
| III-B | 50% |
| III-C | 47% |
| IV-A | 17% |
| IV-B | 15% |
A taxa de sobrevivência de cinco anos para o adenocarcinoma endometrial após o tratamento adequado é de 80%.[73] A maioria das mulheres, mais de 70%, tem cancro em estágio FIGO I, que tem o melhor prognóstico. Os cancros em estágio III e especialmente em estágio IV têm um prognóstico pior, mas são relativamente raros, ocorrendo em apenas 13% dos casos. O tempo médio de sobrevivência para cancro do endométrio em estágio III-IV é de nove a dez meses.[74] A idade avançada é um indicador para um prognóstico pior.[16] Nos Estados Unidos, as mulheres brancas apresentam uma taxa de sobrevivência maior do que as mulheres negras, que tendem a desenvolver formas mais agressivas da doença no momento do diagnóstico.[19] Os tumores com alta expressão de receptor de progesterona têm um bom prognóstico em comparação com tumores com baixa expressão de receptor de progesterona; 93% das mulheres com doença de alto receptor de progesterona sobreviveram até três anos, em comparação com 36% das mulheres com doença do receptor de progesterona baixa.[4] A doença cardíaca é a causa mais comum de morte entre aqueles que sobrevivem ao cancro do endométrio,[75] com outros problemas de saúde relacionados à obesidade também a serem comuns.[76] Após o diagnóstico, a qualidade de vida também está associada positivamente a um estilo de vida saudável (sem obesidade, alimentação de alta qualidade, actividade física).[77]
Taxas de recorrência
[editar | editar código-fonte]A recorrência do cancro do endométrio em estágio inicial varia de 3 a 17%, dependendo do tratamento primário e adjuvante.[73] A maioria das recorrências (75–80%) ocorre fora da pelve e a maioria ocorre dois a três anos após o tratamento, 64% após dois anos e 87% após três anos.[53]
Os cancros em estágio mais alto têm maior probabilidade de recorrência, assim como aqueles que invadiram o miométrio ou o colo do útero, ou que metastatizaram no sistema linfático. O carcinoma seroso papilar, o carcinoma de células claras e o carcinoma endometrioide são os subtipos com maior risco de recorrência.[22] Os subtipos histológicos de alto grau também apresentam risco elevado de recorrência.[15]
O local mais comum de recorrência é na vagina;[2] recidivas vaginais de cancro do endométrio têm o melhor prognóstico. Se ocorrer recidiva de um cancro que não foi tratado com radiação, a EBRT é o tratamento de primeira linha e geralmente é bem-sucedido. Se um cancro tratado com radiação reaparecer, a exenteração pélvica é a única opção de tratamento curativo. Quimioterapia paliativa, cirurgia citorredutora e radiação também são realizadas.[78] A radioterapia (VBT e EBRT) para uma recorrência vaginal local tem uma taxa de sobrevivência em cinco anos de 50%. As recorrências pélvicas são tratadas com cirurgia e radiação, e as recorrências abdominais são tratadas com radiação e, se possível, quimioterapia.[21] Outros locais de recorrência comuns são os linfonodos pélvicos, linfonodos para-aórticos, peritónio (28% das recorrências) e pulmões, embora as recorrências também possam ocorrer no cérebro (<1%), fígado (7%), glândulas adrenais (1%), ossos (4–7%; tipicamente no esqueleto axial), gânglios linfáticos fora do abdómen (0,4–1%), baço e músculo/tecido mole (2–6%).[53]
Epidemiologia
[editar | editar código-fonte]Até 2014, aproximadamente 320 000 mulheres foram diagnosticadas, a cada ano, com cancro do endométrio em todo o mundo, e destas 76 000 morre, fazendo deste cancro o sexto mais comum entre as mulheres.[3] É mais comum nos países desenvolvidos, onde o risco de se ter cancro do endométrio ao longo da vida (em pessoas que nasceram com utiri) é de 1,6%, em comparação com 0,6% nos países em desenvolvimento.[16] Nos países desenvolvidos, ele aparece em 12,9 mulheres por casa 100 000.[22]
Nos Estados Unidos, o cancro do endométrio é o cancro ginecológico mais frequentemente diagnosticado e, nas mulheres, o quarto cancro mais comum em geral,[11][19] representando 6% de todos os casos de cancro em mulheres.[79] Nesse país, em 2014, estimou-se que 52 630 mulheres eram diagnosticadas anualmente e 8 590 morreriam da doença.[25] A Europa do Norte, a Europa Oriental e a América do Norte têm as taxas mais altas de cancro do endométrio, enquanto a África e a Ásia Ocidental têm as taxas mais baixas. A Ásia viu 41% dos diagnósticos de cancro do endométrio do mundo em 2012, enquanto a Europa do Norte, Europa Oriental e América do Norte juntas representaram 48% dos diagnósticos.[3] Ao contrário da maioria dos cancros, o número de novos casos aumentou nos últimos anos, incluindo um aumento de mais de 40% no Reino Unido entre 1993 e 2013.[16] Parte desse aumento pode ser devido ao aumento nas taxas de obesidade em países desenvolvidos,[22] ao aumentando da esperança média de vida e à redução das taxas de natalidade.[11] O risco médio ao longo da vida da mulher para o cancro do endométrio é de aproximadamente 2–3%.[18] No Reino Unido, aproximadamente 7 400 casos são diagnosticados anualmente e, na UE, cerca de 88 000.[21]
O cancro do endométrio aparece com mais frequência durante a perimenopausa (o período imediatamente antes, logo após e durante a menopausa), entre as idades de 50 e 65 anos;[19] no geral, 75% do cancro do endométrio ocorre após a menopausa.[2] Mulheres com menos de 40 anos representam 5% dos casos de cancro do endométrio e 10-15% dos casos ocorrem em mulheres com menos de 50 anos anos de idade. Essa faixa etária está em risco de desenvolver cancro do ovário ao mesmo tempo.[21] A idade média mundial do diagnóstico é 63 anos de idade;[21] nos Estados Unidos, a idade média de diagnóstico é 60 anos de idade. Mulheres americanas brancas correm maior risco de cancro do endométrio do que mulheres americanas negras, com um risco de vida de 2,88% e 1,69%, respectivamente.[25] Mulheres nipo-americanas e mulheres latino-americanas têm taxas mais baixas e mulheres nativas havaianas têm taxas mais altas.[29]
Pesquisa
[editar | editar código-fonte]Existem várias terapias experimentais em fase de pesquisa para o cancro do endométrio, incluindo tratamentos imunológicos, hormonais e quimioterapeuticos. O trastuzumabe (Herceptin), um anticorpo contra a proteína Her2, tem sido usado em cancros conhecidos por serem positivos para o oncogene Her2/neu, mas as pesquisas ainda estão em desenvolvimento. As terapias imunológicas também estão sob investigação, particularmente no carcinoma papilar seroso do útero.[34]
Os cancros podem ser analisados usando técnicas genéticas (incluindo sequenciamento de DNA e imuno-histoquímica) para determinar se certas terapias específicas para genes mutantes podem ser usadas para tratá-lo. Os inibidores de PARP são usados para tratar o cancro do endométrio com mutações PTEN,[3] especificamente, mutações que diminuem a expressão de PTEN. O inibidor de PARP que demonstrou ser activo contra o cancro do endométrio é o olaparibe. A partir da década de 2010 têm-se realizado pesquisas nesta área.[24][80][81]
Encontram-se em desenvolvimento várias pesquisas sobre o uso de metformina, um medicamento para a diabetes, em mulheres obesas com cancro do endométrio antes da cirurgia. As primeiras pesquisas mostraram que é eficaz a desacelerar a taxa de proliferação de células cancerosas.[33] A pesquisa preliminar mostrou que a administração pré-operatória de metformina pode reduzir a expressão de marcadores tumorais. O uso de metformina a longo prazo não demonstrou ter um efeito preventivo contra o desenvolvimento do cancro, mas pode melhorar a sobrevivência geral.[20]
O temsirolimo, um inibidor do mTOR, está a ser investigado como um tratamento potencial.[21] A investigação mostra que os inibidores de mTOR podem ser particularmente eficazes para cancros com mutações no PTEN.[3] Ridaforolimus (deforolimus) também está a ser alvo de pesquisas como um tratamento para pessoas que já fizeram quimioterapia. A pesquisa preliminar tem sido promissora, e um ensaio de estágio II para ridaforolimus foi concluído em 2013.[21] Também houve pesquisas sobre tratamentos combinados de ridaforolimus/progestágeno para o cancro do endométrio recorrente.[82] O bevacizumabe e os inibidores da tirosina quinase, que inibem a angiogénese, também estão a ser alvos de pesquisas como potenciais tratamentos para cancros do endométrio com altos níveis de factor de crescimento endotelial vascular.[3] A ixabepilona está também a ser investigada como uma possível quimioterapia para o cancro do endométrio avançado ou recorrente.[82] Os tratamentos para o raro sarcoma endometrial indiferenciado de alto grau estão a ser pesquisados, pois ainda não há um padrão de tratamento estabelecido para essa doença. As quimioterapias estudadas incluem doxorrubicina e ifosfamida.[50]
Também há pesquisas em andamento sobre mais genes e biomarcadores que podem estar ligados ao cancro do endométrio. O efeito protector dos contraceptivos orais combinados e do DIU está sendo investigado. A pesquisa preliminar mostrou que o DIU de levonorgestrel colocado por um ano, combinado com 6 as injecções mensais da hormona liberadora de gonadotrofina, pode interromper ou reverter o progresso do cancro do endométrio em mulheres jovens.[83] Um composto experimental que combina uma hormona com a doxorrubicina também está sob investigação pela sua maior eficácia em cancros com receptores hormonais. A terapia hormonal que é eficaz no tratamento do cancro da mama, incluindo o uso de inibidores da aromatase, também está a ser investigada para uso no cancro do endométrio. Um desses compostos é o anastrozol, que actualmente encontra-se em pesquisas em recorrências hormonais positivas após a quimioterapia.[82] A pesquisa sobre tratamentos hormonais para sarcomas do estroma endometrial também está em andamento; inclui testes com compostos como o mifepristone, um antagonista da progestina, e a aminoglutetimida e o letrozol, dois inibidores da aromatase.[49]
A pesquisa continua sobre o melhor método de imagem para detecção e estadiamento do cancro do endométrio. Na cirurgia, a pesquisa mostrou que a linfadenectomia pélvica completa juntamente com a histerectomia no cancro do endométrio em estágio um não melhora a sobrevivência e aumenta o risco de efeitos colaterais negativos, incluindo linfedema. Outra pesquisa está a explorar o potencial de identificar os gânglios linfáticos sentinela para biópsia, injectando no tumor um corante que brilha sob luz infravermelha . A radioterapia modulada por intensidade está actualmente sob investigação, e já é utilizada em alguns centros, para aplicação no cancro do endométrio, de modo a reduzir os efeitos colaterais da radioterapia tradicional. O seu risco de recorrência ainda não foi quantificado. Pesquisas sobre oxigenoterapia hiperbárica para reduzir os efeitos colaterais também estão em desenvolvimento. Os resultados do ensaio PORTEC 3 avaliando a combinação de radioterapia adjuvante com quimioterapia eram aguardados no final de 2014.[82]
Não há evidências suficientes para determinar se as pessoas com cancro do endométrio se beneficiam de intervenções comportamentais e de estilo de vida adicionais que visam perder o excesso de peso.[84]
História e cultura
[editar | editar código-fonte]O cancro do endométrio não é amplamente conhecido pela população em geral, apesar da sua frequência. Há pouca percepção dos sintomas, o que pode levar a um diagnóstico tardio e piora a probabilidade de sobrevivência.[85]
Notas
[editar | editar código-fonte]- Este artigo foi inicialmente traduzido, total ou parcialmente, do artigo da Wikipédia em inglês cujo título é «Endometrial cancer».
Referências
- ↑ a b c d e «General Information About Endometrial Cancer». National Cancer Institute. 22 de abril de 2014. Consultado em 3 de setembro de 2014. Cópia arquivada em 3 de setembro de 2014
- ↑ a b c d e f g h i j «Adjuvant radiotherapy for stage I endometrial cancer». The Cochrane Database of Systematic Reviews. 4: CD003916. Abril de 2012. PMC 4164955
 . PMID 22513918. doi:10.1002/14651858.CD003916.pub4
. PMID 22513918. doi:10.1002/14651858.CD003916.pub4 - ↑ a b c d e f g h i j k l m n o International Agency for Research on Cancer (2014). World Cancer Report 2014. World Health Organization. [S.l.: s.n.] ISBN 978-92-832-0429-9
- ↑ a b c d e «Endometrial Cancer Treatment (PDQ®)». National Cancer Institute. 23 de abril de 2014. Consultado em 3 de setembro de 2014. Cópia arquivada em 3 de setembro de 2014
- ↑ a b «SEER Stat Fact Sheets: Endometrial Cancer». National Cancer Institute. Consultado em 18 de junho de 2014. Cópia arquivada em 6 de julho de 2014
- ↑ GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1545–1602. PMC 5055577
 . PMID 27733282. doi:10.1016/S0140-6736(16)31678-6
. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6 - ↑ GBD 2015 Mortality and Causes of Death Collaborators (outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015». Lancet. 388 (10053): 1459–1544. PMC 5388903
 . PMID 27733281. doi:10.1016/s0140-6736(16)31012-1
. PMID 27733281. doi:10.1016/s0140-6736(16)31012-1 - ↑ «Defining Cancer». National Cancer Institute. 17 de setembro de 2007. Consultado em 10 de junho de 2014. Cópia arquivada em 25 de junho de 2014
- ↑ a b c d e f g h i j «What You Need To Know: Endometrial Cancer». NCI. National Cancer Institute. Consultado em 6 de agosto de 2014. Cópia arquivada em 8 de agosto de 2014
- ↑ a b c d e f g h i j «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ a b c d «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ «Uterine Cancer - Cancer Stat Facts». SEER (em inglês). Consultado em 3 de fevereiro de 2019. Cópia arquivada em 6 de julho de 2014
- ↑ a b c «Gynecology». Current Diagnosis & Treatment: Surgery. McGraw-Hill 13th ed. [S.l.: s.n.] 2010. ISBN 978-0-07-163515-8
- ↑ «Association of Endometrial Cancer Risk With Postmenopausal Bleeding in Women: A Systematic Review and Meta-analysis». JAMA Internal Medicine. 178: 1210–1222. Setembro de 2018. PMC 6142981
 . PMID 30083701. doi:10.1001/jamainternmed.2018.2820
. PMID 30083701. doi:10.1001/jamainternmed.2018.2820 - ↑ a b c d e f g h i j k l m «Endometrial cancer». BMJ. 343: d3954. Julho de 2011. PMID 21734165. doi:10.1136/bmj.d3954
- ↑ a b c d e f g h i j k l «Adjuvant chemotherapy for advanced endometrial cancer». The Cochrane Database of Systematic Reviews. 5: CD010681. Maio de 2014. PMC 6457820
 . PMID 24832785. doi:10.1002/14651858.CD010681.pub2
. PMID 24832785. doi:10.1002/14651858.CD010681.pub2 - ↑ a b c d e «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 818 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ a b c d e «Testing women with endometrial cancer for lynch syndrome: should we test all?». Journal of the Advanced Practitioner in Oncology. 4: 322–30. Setembro de 2013. PMC 4093445
 . PMID 25032011. doi:10.6004/jadpro.2013.4.5.4
. PMID 25032011. doi:10.6004/jadpro.2013.4.5.4 - ↑ a b c d e f g h i j k «Neoplastic Diseases of the Uterus». Comprehensive Gynecology. Mosby 6th ed. [S.l.: s.n.] 2013. ISBN 978-0-323-06986-1
- ↑ a b «Metformin in reproductive health, pregnancy and gynaecological cancer: established and emerging indications». Human Reproduction Update. 20: 853–68. 2014. PMID 25013215. doi:10.1093/humupd/dmu037
- ↑ a b c d e f g h i j k l m n o p q r s t u v w «Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up». Annals of Oncology. 24 Suppl 6: vi33–8. Outubro de 2013. PMID 24078661. doi:10.1093/annonc/mdt353
- ↑ a b c d e f g h i «Chemotherapy for advanced, recurrent or metastatic endometrial carcinoma». The Cochrane Database of Systematic Reviews. 8: CD003915. Agosto de 2012. PMC 7104534
 . PMID 22895938. doi:10.1002/14651858.CD003915.pub4
. PMID 22895938. doi:10.1002/14651858.CD003915.pub4 - ↑ Committee on Health Care for Underserved Women (dezembro de 2011). «Health Care for Transgender Individuals: Committee Opinion No. 512». Obstetrics and Gynecology. 118: 1454–1458. PMID 22105293. doi:10.1097/aog.0b013e31823ed1c1. Cópia arquivada em 16 de dezembro de 2014
- ↑ a b «The Role of PARP Inhibitors in the Treatment of Gynecologic Malignancies». Frontiers in Oncology. 3. 237 páginas. Outubro de 2013. PMC 3787651
 . PMID 24098868. doi:10.3389/fonc.2013.00237
. PMID 24098868. doi:10.3389/fonc.2013.00237 - ↑ a b c d e «Endometrial cancer: a review and current management strategies: part I». Gynecologic Oncology. 134: 385–92. Agosto de 2014. PMID 24905773. doi:10.1016/j.ygyno.2014.05.018
- ↑ «Five endometrial cancer risk loci identified through genome-wide association analysis». Nature Genetics (em inglês). 48: 667–674. Junho de 2016. PMC 4907351
 . PMID 27135401. doi:10.1038/ng.3562
. PMID 27135401. doi:10.1038/ng.3562 - ↑ a b «Identification of nine new susceptibility loci for endometrial cancer». Nature Communications (em inglês). 9. 3166 páginas. Agosto de 2018. Bibcode:2018NatCo...9.3166O. PMC 6085317
 . PMID 30093612. doi:10.1038/s41467-018-05427-7
. PMID 30093612. doi:10.1038/s41467-018-05427-7 - ↑ «Postoperative tamoxifen for ductal carcinoma in situ». The Cochrane Database of Systematic Reviews. 10: CD007847. Outubro de 2012. PMID 23076938. doi:10.1002/14651858.CD007847.pub2.
There is evidence from other reports that tamoxifen increases the risk of endometrial cancer although the data presented in this review describes only 10 events occurring in 1798 participants (0.5%) after seven years of follow-up.
- ↑ a b c «Endometrial Cancer Prevention». PDQ. NIH. 28 de fevereiro de 2014. Cópia arquivada em 5 de janeiro de 2015
- ↑ a b c «Neoplastic Diseases of the Ovary». Comprehensive Gynecology. Mosby 6th ed. [S.l.: s.n.] 2013. ISBN 978-0-323-06986-1
- ↑ «Sedentary time and its association with risk for disease incidence, mortality, and hospitalization in adults: a systematic review and meta-analysis». Annals of Internal Medicine. 162: 123–32. Janeiro de 2015. PMID 25599350. doi:10.7326/M14-1651
- ↑ «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 819 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ a b c d «Major clinical research advances in gynecologic cancer in 2013». Journal of Gynecologic Oncology. 25: 236–48. Julho de 2014. PMC 4102743
 . PMID 25045437. doi:10.3802/jgo.2014.25.3.236
. PMID 25045437. doi:10.3802/jgo.2014.25.3.236 - ↑ a b c d e f «Molecular Oncology in Gynecologic Cancer». Comprehensive Gynecology. Mosby 6th ed. [S.l.: s.n.] 1 de janeiro de 2012. ISBN 978-0-323-06986-1
- ↑ «The emerging role of speckle-type POZ protein (SPOP) in cancer development». Drug Discovery Today. 19: 1498–502. Setembro de 2014. PMC 4237012
 . PMID 25058385. doi:10.1016/j.drudis.2014.07.009.
. PMID 25058385. doi:10.1016/j.drudis.2014.07.009. A recent exome-sequencing study revealed that 8% of serious endometrial cancers and 9% of clear cell endometrial cancers have SPOP mutations
- ↑ «Oral and intrauterine progestogens for atypical endometrial hyperplasia». The Cochrane Database of Systematic Reviews. 12: CD009458. Dezembro de 2018. PMC 6517239
 . PMID 30521671. doi:10.1002/14651858.CD009458.pub3
. PMID 30521671. doi:10.1002/14651858.CD009458.pub3 - ↑ «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 820 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 821 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ a b c d «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 824 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ a b «Classification of endometrial carcinoma: more than two types». The Lancet. Oncology. 15: e268–78. Junho de 2014. PMID 24872110. doi:10.1016/S1470-2045(13)70591-6
- ↑ Mendivil, Alberto; Schuler, Kevin M.; Gehrig, Paola A. (2009). «Non-Endometrioid Adenocarcinoma of the Uterine Corpus: A Review of Selected Histological Subtypes». Cancer Control. 16: 46–52. ISSN 1073-2748. doi:10.1177/107327480901600107
- ↑ a b c d «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 826 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ a b c d e «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 827 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ a b «Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up». Annals of Oncology. 22 Suppl 6: vi35–9. Setembro de 2011. PMID 21908501. doi:10.1093/annonc/mdr374
- ↑ a b «Adjuvant chemotherapy for endometrial cancer after hysterectomy». The Cochrane Database of Systematic Reviews: CD003175. Outubro de 2011. PMC 4164379
 . PMID 21975736. doi:10.1002/14651858.CD003175.pub2
. PMID 21975736. doi:10.1002/14651858.CD003175.pub2 - ↑ «Primary squamous cell carcinoma of the endometrium: two cases and a review of the literature». Diagnostic Cytopathology. 41: 817–20. Setembro de 2013. PMID 22241749. doi:10.1002/dc.22814
- ↑ et al.. «Transitional cell carcinoma of the endometrium and endometrial carcinoma with transitional cell differentiation: a clinicopathologic study of 5 cases and review of the literature». Human Pathology. 39: 1606–13 novembro de 2008. PMID 18620731. doi:10.1016/j.humpath.2008.03.005
- ↑ «Transitional cell carcinoma of the endometrium: a case report and review of the literature». International Journal of Gynecological Pathology. 25: 378–82. Outubro de 2006. PMID 16990716. doi:10.1097/01.pgp.0000215296.53361.4b
- ↑ a b c «Treatment of recurrent endometrial stromal sarcoma with letrozole: a case report and literature review». Hormones & Cancer. 1: 112–5. Abril de 2010. PMID 21761354. doi:10.1007/s12672-010-0007-9
- ↑ a b «Uterine sarcomas: histology and its implications on therapy». American Society of Clinical Oncology Educational Book. American Society of Clinical Oncology. Annual Meeting: 356–61. 2012. PMID 24451763. doi:10.14694/EdBook_AM.2012.32.7. Consultado em 11 de novembro de 2020. Cópia arquivada em 14 de janeiro de 2020
- ↑ «Uterine sarcomas: a review». Gynecologic Oncology. 116: 131–9. Janeiro de 2010. PMID 19853898. doi:10.1016/j.ygyno.2009.09.023
- ↑ «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 828 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ a b c «Typical and atypical metastatic sites of recurrent endometrial carcinoma». Cancer Imaging. 13: 113–22. Março de 2013. PMC 3613792
 . PMID 23545091. doi:10.1102/1470-7330.2013.0011
. PMID 23545091. doi:10.1102/1470-7330.2013.0011 - ↑ «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 825 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ Modern Surgical Pathology (2 Volume Set). WB Saunders. [S.l.: s.n.] 2002. ISBN 978-0-7216-7253-3
- ↑ «Stage Information for Endometrial Cancer». National Cancer Institute. Janeiro de 1980. Consultado em 23 de abril de 2014. Cópia arquivada em 6 de abril de 2014
- ↑ Murray J. Casey; Garth K. Summers; David Crotzer. «Endometrial Cancer». StatPearls, National Center for Biotechnology Information. Consultado em 11 de novembro de 2020. Cópia arquivada em 12 de novembro de 2020 Last Update: July 13, 2020
- ↑ a b «Lymphadenectomy for the management of endometrial cancer». The Cochrane Database of Systematic Reviews. 10: CD007585. Outubro de 2017. PMC 6485923
 . PMID 28968482. doi:10.1002/14651858.cd007585.pub4
. PMID 28968482. doi:10.1002/14651858.cd007585.pub4 - ↑ a b «Laparoscopy versus laparotomy for the management of early stage endometrial cancer». The Cochrane Database of Systematic Reviews. 10: CD006655. Outubro de 2018. PMC 6517108
 . PMID 30379327. doi:10.1002/14651858.CD006655.pub3
. PMID 30379327. doi:10.1002/14651858.CD006655.pub3 - ↑ a b «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 829 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 833 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ «Gestational Trophoblastic Disease». Comprehensive Gynecology. Mosby 6th ed. [S.l.: s.n.] 2013. ISBN 978-0-323-06986-1
- ↑ a b c d «Principles of Radiation Therapy and Chemotherapy in Gynecologic Cancer». Comprehensive Gynecology. Mosby 6th ed. [S.l.: s.n.] 2013. ISBN 978-0-323-06986-1
- ↑ «Exploiting DNA mismatch repair deficiency as a therapeutic strategy». Experimental Cell Research. 329: 110–5. Novembro de 2014. PMID 25017099. doi:10.1016/j.yexcr.2014.07.004
- ↑ «PI3K/AKT/mTOR inhibitors for advanced or recurrent endometrial cancer». The Cochrane Database of Systematic Reviews. 10: CD012160. Outubro de 2019. PMC 6953296
 . PMID 31588998. doi:10.1002/14651858.cd012160.pub2
. PMID 31588998. doi:10.1002/14651858.cd012160.pub2 - ↑ «Adjuvant progestagens for endometrial cancer». The Cochrane Database of Systematic Reviews: CD001040. Junho de 2011. PMC 4238061
 . PMID 21678331. doi:10.1002/14651858.cd001040.pub2
. PMID 21678331. doi:10.1002/14651858.cd001040.pub2 - ↑ «Role of nuclear progesterone receptor isoforms in uterine pathophysiology». Human Reproduction Update. 21: 155–73. 2014. PMC 4366574
 . PMID 25406186. doi:10.1093/humupd/dmu056
. PMID 25406186. doi:10.1093/humupd/dmu056 - ↑ «Hormonal therapy in advanced or recurrent endometrial cancer». The Cochrane Database of Systematic Reviews: CD007926. Dezembro de 2010. PMC 4164823
 . PMID 21154390. doi:10.1002/14651858.cd007926.pub2
. PMID 21154390. doi:10.1002/14651858.cd007926.pub2 - ↑ «Endometrial cancer risk was lower in women who used continuous combined HRT than in non-users». Evidence-based Obstetrics & Gynecology. 8: 68–69. Março de 2006. ISSN 1361-259X. doi:10.1016/j.ebobgyn.2006.01.011
- ↑ a b «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 831 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ «Five Things Physicians and Patients Should Question». Choosing Wisely. Society of Gynecologic Oncology. 31 de outubro de 2013. Consultado em 27 de julho de 2014. Cópia arquivada em 1 de dezembro de 2013
- ↑ «Survival by stage of endometrial cancer». American Cancer Society. 2 de março de 2014. Consultado em 10 de junho de 2014. Cópia arquivada em 31 de julho de 2014
- ↑ a b «Follow-up practice in endometrial cancer and the association with patient and hospital characteristics: a study from the population-based PROFILES registry». Gynecologic Oncology. 129: 324–31. Maio de 2013. PMID 23435365. doi:10.1016/j.ygyno.2013.02.018
- ↑ «Exenterative surgery for recurrent gynaecological malignancies». The Cochrane Database of Systematic Reviews. 2: CD010449. Fevereiro de 2014. PMC 6457731
 . PMID 24497188. doi:10.1002/14651858.CD010449.pub2
. PMID 24497188. doi:10.1002/14651858.CD010449.pub2 - ↑ «Cardiovascular disease is the leading cause of death among endometrial cancer patients». Gynecologic Oncology. 126: 176–9. Agosto de 2012. PMID 22507532. doi:10.1016/j.ygyno.2012.04.013
- ↑ «Endometrial cancer and obesity: epidemiology, biomarkers, prevention and survivorship». Gynecologic Oncology. 114: 121–7. Julho de 2009. PMID 19406460. doi:10.1016/j.ygyno.2009.03.039
- ↑ «Obesity, diet, physical activity, and health-related quality of life in endometrial cancer survivors». Nutrition Reviews. 73: 399–408. Junho de 2015. PMC 4477700
 . PMID 26011914. doi:10.1093/nutrit/nuu063
. PMID 26011914. doi:10.1093/nutrit/nuu063 - ↑ «Endometrial Cancer». Williams Gynecology. McGraw-Hill 2nd ed. [S.l.: s.n.] 2012. 834 páginas. ISBN 978-0-07-171672-7 Cópia arquivada em 4 de Janeiro de 2014
- ↑ «General Information about Endometrial Cancer». Endometrial Cancer Treatment (PDQ). NIH. 23 de abril de 2014. Cópia arquivada em 20 de junho de 2014
- ↑ «PARP Inhibitors for BRCA1/2 mutation-associated and BRCA-like malignancies». Annals of Oncology. 25: 32–40. Janeiro de 2014. PMC 3868320
 . PMID 24225019. doi:10.1093/annonc/mdt384
. PMID 24225019. doi:10.1093/annonc/mdt384 - ↑ «PARP inhibitors in BRCA gene-mutated ovarian cancer and beyond». Current Oncology Reports. 13: 442–9. Dezembro de 2011. PMID 21913063. doi:10.1007/s11912-011-0193-9
- ↑ a b c d «Womb cancer research». CancerHelp UK. Cancer Research UK. Consultado em 31 de agosto de 2014. Cópia arquivada em 22 de agosto de 2014
- ↑ «Progestin intrauterine device and GnRH analogue for uterus-sparing treatment of endometrial precancers and well-differentiated early endometrial carcinoma in young women». Annals of Oncology. 22: 643–9. Março de 2011. PMID 20876910. doi:10.1093/annonc/mdq463
- ↑ «Interventions for weight reduction in obesity to improve survival in women with endometrial cancer». The Cochrane Database of Systematic Reviews. 2: CD012513. Fevereiro de 2018. PMC 6491136
 . PMID 29388687. doi:10.1002/14651858.CD012513.pub2. Consultado em 11 de novembro de 2020. Cópia arquivada em 8 de agosto de 2019
. PMID 29388687. doi:10.1002/14651858.CD012513.pub2. Consultado em 11 de novembro de 2020. Cópia arquivada em 8 de agosto de 2019 - ↑ Carlisle, Daloni (21 de setembro de 2014). «Womb cancer: the most common diagnosis you've never heard of». The Guardian. Consultado em 29 de setembro de 2014. Cópia arquivada em 22 de setembro de 2014
Ligações externas
[editar | editar código-fonte] Media relacionados com cancro do endométrio no Wikimedia Commons
Media relacionados com cancro do endométrio no Wikimedia Commons