Зарядовое число
 Из Википедии, бесплатной энциклопедии
Из Википедии, бесплатной энциклопедии

Заря́довое число́ атомного ядра (синонимы: а́томный но́мер, а́томное число́, поря́дковый но́мер химического элемента) — количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому номеру соответствующего ядра химического элемента в таблице Менделеева. Обычно обозначается буквой Z.
Термин «атомный» или «порядковый» номер обычно используется в атомной физике и в химии, тогда как эквивалентный термин «зарядовое число» — в ядерной физике. В неионизированном атоме количество электронов в электронных оболочках совпадает с зарядовым числом.
Ядра с одинаковым зарядовым числом, но различным массовым числом A (которое равно сумме числа протонов Z и числа нейтронов N) являются различными изотопами одного и того же химического элемента, поскольку именно заряд ядра определяет структуру электронной оболочки атома и, следовательно, его химические свойства. Более трёх четвертей химических элементов существует в природе в виде смеси изотопов (см. Моноизотопный элемент), и средняя изотопная масса изотопной смеси элемента (называемая относительной атомной массой) в определённой среде на Земле определяет стандартную атомную массу элемента (ранее использовалось название «атомный вес»). Исторически именно эти атомные веса элементов (по сравнению с водородом) были величинами, которые измеряли химики в XIX веке.
Поскольку протоны и нейтроны имеют приблизительно одинаковую массу (масса электронов пренебрежимо мала по сравнению с их массой), а дефект массы нуклонного связывания всегда мал по сравнению с массой нуклона, значение атомной массы любого атома, выраженной в атомных единицах массы, находится в пределах 1 % от целого числа А.
История
[править | править код]Периодическая таблица и порядковые номера для каждого элемента
[править | править код]
Поиски основы естественной классификации и систематизации химических элементов, основанной на связи их физических и химических свойств с атомным весом, предпринимались на протяжении длительного времени. В 1860-х годах появился ряд работ, связывающих эти характеристики — спираль Шанкуртуа, таблица Ньюлендса, таблицы Одлинга и Мейера, но ни одна из них не давала однозначного исчерпывающего описания закономерности. Сделать это удалось русскому химику Д. И. Менделееву. 6 марта 1869 года (18 марта 1869 года) на заседании Русского химического общества было зачитано сообщение Менделеева об открытии им Периодического закона химических элементов[1], а вскоре его статья «Соотношение свойств с атомным весом элементов» была опубликована в «Журнале Русского физико-химического общества»[2]. В том же году вышло первое издание учебника Менделеева «Основы химии», где была приведена его периодическая таблица. В статье, датированной 29 ноября 1870 года (11 декабря 1870 года), опубликованной в «Журнале Русского химического общества» под названием «Естественная система элементов и применение её к указанию свойств неоткрытых элементов», Менделеев впервые употребил термин «периодический закон» и указал на существование нескольких не открытых ещё элементов[3].
В своих работах Менделеев расположил элементы в порядке их атомных весов, но при этом сознательно допустил отклонение от этого правила, поместив теллур (атомный вес 127,6) впереди иода (атомный вес 126,9)[4], объясняя это химическими свойствами элементов. Такое размещение элементов правомерно с учётом их зарядового числа Z, которое было неизвестно Менделееву. Последующее развитие атомной химии подтвердило правильность догадки учёного.
Модели атома Резерфорда-Бора и Ван ден Брука
[править | править код]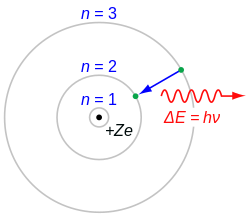
В 1911 году британский физик Эрнест Резерфорд предложил модель атома, согласно которой в центре атома расположено ядро, содержащее бо́льшую часть массы атома и положительный заряд, который в единицах заряда электрона должен был быть равен примерно половине атомного веса атома, выраженного в числе атомов водорода. Резерфорд сформулировал свою модель на основе данных об атоме золота (Z = 79, A = 197), и, таким образом, получалось, что у золота должен быть заряд ядра около 100 (в то время как порядковый номер золота в периодической таблице 79). Через месяц после выхода статьи Резерфорда голландский физик-любитель Антониус ван ден Брук впервые предположил, что заряд ядра и число электронов в атоме должны быть точно равны его порядковому номеру в периодической таблице (он же — атомный номер, обозначаемый Z). Эта гипотеза в конечном счёте подтвердилась.
Но с точки зрения классической электродинамики, в модели Резерфорда электрон, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы разрешить эту проблему, в 1913 году датский физик Нильс Бор предложил свою модель атома. Бор ввёл допущение, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых, они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. При этом стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка[5]: .
Эксперименты Мозли 1913 года и «пропавшие» химические элементы
[править | править код]В 1913 году британский химик Генри Мозли после дискуссии с Н.Бором решил проверить гипотезы Ван ден Брука и Бора на эксперименте[6]. Для этого Мозли измерил длины волн спектральных линий фотонных переходов (линии K и L) в атомах алюминия (Z = 13) и золота (Z = 79), использовавшихся в качестве серии мишеней внутри рентгеновской трубки[7]. Квадратный корень частоты этих фотонов (рентгеновских лучей) увеличивался от одной цели к другой в арифметической прогрессии. Это привело Мозли к заключению (закон Мозли), что значение атомного номера почти соответствует (в работе Мозли — со смещением на одну единицу для K-линий) вычисленному электрическому заряду ядра, то есть величине Z. Среди прочего эксперименты Мозли продемонстрировали, что ряд лантаноидов (от лантана до лютеция включительно) должен содержать ровно 15 элементов — не меньше и не больше, что было далеко не очевидно для химиков того времени.
После смерти Мозли в 1915 году его методом были исследованы атомные номера всех известных элементов от водорода до урана (Z = 92). Было обнаружено, что в периодической таблице отсутствуют семь химических элементов (с Z < 92), которые были идентифицированы как ещё не открытые, с атомными номерами 43, 61, 72, 75, 85, 87 и 91[8]. Все эти семь «пропавших» элементов были обнаружены в период с 1918 по 1947 год: технеций (Z = 43), прометий (Z = 61), гафний (Z = 72), рений (Z = 75), астат (Z = 85), франций (Z = 87) и протактиний (Z = 91)[8]. К этому времени также были обнаружены первые четыре трансурановых элемента, поэтому периодическая таблица была заполнена без пробелов до кюрия (Z = 96).
Протон и гипотеза «ядерных электронов»
[править | править код]
К 1915 году в научном сообществе сложилось понимание того факта, что зарядовые числа Z, они же — порядковые номера элементов, должны быть кратны величине заряда ядра атома водорода, но не было объяснения причин этого. Сформулированная ещё в 1816 году гипотеза Праута предполагала, что водород является некоей первичной материей, из которой путём своего рода конденсации образовались атомы всех других элементов и, следовательно, атомные веса всех элементов, равно как и заряды их ядер, должны измеряться целыми числами. Но в 1907 году опыты Резерфорда и Ройдса[англ.] показали, что альфа-частицы с зарядом +2 являются ядрами атомов гелия, масса которых превышает массу водорода в четыре, а не в два раза. Если гипотеза Праута верна, то что-то должно было нейтрализовать заряды ядер водорода, присутствующие в ядрах более тяжёлых атомов.
В 1917 году (в экспериментах, результаты которых были опубликованы в 1919 и 1925 годах), Резерфорд доказал, что ядро водорода присутствует в других ядрах; этот результат обычно интерпретируют как открытие протонов[9]. Эти эксперименты начались после того, как Резерфорд заметил, что, когда альфа-частицы были выброшены в воздух (в основном состоящий из азота), детекторы зафиксировали следы типичных ядер водорода. После экспериментов Резерфорд проследил реакцию на азот в воздухе и обнаружил, что когда альфа-частицы вводятся в чистый газообразный азот, эффект оказывается больше. В 1919 году Резерфорд предположил, что альфа-частица выбила протон из азота, превратив его в углерод. После наблюдения изображений камеры Блэкетта в 1925 году Резерфорд понял, что произошло обратное: после захвата альфа-частицы протон выбрасывается, поэтому тяжёлый кислород, а не углерод, является конечным результатом, то есть Z не уменьшается, а увеличивается. Это была первая описанная ядерная реакция: 14N + α → 17O + p.
Резерфорд назвал новые тяжёлые ядерные частицы протонами в 1920 году (предлагались альтернативные названия — «прутоны» и «протилы»). Из работ Мозли следовало, что ядра тяжёлых атомов имеют более чем вдвое большую массу, чем можно было бы ожидать при условии, что они состоят только из ядер водорода, и поэтому требовалось объяснение для «нейтрализации» предполагаемых дополнительных протонов, присутствующих во всех тяжёлых ядрах. В связи с этим была выдвинута гипотеза о так называемых «ядерных электронах». Так, предполагалось, что ядро гелия состоит из четырёх протонов и двух «ядерных электронов», нейтрализующих заряд двух протонов. В случае золота с атомной массой 197 и зарядом 79, ранее рассмотренном Резерфордом, предполагалось, что ядро атома золота содержит 118 этих «ядерных электронов».
Открытие нейтрона и его значение
[править | править код]Несостоятельность гипотезы «ядерных электронов» стала очевидной после открытия нейтрона[англ.] Джеймсом Чедвиком в 1932 году[10]. Наличие нейтронов в ядрах атомов легко объясняло расхождение между атомным весом и зарядным числом атома: так, в атоме золота содержится 118 нейтронов, а не 118 ядерных электронов, а положительный заряд ядра полностью состоит из 79 протонов. Таким образом, после 1932 года атомный номер элемента Z стал рассматриваться как число протонов в его ядре.
Символ Z
[править | править код]Зарядовое число обычно обозначается буквой Z, от нем. atomzahl — «атомное число», «атомный номер»[11] Условный символ Z, вероятно, происходит от немецкого слова Atomzahl (атомный номер)[12], обозначающего число, которое ранее просто обозначало порядковое место элемента в периодической таблице и которое приблизительно (но не точно) соответствовало порядку элементов по возрастанию их атомных весов. Только после 1915 года, когда было доказано, что число Z является также величиной заряда ядра и физической характеристикой атома, немецкое слово Atomzahl (и его английский эквивалент англ. Atomic number) стали широко использоваться в этом контексте.
Химические свойства
[править | править код]Каждый элемент обладает определённым набором химических свойств как следствие количества электронов, присутствующих в нейтральном атоме, которое представляет собой Z (атомный номер). Конфигурация электронов в атоме следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим его химические связи. Следовательно, только атомный номер определяет химические свойства элемента, и именно поэтому элемент может быть определён как состоящий из любой смеси атомов с данным атомным номером.
Новые элементы
[править | править код]
При поиске новых элементов исследователи руководствуются представлениями об зарядовых числах этих элементов. По состоянию на конец 2019 года были обнаружены все элементы с зарядовыми числами от 1 до 118. Синтез новых элементов осуществляется путём бомбардировки атомов-мишеней тяжёлых элементов ионами таким образом, что сумма зарядовых чисел атома-мишени и иона-«снаряда» равна зарядовому числу создаваемого элемента. Как правило, период полураспада элемента становится короче с увеличением атомного номера, хотя для неизученных изотопов с определённым числом протонов и нейтронов могут существовать так называемые «острова стабильности»[13].
См. также
[править | править код]- Атомная теория
- Гипотеза Праута
- Химический элемент
- Периодическая таблица химических элементов
- Список химических элементов
Примечания
[править | править код]- ↑ Трифонов Д. Н. Несостоявшееся выступление Менделеева (6 (18) марта 1869 г.) Архивная копия от 18 марта 2014 на Wayback Machine // Химия, № 04 (699), 16-28.02.2006
- ↑ Менделеев Д. И. Соотношение свойств с атомным весом элементов // Журнал Русского химического общества. — 1869. — Т. I. — С. 60—77. Архивировано 18 марта 2014 года.
- ↑ Менделеев Д. И. Естественная система элементов и применение её к указанию свойств неоткрытых элементов // Журнал Русского химического общества. — 1871. — Т. III. — С. 25—56. Архивировано 17 марта 2014 года.
- ↑ Периодический закон химических элементов // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 185. — ISBN 5-7155-0292-6.
- ↑ Планетарная модель атома. Постулаты Бора Архивная копия от 21 февраля 2009 на Wayback Machine на Портале Естественных Наук Архивная копия от 26 ноября 2009 на Wayback Machine
- ↑ Ordering the Elements in the Periodic Table Архивная копия от 4 марта 2016 на Wayback Machine, Royal Chemical Society
- ↑ Moseley H. G. J. XCIII. The high-frequency spectra of the elements (англ.) // Philosophical Magazine, Series 6. — 1913. — Vol. 26, no. 156. — P. 1024. — doi:10.1080/14786441308635052. Архивировано 22 января 2010 года.
- ↑ 1 2 Scerri E. A tale of seven elements (англ.). — Oxford University Press, 2013. — P. 47. — ISBN 978-0-19-539131-2.
- ↑ Petrucci R. H., Harwood W. S., Herring F. G. General Chemistry (англ.). — 8th ed.. — Upper Saddle River, N.J.: Prentice Hall, 2002. — P. 41.
- ↑ Chadwick J. Existence of a Neutron (англ.) // Proceedings of the Royal Society A. — 1932. — Vol. 136, no. 830. — P. 692—708. — doi:10.1098/rspa.1932.0112. — .
- ↑ General Chemistry Online: FAQ: Atoms, elements, and ions: Why is atomic number called "Z"? Why is mass number called "A"? antoine.frostburg.edu. Дата обращения: 8 марта 2019. Архивировано 16 января 2000 года.
- ↑ Origin of symbol Z Архивная копия от 16 января 2000 на Wayback Machine. frostburg.edu
- ↑ Остров Стабильности за пределами таблицы Менделеева. Дата обращения: 29 ноября 2019. Архивировано 21 ноября 2018 года.
