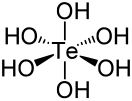
Теллуровая кислота
 Из Википедии, бесплатной энциклопедии
Из Википедии, бесплатной энциклопедии
| Теллуровая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | Теллуровая кислота | ||
| Традиционные названия | Ортотеллуровая кислота | ||
| Хим. формула | H6TeO6 | ||
| Рац. формула | H6O6Te | ||
| Физические свойства | |||
| Молярная масса | 229,64 г/моль | ||
| Плотность | 3,07 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 136 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 19,7 г в 100 г (0°C) | ||
| Классификация | |||
| Рег. номер CAS | 7803-68-1 | ||
| PubChem | 62686 | ||
| Рег. номер EINECS | 232-267-6 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 30461 | ||
| ChemSpider | 56436 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Теллуровая кислота — слабая многоосновная неорганическая кислота состава H6TeO6 (H2TeO4•2H2O), соответствующая высшей степени окисления теллура (+6).
Физические свойства
[править | править код]Бесцветные кристаллы, растворимые в воде, не растворяются в концентрированной азотной кислоте.
Получение
[править | править код]Получают взаимодействием элементарного теллура с 30%-м раствором перекиси водорода при нагревании на водяной бане. При температуре ниже 10 °С выделяется из раствора в виде кристаллогидрата H6TeO6•4H2O. Соли теллуровой кислоты могут быть получены растворением оксида теллура(VI) в концентрированных растворах щелочей либо сплавлением теллуритов с КNО3[1].
Химические свойства
[править | править код]Слабая кислота; К1 = 2•10−8, К2 = 1•10−11. Относительно неустойчива; при нагревании до 140 °С образует аллотеллуровую кислоту — вязкую хорошо смешивающуюся с водой жидкость, представляющую собой, по-видимому, раствор смеси полимерных теллуровых кислот.
Выше 200°С распадается на оксид теллура(VI) и воду:
Соли теллуровой кислоты — теллураты. На металл могут замещаться все атомы водорода, поэтому известны как частично (Na2H4TeO6), так и полностью замещённые (Na6TeO6) производные. При сплавлении с гидроксидом натрия образует ортотеллурат натрия Na6TeO6:
На влажном воздухе Na6TeO6постепенно превращается в кислую соль Na2H4TeO6•3H2O.
Ссылки
[править | править код]Примечания
[править | править код]- ↑ Некрасов Б. В. Основы общей химии. Т. 1, изд. 3-е, испр. и доп. — М: Химия, 1973. С. 362—363.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |