Хлорид иттрия
 Из Википедии, бесплатной энциклопедии
Из Википедии, бесплатной энциклопедии
| Хлорид иттрия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Хлорид иттрия |
| Традиционные названия | Хлористый иттрий |
| Хим. формула | YCl3 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 195,27 г/моль |
| Плотность | 2,8 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 721; 857 °C |
| • кипения | 1482 °C |
| Мол. теплоёмк. | 92,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1000 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 75,125; 78,180 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10361-92-9 |
| PubChem | 66318 |
| Рег. номер EINECS | 233-801-0 |
| SMILES | |
| InChI | |
| RTECS | ZG3150000 |
| ChEBI | 63020 |
| ChemSpider | 59696 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид иттрия — бинарное неорганическое соединение, соль металла иттрия и соляной кислоты с формулой YCl3, бесцветные кристаллы, растворимые в воде, образует кристаллогидраты.
Получение[править | править код]
- Действие хлора на металлический иттрий:
- Действие хлора на оксид иттрия в присутствии восстановителя:
- Реакция соляной кислоты с металлическим иттрием, оксидом, гидроксидом или сульфидом иттрия:
Физические свойства[править | править код]
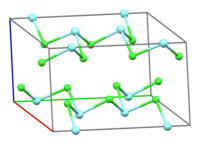
Хлорид иттрия образует бесцветные кристаллы моноклинной сингонии, пространственная группа C 2/m, параметры ячейки a = 0,692 нм, b = 1,192 нм, c = 0,633 нм, β = 111,0°, Z = 4.
Хорошо растворяется в воде и этаноле. Не растворяется в диэтиловом эфире.
Образует кристаллогидраты состава YCl3•H2O и YCl3•6H2O.
Химические свойства[править | править код]
- Безводную соль получают сушкой кристаллогидрата в атмосфере сухого хлористого водорода:
- При нагревании кристаллогидрат разлагается:
- Реагирует с водой при кипячении:
- Реагирует с щелочами:
- Вступает в обменные реакции:
- Иттрий вытесняется из хлорида щелочными металлами:
- С хлоридами некоторых металлов образует комплексные соли:
Применение[править | править код]
- Используется для очистки иттрия.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |






![{\displaystyle {\mathsf {YCl_{3}\cdot 6H_{2}O\ {\xrightarrow[{-H_{2}O}]{100^{o}C}}\ YCl_{3}\cdot H_{2}O\ {\xrightarrow[{-H_{2}O}]{160^{o}C,HCl}}\ YCl_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/205ebef97af670628c007d507ce5373bc2509b26)







