Главный комплекс гистосовместимости
 Из Википедии, бесплатной энциклопедии
Из Википедии, бесплатной энциклопедии
| Главный комплекс гистосовместимости | |
|---|---|
| Каталоги | |




Главный комплекс гистосовместимости (ГКГС, или ГКГ, англ. MHC, major histocompatibility complex) — большая область генома или большое семейство генов, обнаруженное у позвоночных и играющее важную роль в иммунной системе и развитии иммунитета. Название «комплекс гистосовместимости» эта область получила потому, что обнаружена она была при исследовании отторжения чужеродных тканей. Изучение свойств и функций продуктов генов MHC показало, что отторжение трансплантата организмом при несовпадении их MHC является экспериментальным артефактом, маскирующим истинную функцию MHC — презентацию антигена лимфоцитам для распознавания и удаления собственных изменённых клеток.
Эволюционно MHC возник 450 миллионов лет назад вместе с появлением челюстноротых рыб (лат. Gnathostomata). Если у бесчелюстных приобретённый иммунитет основан на вариабельных лимфоцитарных рецепторах (VLR[англ.]), Т-подобных и В-подобных рецепторах, то у челюстноротых появились иммуноглобулины (Ig), Т-клеточные рецепторы (TCR) и MHC[1].
История
[править | править код]Первое описание MHC было сделано в середине XX века. В частности, Георгом Снеллом была обнаружена на 17-й хромосоме мышей большая группа генов, кодирующих белки, определяющие совместимость тканей и органов при их пересадке, что позволило объяснить отторжение пересаженной кожи, если донор и реципиент имеют разные варианты (аллели) MHC. Вскоре такие же гены были найдены Жаном Доссе у людей, он же вскоре описал первый лейкоцитарный антиген человека — молекулу белка, которую мы сейчас называем HLA-A2[2]. Позднее Барух Бенасерраф продемонстрировал на морских свинках, что гены MHC не только определяют индивидуальность организма, но модулируют иммунный ответ. За эти исследования в 1980 году этим трём учёным была присуждена Нобелевская премия по Медицине и Физиологии «за открытие генетически определённых структур на поверхности клеток, определяющих иммунную реакцию».
В 1974 году Рольф Зинкернагель и Питер Дохерти продемонстрировали, что цитолитический Т-лимфоцит распознает комбинацию вируса и MHC класса I молекулы хозяина, а тот же самый лимфоцит не распознает клетку, заражённую тем же вирусом, если она имеет другой аллель полиморфной MHC-I[3]. За эту работу Нобелевский комитет присудил Зинкернагелю и Дохерти Нобелевскую премию по Физиологии и Медицине в 1996 году. Через 10 лет после публикации Зинкернагеля и Дохерти стало ясно, что Т-клеткам нужен не весь вирус, даже не весь вирусный белок, антигеном является маленький пептид, получаемый при протеазном расщеплении вирусного белка[4]. Через два года после этого постдок Дона Уайли[англ.] Памела Бьоркман определила первую трехмерную структуру молекулы HLA-A2[5].
Гены
[править | править код]Главный комплекс гистосовместимости является регионом с одной из самых высоких плотностей локализации генов. У человека 1 ген приходится на 18000 пар нуклеотидов[6]. Но еще плотнее расположены MHC у птиц. У курицы средний размер интронов в MHC-локусе составляет 200 оснований, а расстояние между генами, включая промоторы, может быть всего 30 оснований, что приводит к среднему размеру гена кур в три раза меньше, чем размер аналогичных генов млекопитающих[7].
У человека область MHC исторически называется человеческий лейкоцитарный антиген (англ. HLA, Human Leucocyte Antigen), поскольку открыта она была при изучении различий клеток белой крови у разных людей, у свиней она носит название SLA (Swine Leucocyte Antigen), у собак DLA, у коров BoLA, у мышей — область H-2, у крыс — RT1, у кур — B, и т. д. У разных организмов они находятся на разных хромосомах, имеют разную длину и включают разное число генов, но общее устройство у всех похоже. Самая изученная MHC-область — человеческая HLA, находится на коротком плече хромосомы 6 между генетическими маркерами MOG и COL11A2 и составляет около 4 млн пар нуклеотидов (6р21.1-21.3). HLA содержит более 200 генов, многие из которых чрезвычайно полиморфны. Не все эти гены связаны с иммунитетом, у человека лишь 40 % генов HLA кодируют белки, вовлеченные в иммунный ответ[6]. И наоборот, есть много белков иммунной системы, чьи гены расположены на других хромосомах, например, гены Т-клеточного рецептора находятся на хромосоме 14, гены интерферонов на хромосомах 9 и 12 и т. д.
В HLA выделяют три подобласти; если считать от теломеры, то сначала идет область, называемая класс I, затем класс III и класс II. У других организмов последовательность классов может быть другой. У рыб класс II вообще находится на другой хромосоме[8].
Два набора генов, класса I и II, кодирующие так называемые MHC класс I и MHC класс II молекулы, являются центральными игроками клеточного иммунитета. Основная функция MHC-I и MHC-II молекул — связывание пептидных фрагментов, полученных при внутриклеточном расщеплении белковых молекул, и презентация этих пептидов на поверхности клеток для распознавания Т- и NK- клеточными рецепторами. В большинстве своем это пептиды собственных белков, если же в организм попал патоген, то на поверхности клеток будут присутствовать и пептиды из чужих белков. Несмотря на то, что доля чужих пептидов на клеточной поверхности очень мала (одна молекула на десятки и сотни тысяч своих пептидов), такие зараженные клетки быстро распознаются Т-лимфоцитами и разрушаются иммунной системой. Презентация собственных белков на поверхности клеток чрезвычайно важна, иммунная система постоянно отслеживает и уничтожает не только инфицированные, но и поврежденные или измененные клетки[9][10].
Два свойства белков MHC являются очень важными при использования их в приобретённом иммунитете. Во-первых, полигенность: каждый организм имеет несколько генов MHC. Так, например, у каждого человека есть три гена комплекса MHC-I, HLA-A, HLA-B и HLA-C. Во-вторых, полиморфность — в популяции существует множество вариантов каждого гена, так для HLA-A на 2020 год известно 5907 аллелей, кодирующих 3702 разных белковых молекул. Просмотреть все описанные варианты молекул HLA можно в базе данных IMGT (www.imgt.org).
Наряду с классическими молекулами MHC-I, HLA-A, HLA-B и HLA-C в области класс I есть гены так называемых неклассических комплексов HLA: MICA[англ.], MICB[англ.], HLA-E[англ.], HLA-F[англ.] и HLA-G[англ.], отличающихся от классических меньшей полиморфностью и меньшим уровнем экспрессии. MICA (MHC class I polypeptide-related sequence A) кодирует мембранно-связанный гликопротеин, чья экспрессия вызывается стрессом — температурой, вирусной или бактериальной инфекцией, онкогенной трансформацией и пр.[11] MICA является самым полиморфным из неклассических HLA, у человека описано более 150 вариантов (IMGT). MICA является лигандом рецептора CD94/NKG2D, который экспрессируется на NK-клетках и некоторых Т-лимфоцитах. При связывании с MICA CD94/NKG2D активирует цитолитическую активность этих клеток. Таким образом, MICA является сигналом иммунной системе на раннюю реакцию в ответ на инфекцию или спонтанное возникновение модифицированных раковых клеток. HLA-E связывает обычно сигнальные пептиды классических HLA-A, B и C и служит лигандом NK-клеточных рецепторов CD94/NKG2A или CD94/NKG2B, ингибируя их цитотоксическую активность[12]. HLA-G экспрессируется только на зародышевых клетках плаценты, играя важную роль в иммунотолерантности при беременности[13].
В отличие от комплексов MHC-I, белки MHC-II экспрессируются исключительно в так называемых профессиональных антиген-презентирующих клетках (англ. APC). К ним относятся дендритные клетки, В-клетки и макрофаги. MHC-II — гетеродимеры, гены обеих цепей принадлежат MHC-локусу. Шесть генов человеческих MHC-II носят названия HLA-DRA (B), HLA-DQA (B) и HLA-DPA (B).
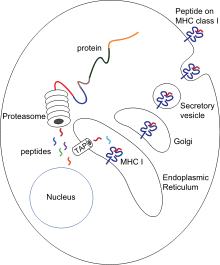
Кроме MHC-I и MHC-II в этом же локусе расположены гены других белков, участвующих в презентации антигена. Два гена каталитической β-субъединицы протеосомы, PSMB8 и PSMB9 начинают экспрессироваться только в том случае, если клетка получила сигнал о наличии в среде гамма-интерферона. Замена каталитических субъединиц превращает протеосому в иммунопротеосому с изменённой протеолитической специфичностью. Иммунопротеосома выпускает пептиды с гидрофобной или основной аминокислотой на С-конце, имеющие большее сродство к MHC-I[14].
Рядом с PSMB8 и PSMB9 находятся гены TAP1 и TAP2, кодирующие два субъединицы транспортера пептидов через мембрану эндоплазматического о. TAP1 и TAP2 не только переносят пептиды в ЭР, но и помогают им связаться с MHC-I. В этом им помогает тапазин, чей ген TAPBP тоже находится в области класс II геномного локуса HLA.
Пептиды комплекса MHC-II получаются из лизосомального, а не протеосомного расщепления. Ген HLA-DM кодирует белок DM, который катализирует связывание пептидов с MHC-II. Рядом находится HLA-DO, ген отрицательного регулятора HLA-DM.
Локус HLA содержит также гены трёх цитокинов семейства фактора некроза опухоли, TNF, гены белков системы комплемента (C2, C4а, C4b, CFB) и много других генов, чьи продукты не связаны напрямую с иммунной системой, например, CYP21P — один из цитохромов Р450, POU5F1 и TCF19 — факторы транскрипции, AGER — регулятор многих клеточных процессов, Hsp70 и т. д.
Описание MHC человека с полным секвенированием и аннотацией генов было опубликовано в 1999 году в журнале Nature центрами секвенирования Великобритании, США и Японии[6]. Представленная последовательность называлась виртуальной MHC, поскольку это была мозаика, составленная из кусков генома людей с разными гаплотипами.
В том же номере журнала Nature было опубликовано описание куриной MHC, которая в 20 раз короче человеческой и включает только 19 генов[7]. B-локус кур имеет все признаки MHC: там расположены гены классических MHC-I и MHC-II молекул, он определяет тканевую специфичность и иммунный ответ. MHC-локус кур гораздо компактнее человеческого, центральная его область от гена класс II до гена класс I молекул имеет всего 44 000 оснований, хотя содержит 11 генов. Порядок генов другой, класс I и класс II области не разделены длинной класс III областью. Почти все гены B-локуса кур имеют ортологов у млекопитающих, но много генов, имеющихся в MHC-областях млекопитающих, отсутствуют у кур. В B-области кур есть всего два гена молекул MHC-I и MHC-II, отсутствуют DN и DOB, нет генов каталитических субъединиц протеасом, ген неполиморфной субъединицы MHC-II, class IIa находится вне B-локуса. Зато присутствуют гены лектина и NK-рецептора, которые у млекопитающих находятся на другой хромосоме.
Секвенирование MHC-локуса перепелов[8] показало похожую, но более сложную организацию, из-за нескольких дупликаций. Так у перепелов есть семь генов молекул MHC класс I, семь генов b-цепи MHC класс II и 8 BG-подобных генов.
Секвенированы MHC-локусы нескольких рыб[8]. У всех у них класс II и класс I области не связаны между собой и находятся на разных хромосомах. В отличие от птиц, рыбы, как и млекопитающие, имеют в MHC-области гены каталитических субъединиц протеасом, но они расположены в области класс I, вместе с генами транспортера TAP, TAPBP. Количество генов классических MHC у разных рыб разное, например, у фугу девять генов молекул MHC класс I, а у данио их только три.
База данных IMGT (International Immunogenetics information system) содержит информацию о нуклеотидных последовательностях MHC-локусов 77 разных видов (по состоянию на 2019-12-19).
Белки
[править | править код]MHC-I
[править | править код]Белковая молекула MHC-I — гетеродимер, состоящий из инвариантной малой субъединицы, называемой β2-микроглобулин, и тяжёлой полиморфной α-субъединицы, кодируемой одним из генов класса I локуса MHC (у человека — HLA-A, HLA-B или HLA-C). α-цепь MHC-I содержит 365 аминокислот. 284 N-концевых остатка образуют экстра-клеточную часть молекулы, следующая за ними трансмембранная спираль удерживают MHC-I на поверхности клетки, а последние 32 аминокислоты, расположенные в цитозоле, отвечают за внутриклеточный транспорт MHC-I из эндоплазматического ретикулума на поверхность[15] . Кристаллографический анализ показал, что внеклeточная область α-цепи MHC-I делится на три домена α1, α2 и α3, каждый по 90 аминокислот. α1 и α2 домены образуют антиген-связывающую часть MHC-I[5]. Антигеном для MHC-I являются пептиды длиной 8—10 аминокислот. α3 домен имеет иммуноглобулиновую укладку, такую же как соседний β2-микроглобулин, эти два иммуноглобулиновых домена отделяют пептид-связывающую область от клеточной мембраны. α1 и α2 домены имеют одинаковую третичную структуру из четырёх антипараллельных β-стрендов и длинной α-спирали, лежащей сверху. Вся α1 — α2 конструкция напоминает плоскодонку, дно которой образовано восемью β-стрендами, а борта α-спиралями. Внутри этой плоскодонки размещается пептид, напоминая команду гребцов из 8—10 участников. Пептид имеет протяжённую конформацию, так что в отличие от команды гребцов, боковые цепи соседних аминокислот будут направлены в разные стороны. Часть из них будет направлена вниз, связываясь в карманах дна пептидо-связывающего желоба MHC-I. Разные MHC-I имеют разные карманы, определяя пептидную специфичность каждого аллеля[16]. Например, HLA-A2 имеет небольшие гидрофобные карманы для остатков 2 и 9, и положительно-заряженный карман для остатка 4, поэтому HLA-A2 связывает пептиды, имеющие Leu/Met в положении 2, Asp/Glu в положении 4 и Val/Leu в положении 9. А вот аллель HLA-B27 связывает пептиды с Arg на втором месте, Phe/Trp/Tyr на третьем и Leu/Phe на девятом. Посмотреть мотивы пептидов для разных аллелей можно на сервере MHCMotifViewer. Остатки пептида, смотрящие вверх, будут взаимодействовать с Т-клеточным рецептором, как и несколько остатков самой MHC, опреляя двойную специфичность этого рецептора, патогенного пептида и данного аллеля MHC хозяина.
Если карманы определяют специфичность пептида, то главную роль в его связывании с MHC-I играет основная цепь, включая N- и C-концы, которые у 99 % пептидов погружены в дно желоба и закрыты остатками спиралей от окружения. Поэтому длинные пептиды обычно имеют выпячивание в центре, так как их концы удерживаются в том же месте, что и у более коротких пептидов[17].
MHC-II
[править | править код]MHC-II молекулы имеют точно такую же доменную организацию, как и MHC-I, но их четыре домена расположены на двух полиморфных субъединицах примерно одинакового размера. Как α-, так и β-субъединицы имеют α1 (или β1) домен, образующий половину антиген-связывающего участка и иммуноглобулиновый домен α2 (β2), расположенный ближе к клеточной мембране[18]. Обе цепи имеют трансмембранную спираль и короткий цитоплазматический конец в 12—18 аминокислот. Трехмерная структура внеклеточных частей MHC обоих классов очень похожа, пептид также связывается в жёлобе между двумя спиралями. Основное отличие состоит в том, что спирали, образующие стенки антиген-связывающего желоба MHC-II, не подходят близко друг к другу, и жёлоб оказывается открыт с обоих концов. По этой причине, ни N-, ни C-концы пептида не принимают особого участия в связывании с MHC-II, более того, часто наблюдают, что они свешиваются наружу[19], что хорошо коррелирует с тем фактом, что антигены MHC-II гораздо длиннее, чем у MHC-I.
ГКГ и выбор сексуального партнёра
[править | править код]Ряд независимых исследований 1970—1990-х гг. показали, что на выбор полового партнёра влияет главный комплекс гистосовместимости. Эксперименты, проведённые первоначально на мышах и рыбах[20], затем на добровольных участниках-людях, показали, что женщины имели склонность выбирать партнёров с ГКГ, отличным от собственного, однако их выбор менялся на противоположный в случае использования гормональных оральных контрацептивов — в этом случае женщины скорее выбирали партнёра с подобным ГКГ[21][22][23].
См. также
[править | править код]- Иммунная система
- Человеческий лейкоцитарный антиген
- Презентация антигенa
- MHC class I[англ.]
- MHC class II[англ.]
- ГКГС III класса
- Т-клеточный рецептор
Примечания
[править | править код]- ↑ Nicole C. Smith, Matthew L. Rise, Sherri L. Christian. A Comparison of the Innate and Adaptive Immune Systems in Cartilaginous Fish, Ray-Finned Fish, and Lobe-Finned Fish // Frontiers in Immunology. — 2019-10-10. — Т. 10. — С. 2292. — ISSN 1664-3224. — doi:10.3389/fimmu.2019.02292.
- ↑ J. Dausset. [Iso-leuko-antibodies] // Acta Haematologica. — 1958-07. — Т. 20, вып. 1—4. — С. 156–166. — ISSN 0001-5792. — doi:10.1159/000205478. Архивировано 3 июля 2016 года.
- ↑ R. M. Zinkernagel, P. C. Doherty. Restriction of in vitro T cell-mediated cytotoxicity in lymphocytic choriomeningitis within a syngeneic or semiallogeneic system // Nature. — 1974-04-19. — Т. 248, вып. 5450. — С. 701–702. — ISSN 0028-0836. — doi:10.1038/248701a0. Архивировано 8 апреля 2016 года.
- ↑ A. R. Townsend, F. M. Gotch, J. Davey. Cytotoxic T cells recognize fragments of the influenza nucleoprotein // Cell. — 1985-09. — Т. 42, вып. 2. — С. 457–467. — ISSN 0092-8674. — doi:10.1016/0092-8674(85)90103-5. Архивировано 17 апреля 2020 года.
- ↑ 1 2 P. J. Bjorkman, M. A. Saper, B. Samraoui, W. S. Bennett, J. L. Strominger. Structure of the human class I histocompatibility antigen, HLA-A2 // Nature. — 1987 Oct 8-14. — Т. 329, вып. 6139. — С. 506–512. — ISSN 0028-0836. — doi:10.1038/329506a0. Архивировано 13 сентября 2019 года.
- ↑ 1 2 3 Complete sequence and gene map of a human major histocompatibility complex. The MHC sequencing consortium // Nature. — 1999-10-28. — Т. 401, вып. 6756. — С. 921–923. — ISSN 0028-0836. — doi:10.1038/44853. Архивировано 14 июля 2019 года.
- ↑ 1 2 J. Kaufman, S. Milne, T. W. Göbel, B. A. Walker, J. P. Jacob. The chicken B locus is a minimal essential major histocompatibility complex // Nature. — 1999-10-28. — Т. 401, вып. 6756. — С. 923–925. — ISSN 0028-0836. — doi:10.1038/44856. Архивировано 19 марта 2015 года.
- ↑ 1 2 3 Jerzy K. Kulski, Takashi Shiina, Tatsuya Anzai, Sakae Kohara, Hidetoshi Inoko. Comparative genomic analysis of the MHC: the evolution of class I duplication blocks, diversity and complexity from shark to man // Immunological Reviews. — 2002-12. — Т. 190. — С. 95–122. — ISSN 0105-2896. — doi:10.1034/j.1600-065x.2002.19008.x. Архивировано 11 ноября 2016 года.
- ↑ Klas Kärre. Natural killer cell recognition of missing self // Nature Immunology. — 2008-05. — Т. 9, вып. 5. — С. 477–480. — ISSN 1529-2916. — doi:10.1038/ni0508-477. Архивировано 2 августа 2013 года.
- ↑ Kenneth L. Rock, Eric Reits, Jacques Neefjes. Present Yourself! By MHC Class I and MHC Class II Molecules // Trends in Immunology. — 11 2016. — Т. 37, вып. 11. — С. 724–737. — ISSN 1471-4981. — doi:10.1016/j.it.2016.08.010.
- ↑ Dan Chen, Ulf Gyllensten. MICA polymorphism: biology and importance in cancer // Carcinogenesis. — 2014-12. — Т. 35, вып. 12. — С. 2633–2642. — ISSN 1460-2180. — doi:10.1093/carcin/bgu215. Архивировано 3 мая 2017 года.
- ↑ Alexander Rölle, Dirk Jäger, Frank Momburg. HLA-E Peptide Repertoire and Dimorphism-Centerpieces in the Adaptive NK Cell Puzzle? // Frontiers in Immunology. — 2018. — Т. 9. — С. 2410. — ISSN 1664-3224. — doi:10.3389/fimmu.2018.02410.
- ↑ Gry Persson, Nanna Jørgensen, Line Lynge Nilsson, Lærke Heidam J. Andersen, Thomas Vauvert F. Hviid. A role for both HLA-F and HLA-G in reproduction and during pregnancy? // Human Immunology. — 2019-09-24. — ISSN 1879-1166. — doi:10.1016/j.humimm.2019.09.006.
- ↑ K. Akiyama, K. Yokota, S. Kagawa, N. Shimbara, T. Tamura. cDNA cloning and interferon gamma down-regulation of proteasomal subunits X and Y // Science (New York, N.Y.). — 1994-08-26. — Т. 265, вып. 5176. — С. 1231–1234. — ISSN 0036-8075. — doi:10.1126/science.8066462. Архивировано 23 сентября 2016 года.
- ↑ Xiaofei Jia, Rajendra Singh, Stefanie Homann, Haitao Yang, John Guatelli. Structural basis of evasion of cellular adaptive immunity by HIV-1 Nef // Nature Structural & Molecular Biology. — 2012-06-17. — Т. 19, вып. 7. — С. 701–706. — ISSN 1545-9985. — doi:10.1038/nsmb.2328. Архивировано 19 апреля 2020 года.
- ↑ P. J. Bjorkman, M. A. Saper, B. Samraoui, W. S. Bennett, J. L. Strominger. The foreign antigen binding site and T cell recognition regions of class I histocompatibility antigens // Nature. — 1987 Oct 8-14. — Т. 329, вып. 6139. — С. 512–518. — ISSN 0028-0836. — doi:10.1038/329512a0. Архивировано 20 октября 2014 года.
- ↑ I. A. Wilson, D. H. Fremont. Structural analysis of MHC class I molecules with bound peptide antigens // Seminars in Immunology. — 1993-04. — Т. 5, вып. 2. — С. 75–80. — ISSN 1044-5323. — doi:10.1006/smim.1993.1011.
- ↑ J. H. Brown, T. S. Jardetzky, J. C. Gorga, L. J. Stern, R. G. Urban. Three-dimensional structure of the human class II histocompatibility antigen HLA-DR1 // Nature. — 1993-07-01. — Т. 364, вып. 6432. — С. 33–39. — ISSN 0028-0836. — doi:10.1038/364033a0. Архивировано 4 мая 2020 года.
- ↑ V. L. Murthy, L. J. Stern. The class II MHC protein HLA-DR1 in complex with an endogenous peptide: implications for the structural basis of the specificity of peptide binding // Structure (London, England: 1993). — 1997-10-15. — Т. 5, вып. 10. — С. 1385–1396. — ISSN 0969-2126. — doi:10.1016/s0969-2126(97)00288-8. Архивировано 31 марта 2019 года.
- ↑ Boehm, T; Zufall, F. MHC peptides and the sensory evaluation of genotype (англ.) // Trends Neurosci[англ.] : journal. — 2006. — Vol. 29, no. 2. — P. 100—107. — doi:10.1016/j.tins.2005.11.006. — PMID 16337283.
- ↑ Wedekind, C; Seebeck, T; Bettens, F; Paepke, A J. MHC-dependent mate preferences in humans (англ.) // Proc Biol Sci : journal. — 1995. — June (vol. 1359, no. 260). — P. 245—249. — doi:10.1098/rspb.1995.0087. — PMID 7630893.
- ↑ Santos, P S; Schinemann, J A; Gabardo, J; Bicalho, Mda G. New evidence that the MHC influences odor perception in humans: a study with 58 Southern Brazilian students (англ.) // Horm Behav. : journal. — 2005. — April (vol. 47, no. 4). — P. 384—388. — doi:10.1016/j.yhbeh.2004.11.005. — PMID 15777804.
- ↑ Jacob S., McClintock M.K., Zelano B., Ober C. Paternally inherited HLA alleles are associated with women's choice of male odor (англ.) // Nat. Genet. : journal. — 2002. — February (vol. 30, no. 2). — P. 175—179. — doi:10.1038/ng830. — PMID 11799397.
Ссылки
[править | править код]Литература
[править | править код]- Мейл, Д. Иммунология / Д. Мейл, Дж. Бростофф, Д. Б. Рот, А. Ройтт / Пер. с англ. — М.: Логосфера, 2007. — 568 с.
- Койко, Р. Иммунология / Р. Койко, Д. Саншайн, Э. Бенджамини; пер. с англ. А. В. Камаева, А. Ю. Кузнецовой под ред. Н. Б. Серебряной. -М: Издательский центр «Академия», 2008. — 368 с.