Svojstva vode

| Voda | |
|---|---|
  | |
| Opšte | |
| Ime | Voda |
| Druga imena | Aqua dihidrogen monoksid |
| Hemijska formula | H2O |
| Molekulska masa | 18,02 g/mol |
| Izgled | prozirna, skoro bezbojna tečnost sa slabo plavičasta [1]Arhivirano 2019-05-25 na Wayback Machine-u |
| CAS number | [7732-18-5] |
| Osobine | |
| Gustina i faza | 1 g/cm3, tečna |
| 0,917 g/cm3, čvrsta | |
| Tačka topljenja | 0 °C, 32 °F (273,15 K) |
| Tačka ključanja | 100 °C, 212 °F (373,15 K) |
| Toplotni kapacitet (tečna) | 4186 J/(kg·K) |
| Toplotni kapacitet (gas) | cp= 1850 J/(kg·K) cv= 3724 J/(kg.K) |
| Toplotni kapacitet (čvrsto 0 °C) | 2060 J/(kg·K) |
| Konstanta disocijacije (pKa) | 13,995 |
| Viskoznost | 1 mPa·s na 20 °C |
| Struktura | |
| Oblik molekula | nelinearan savijen |
| Kristalna struktura | Heksagonalna Videtiled |
| Dipolni moment | 1,85 D |
| Dodatni podaci | |
| Struktura i osobine | n, εr, itd. |
| Termodinamički podai | Fazno ponašanje čvrsta, tečna, gas |
| Spektroskopski podaci | UV, IR, NMR, MS |
| Srodna jedinjenja | |
| Srodni rastvarači | aceton metanol |
| Srodna jedinjenja | led teška voda |
| Izuzev kada je napomenuto drugačije, podaci su dati za materijale u njihovom standardno stanje (na 25 °C, 100 kPa) Infobox disclaimer and references | |
Voda ima molekulsku formulu H2O, dakle, jedan molekul vode sastoji se od dva vodonikova atoma i jednog atoma kiseonika. Isto može biti opisana jonski kao HOH, sa vodonikovim jonom (H+) vezanim za hidroksilni jon (OH-). Pri normalnim uslovima kod vode se tečna i gasna faza nalaze u dinamičkoj ravnoteži.
Na sobnoj temperaturi voda je tečnost skoro bezbojna, bez ukusa i mirisa. U nauci se često kaže da je voda univerzalni rastvarač i jedina je supstanca koja se u prirodi nalazi čista u sva tri agregatna stanja.
Voda postoji u mnogim oblicima - u čvrstom stanju poznata je kao led koji može imati nekoliko kristalnih oblika a ultra brzo hlađena voda može da pređe u amorfno stanje. U gasnom stanju voda je poznata kao vodena para. Tečna faza se kao i samo jedinjenje naziva voda.
Iznad kritične temperature (647 K i 22,064 MPa), voda se nalazi u superkritičnim uslovima kada molekuli vode obrazuju grozdove koji se ponašaju kao tečna faza a koji lebde u parnoj fazi.
Teška voda je voda u kojoj je atom vodonika isključivo zastupljen kao izotop deuterijum. Po hemijskim i fizičkim osobinama je skoro identična `običnoj` vodi. Najpoznatija primena teške vode je kao usporivač neutrona u nuklearnim reaktorima.
Voda je pronađena u međuzvezdanim oblacima u našoj galaksiji, Mlečnom putu. Veruje se da vode ima u znatnim količinama i u ostalim galaksijama jer su njeni sastojci vodonik i kiseonik među najrasprostranjenijim elementima u svemiru.
Međuzvezdani oblaci vremenom mogu da se kondenzuju u sunčeve nebule i sunčeve sisteme poput našeg. Voda može da se nađe u kometama, planetama, i njihovim prirodnim satelitima. U našem sunčevom sistemu voda, u obliku leda, je pronađena:
- na Mesecu,
- na planetama Merkuru, Marsu, Neptunu, i Plutonu,
- na planetarnim satelitima, kao što su Triton i Evropa.
Voda u tečnom obliku poznata je samo na Zemlji mada postoje prilično jaki dokazi da tečnosti ima ispod površine Saturnovog meseca Enceladu.
Vodeni ciklus, ili hidrološki ciklus odnosi se na neprekidnu razmenu vode u hidrosferi, između atmosfere, vode iz tla, površinskih voda, zemnih voda i biljaka.
Približna zapremina sve vode na Zemlji je 1.360.000.000 km³. Od toga:
- 1.320.000.000 km³ ili 97,2%, je voda u morima i okeanima
- 25.000.000 km³ ili 1,8% je u glečerima ili u polarnom ledu.
- 13.000.000 km³ ili 0,9% su zemne vode.
- 250.000 km³ ili 0,02% otpada na slatkovodnu masu (jezera, reke...).
- 13.000 km³ ili 0,001% nalazi se u atmosferi u obliku vodene pare.
Tečna voda se nalazi u vodenim masama kao što su okeani, mora, jezera, reka, potoka, kanala ili bara. Najveći deo vode na Zemlji je u obliku morske vode. Voda je prisutna i u atmosferi u tečnom stanju i u obliku pare. Takođe je postoji u obliku podzemnih voda.
Mada pod normalnim uslovima ključa na 100 °C, u prirodi postoje uslovi pri kojima voda ključa na 400 °C (voda pregrejana vulkanskom aktivnošću u velikim okeanskim dubinama) ili na jedva 70 °C (na vrhu Monteveresta).
Voda se, osim kao hemijski rastvarač, koristi u mnogim industrijskim postupcima i mašinama, kao što su parne turbine i izmenjivači toplote. Ispuštanje neprečišćene vode iz industrijskih postrojenja predstavlja zagađenje. Zagađenje može biti hemijsko (u vodi su ostaci hemijskog zagađivača) ili toplotno (voda reke je pregrejana i ugrožava živi svet u njoj). Industrija zahteva relativno čistu vodu za svoje procese i stoga koristi razne metode i tehnike prečišćavanja kako kod snabdevanja tako i kod ispuštanja vode.
Fizička hemija vode
[uredi | uredi kod]Normalno, što se najčešće i opaža, gustina neke supstance u čvrstom agregatnom stanju je veće od njene gustine u tečnom. Stoga komad takve čvrste supstance tone u sopstvenoj tečnoj fazi. (Na tački topljenja, ili tački mržnjenja, tečna i čvrsta faza su u ravnoteži pa je taj ogled zaista i moguć.) Međutim, nasuprot tome, kod vode, čvrsta faza (led) umesto da tone, pliva na površini svoje tečne faze. Dakle, gustina leda je manja od gustine tečne vode. Ova 'anomalija' vode je od izvanrednog značaja. Hlađenjem od sobne temperature gustina vode raste (zapremina opada) kako se očekuje i opaža kod većine supstancija. Međutim, na + 4 °C, dakle, malo iznad tačke mržnjenja, gustina vode dostiže maksimum. Daljim hlađenjem od 4 °C do tačke mržnjenja gustina opet počinje da opada. Ovakvo ponašanje vode povezano je sa kristalnom strukturom običnog leda koji je poznat kao led Ih. (Voda ima nekoliko različitih čvrstih faza od kojih neke imaju gustinu veću od tečnosti, recimo amorfne faze vode.) Dakle, pomalo je čudno što je gustina običnog leda manja od gustine vode ali sve postaje jasno kada se uzmu u obzir osobine vodonične veze.
| Zavisnost gustine vode od temperature | |
|---|---|
| T/°C | gustina (g/cm3) |
| 30 | 0,9957 |
| 20 | 0,9982 |
| 10 | 0,9997 |
| 0 | 0,9998 |
| -10 | 0,9982 |
| -20 | 0,9935 |
| -30 | 0,983 |
| Vrednosti ispod 0 °C odnose se na prehlađenu vodu (ne na led). | |
Vodonična veza je slična hemijskim u smislu da postoji preferencijalni pravac duž kojeg deluju, dakle postoji preferencijalna geometrija, ali je znatno slabija od hemijskih te može lako da je raskine toplotno kretanje i na temperaturama bliskim sobnoj. Vodonične veze postoje i u čvrstom i u tečnom stanju ali su u tečnom delom porušene. U tečnom stanju usled toplotnog kretanja vodonične veze se neprekidno grade i razgrađuju. U čvrstom stanju molekul vode obrazuje dve vodonične veze koje sa hemijskim vezama obrazuju tetraedar u čijem je centru atom kiseonika. U tečnoj fazi takvi se teraedri obrazuju i ruše što za posledicu ima da atomi kiseonika mogu da budu malo bliže jedan drugome nego u pravilnoj kristalnoj rešetki. Dakle, voda se širi pri mržnjenju zato što se prilikom obrazovanja kristalne rešetke atomi kiseonika udaljavaju jedni od drugih u nastojanju da obrazuju pravilne tetraedre.
Nije preterivanje ako se kaže da ceo život na Zemlji počiva na ovoj osobini. Na primer, kada bi gustina leda bila veća od gustine tečnosti tada bi led nastao tokom zime vrlo lako ostao očuvan na dnu jer topla voda bi, zbog manje gustine ostala na površini i led bi se vrlo sporo topio. Dakle, ne bi bilo prirodnog mešanja vode zbog kojeg se na dnu, umesto leda, skuplja voda sa temperaturom od + 4 °C. Drugim rečima, stajaće vode bi se mrznule od dna ka vrhu i u njima ne bi moglo da bude višegodišnjih živih bića. Voda (i led) su dobri toplotni izolatori i prvi slojevi leda na površini vodenih masa usporavaju mržnjenje donjih slojeva jer se, zbog manje gustine, ne mešaju sa njima.
Dakle, ukupan efekat je da se, zbog postojanja vodoničnih, veza u prirodnom okruženju hladna voda konvekcijom spušta na dno vodene mase dok se ne postigne ravnoteža pri kojoj je temperatura na dnu + 4 °C. Voda i hladnija i toplija od 4 °C biće potisnuta na površinu. Posledica toga je da je pri jakoj zimi voda na površini, bez obzira na zamrzavanje hladnija nego na dnu što veoma usporava zamrzavanje po celoj zapremini, koje se odvija od vrha ka dnu.

Na trojnoj tački u ravnoteži se nalaze sve tri faze, čvrsta, tečna i gasovita. Ona se postiže na kombinaciji pritiska i temperature jedinstvenoj za svaku supstanciju (stabilnu pod tim uslovima) pa je zgodna za kalibraciju temperaturske skale. Trojnu tačku vode je lako reprodukovati pa se ona uzima za kalibraciju temperaturske skale. Po konvenciji, trojna tačka vode je na 273,16 K (0,01 °C) i na pritisku od 611,73 Pa. To je relativno nizak pritisak, približno 1/166 od normalnog barometarskog pritiska na morskom nivou (101.325 Pa). To je pritisak zasićene vodene pare (napon pare) na datoj temperaturi i sličan je onome na Marsu.

Vodene kapljice su stabilne zahvaljujući visokom površinskom naponu koji je, opet posledica vodoničnih veza. I ova osobina je od izvanredne važnosti za život jer je deo osnovnog mehanizma kojim biljke uspevaju da sačuvaju vodu i kojim se voda prenosi od korena ka vrhu biljke.
Čista voda je zapravo odličan izolator, odnosno slab provodnik, dakle, vrlo slabo provodi električnu struju. Međutim, pošto je izvanredan rastvarač u vodi uvek ima tragova rastvorka najčešće soli. I najmanja količina takvih primesa vodu čini provodnom jer te soli disosuju na slobodne jone koji svojim kretanjem provode električnu struju.
Voda može da se razloži na sastavne elemente, kiseonik i vodonik, propouštanjem struje kroz nju. Taj se proces naziva elektroliza. Molekuli vode prirodno disosuju na jone H+ i OH-. Kada se zatvori strujno kolo negativna eletroda (katoda) privlači H+ jone koji se na katoi neutrališu primajući po jedan elektron i koji se rekombinuju u molekule vodonika, H2. U isto vreme pozitivna anoda privlači OH- jone koji joj predaju po jedan elektron i na njoj se rekombinuju u vodu i gasoviti kiseonik, O2. Gasovi, proizvodi eletrolize izlaze na površinu u obliku mehurića gde se mogu posebno sakupiti.
Poznato je da je maksimalni specifični otpor vode približno 182 kilo Om metara (ili 18,2 MΩ·cm) na 25 S što se dobro slaže sa ekseprimentalnim vrednsotima za ultračistu vodu koaj se koristi u laboratoriji ili industriji poluprovodnika. Primese na nivou od čak 100 delova na milijardu mogu biti detektovane na osnovu porasta eletrične provodljivosti (pada otpornosti) vode.
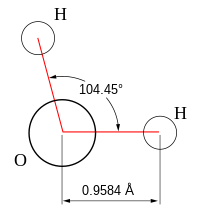
Važna osobina vode je polarnost, dakle, dipolna priroda molekula. Molekul vode (videti shemu) je ugaonog oblika gde se atomi vodonika nalaze pod uglom od 104 stepeni mereno iz centra atoma kiseonika. Pošto je kiseonik elektronegativniji od vodonika, s kiseonične strane molekul je malo negativniji nego s vodonične što dovodi do stvaranja električnog dipola. Dakle molekul vode je s jedns strane malo negativan a sa druge malo pozitivan (pri čemi je molekul kao celina neutralan) pa ta mala naeletrisanja među susednim molekulima deluju jedna na druge. Suprotna naelektrisanja se privlače a istoimena odbijaju što dovodi do dodatnih interakcija među molekulima vode i među drugim polarnim molekulima. Posebno je karakteristična privlačna sila u kojoj učestvuje vodonik iz polarnih molekula. Ona se naziva vodonična veza i može da objasni brojne fizičkohemijske osobine vode.
Zahvaljujući svojoj polarnosti voda je takođe odličan rastvarač. Kada se jonska ili polarna jedinjenja nađu u vodi, polarni molekuli vode se grupišu oko čestice, jona ili molekula, i tako neutrališu sopstveno naelektrisanje jona ili molekula. Taj proces 'rojenja' moelkula rastvarača oko rastvorka naziva se solvatacija a kada je u pitanju voda hidratacija. Hidratisani joni i molekuli zbog neutralizacije prvobitnog naelektrisanja više ne privlače jedni druge kao pre te se otkidaju od kristala (ili čiste tečne faze) i odlaze u vodeni rastvor. Pošto je molekul vode relativno mali jedan molekul rastvorka okružuje ogroman broj molekula vode stvarajući oko njega hidratacionu sferu.
U vodi je rastvorna većina supstanci koje mogu da disosuju poput baza, kiselina i soli, zatim polarna organska jedinjenja poput alkohola, aldehida i ketona. Međutim, u vodi su nerastvorna organska jedinjenja koja imaju velike nepolarne grupe poput masti i ulja. Nepolarni molekuli se ne mešaju sa vodom zato što je za molekule vode energijski mnogo povoljnije da obrazuju vodonične veze međusobno nego da se mešaju sa nepolarnim grupama sa kojim amogu da obrazuju samo relativno slabe Van der Valsove sile.
Hemijski, voda je amfoterna, dakle, ima osobine i kiseline i baze. Pri pH 7 (u neutralnoj sredini) koncentracija hidroksilnih jona (OH-) jednaka je koncentraciji hidronijum jona (H3O+) (ili vodoničnih (H+)) jona. Ako se ta ravnoteža poremeti, rastvor postaje kiseo (kada poraste koncentracija hidronijum jona) ili bazan (kada poraste koncentracija hidroksilnih jona).
U hemijskim reakcijama voda može da deluje i kao kiselina i kao baza. Prema Bronstedovoj teoriji, kiselina je vrsta koja u hemijskoj reakciji odaje proton (H+ jon) a baza je grupa koja prima proton. Kada reaguje sa jačom kiselinom, voda se ponaša kao baza a kada reaguje sa jačom bazom, ponaša se kao kiselina. Na primer, od hlorovodonične kiseline, voda prima proton:
- HCl + H2O ⇌ H3O+ + Cl-
Ovde, primajući proton, voda deluje kao baza.
U reakciji sa amonijakom, NH3, voda odaje H+ jon, dakle, deluje kao kiselina:
- NH3 + H2O ⇌ NH4+ + OH-

Molekul vode može da obrazuje najviše četiri vodonične veze jer je donor dva i akceptor dva vodonika. Druga jedinjenja poput hlorovodonika, amonijaka, metanola takođe obrazuju vodonične veze ali ne pokazuju anomalne osobine poput molekula vode. Rešenje ove zagonetke leži u činjenici da samo voda obrazuje mrežu vodoničnih veza dok su u drugim molekulima, bilo zbog nemogućnosti da se primi-preda više vodonikovih atoma ili zbog sternih smetnji, te veze ograničene na molekulske parove ili manje molekulske grozdove.
|
Voda, jednostavno binarno jedinjenje moglo bi se zvati vodonik oksid. To bi bilo najjednostavnije ime, i najbolje. Ponekad se, što je komplikovano bez potrebe, naziva i „vodonik hidroksid“. U stvari, Međunarodna unija za čistu i primenjenu hemiju preporučuje korišćenje trivijalnog imena „voda“. Dakle, osravno ime vode je „voda“.
- Water Structure and Behaviour A comprehensive and up-to-date NPOV resource maintained by Prof Martin Chaplin of South Bank University, UK
- A spoof site on the "dangers" of dihydrogen monoxide
- Stockholm International Water Institute (SIWI)
- Explanation of the anomalous properties of water
- Computational Chemistry Wiki Arhivirano 2007-09-27 na Wayback Machine-u
