Halogen

Halogenerna är en grupp grundämnen i periodiska systemets grupp 17. De är giftiga i grundämnesform. De är bland de mest reaktiva grundämnena i hela det periodiska systemet och bildar gärna negativa joner. Halogenerna är fluor, klor, brom, jod och astat.
Ordet halogen kommer från grekiskan: hals, "salt", och gen, "alstrare", alltså saltbildare, då de förekommer i många salter, till exempel natriumklorid. Halogenerna bildar salter med olika sorters metaller, därav namnet halogen. Alla halogener reagerar gärna med alkalimetallerna. Halogenernas kemi kan härledas tillbaka till det faktum att de har 7 valenselektroner och därför bara saknar en enda elektron för att uppnå ädelgasstruktur (alternativt uppfylla oktettregeln). De är därför oerhört benägna att plocka upp en elektron vilket gör dem till de starkaste oxidationsmedlen.[1]
Salter
[redigera | redigera wikitext]Halogenernas salt är:
Egenskaper
[redigera | redigera wikitext]Några distinkta egenskaper för samtliga halogener är att de alla
- är giftiga (på grund av deras reaktivitet)
- är färgade i gasform
- är ickemetaller
- har låg smält- och kokpunkt
Går man nedåt i gruppen kommer smält- och kokpunkten att öka på grund av att atomerna blir större vilket i sin tur leder till att det finns större yta för de intermolekylära krafterna att verka på vilket gör dem starkare. Detta fenomen kan man vittna i att fluor och klor är gaser i rumstemperatur, brom en vätska och jod och astat i fast form.[2] Tenness är ett artificiellt grundämne som ej existerar utanför laboratorier och sönderfaller för snabbt för att dess egenskaper ska kunna undersökas, i dagsläget kan man därför endast beräkna och förutspå grundämnets egenskaper.[3]
Går man neråt i gruppen kommer reaktiviteten att minska då antalet elektronskal ökar. Det är den positiva kärnan i atomen som med en elektromagnetisk kraft drar till sig de negativa elektronerna, men ju längre ner i gruppen man kommer desto fler elektronskal kommer dämpa kärnans attraherande kraft mot omgivningen. Om atomen har en lägre attraherande kraft resulterar det direkt i att den är mindre reaktiv. Fluor, det mest reaktiva ämnet i halogengruppen är faktiskt också det mest reaktiva ämnet på hela det periodiska systemet.[2] Det är också denna princip som avgör en halogens förmåga att oxidera andra ämnen. Går man därför neråt i gruppen så kommer man att få ett relativt sämre oxidationsmedel.[4]
Fria halogener bildar homonukleära diatomiska molekyler.[5] Fluor till exempel, bildar gärna en tvåatomig molekyl med sig själv. I molekylen F2 delar fluoratomerna en kovalent bindning vilket ger atomerna ädelgasstruktur och därför är molekylen någorlunda stabil. Klor, brom och jod bildar Cl2, Br2 och I2 genom samma princip som fluor bildar F2.[1]
Historia
[redigera | redigera wikitext]Fluors existens upptäcktes redan 1529, så kemister insåg att fluorit, (kalciumfluorit, CaF2), innehöll ett okänt grundämne, men man lyckades aldrig isolera det. Det dröjde till 1886 innan Henri Moissan, genom elektrolys, lyckades framställa fluor ur vätefluorid (HF) och kaliumvätedifluorid (KHF2).
Saltsyra (HCl) upptäcktes tidigt men det tog till 1774 innan Carl Wilhelm Scheele lyckades producera rent klor ur saltsyra och mangandioxid dock utan vetskap att det var ett rent grundämne han framställt. Det tog ytterligare 33 år efter Scheeles upptäckt innan Humphry Davy insåg att klor var ett faktiskt grundämne. Klor och saltsyra i kombination kan skapa en giftig gas som användes som kemisk krigföring under första världskriget.
Antoine Jérôme Balard upptäckte under 1820-talet brom genom att låta klorgas passera genom en saltlag.
Jod upptäcktes av misstag av Bernard Courtois 1811. Han brukade använda sig av aska från sjögräs för att producera salpeter. I en sats tillsatte han svavelsyra och upptäckte att han framställt en lila gas som desublimerade till svarta kristaller. Med misstanke om att han funnit ett nytt grundämne skickade han in kristallerna för undersökning. Han bevisade sig vara rätt när Louis Joseph Gay-Lussac bekräftade att ett nytt grundämne var funnet.
Under 1930-talet gjordes flera anspråk på att ha funnit grundämne 85, varav alla utom det senaste bevisades fel. Genom att bombardera vismut med alfapartiklar framställdes astat 1940 av Dale R. Corson, K.R. Mackenzie och Emilio G. Segrè.[6]
Tenness upptäcktes 2010 och redan i april samma år tillkännagavs dess upptäckt för allmänheten av forskare från the Joint Institute for Nuclear Research i Dubna, Ryssland och the Lawrence Livermore National Laboratory i Kalifornien. Forskarna bombarderade berkeliummolekyler med kaliumjoner tills de fick fram tenness. Ämnet är syntetiskt och förekommer inte naturligt. Ämnet har två isotoper med kända halveringstider varav den längsta är cirka 80 millisekunder. [7]
- Elektronkonfiguration för halogenerna
- Fluor
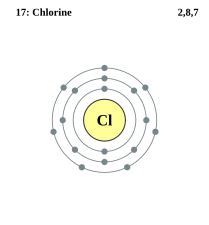
- Klor
- Brom
- Jod
- Astat
- Tenness
Se även
[redigera | redigera wikitext]Referenser
[redigera | redigera wikitext]Noter
[redigera | redigera wikitext]- ^ [a b] R Gilbert, Thomas; Rein V Kirss, Geoffrey Davies (2002). Chemistry: The Science in Context. sid. ss. 307. Läst 21 mars 2019
- ^ [a b] SunnyLearning. ”The Group 7 Halogens - GCSE AQA Chemistry”. https://www.youtube.com/watch?v=pykCzgrbQ70. Läst 31 mars 2019.
- ^ ”Tennessine” (på engelska). Wikipedia. 2019-03-16. https://en.wikipedia.org/w/index.php?title=Tennessine&oldid=888011316. Läst 31 mars 2019.
- ^ ”Halogens as oxidising agents”. www.chemguide.co.uk. http://www.chemguide.co.uk/inorganic/group7/halogensasoas.html. Läst 31 mars 2019.
- ^ ”Vad är en diatomisk molekyl?”. sv.scienceaq.com. http://sv.scienceaq.com/100513700.html. Läst 31 mars 2019.
- ^ Emsley, John (2011). Nature's Building Blocks. Läst 1 april 2019
- ^ Sharp, Tim; December 1, Reference Editor |; ET, 2016 09:36pm. ”Facts About Tennessine (Element 117)”. Live Science. https://www.livescience.com/41459-facts-about-ununseptium.html. Läst 31 mars 2019.
Källor
[redigera | redigera wikitext]- Nationalencyklopedin 8. Bra Böcker. 1989. sid. 333. ISBN 91-7024-621-1
- Sherwood, Martin (1990). Kemin, Grundämnen & föreningar. Bonniers. sid. 54. ISBN 91-34-50893-7
|