İyon
 Vikipedi, özgür ansiklopedi
Vikipedi, özgür ansiklopedi

İyon ya da yerdeş (Fransızca kökenli ion), bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan (veya bir atom grubundan) oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.
Katyon, protonlardan daha az elektronu olan pozitif (+) yüklü bir iyondur[1], anyon ise protonlardan daha çok elektronu olan negatif (–) yüklü bir iyondur.[2] Zıt elektrik yükleri elektrostatik kuvvetle birbirine doğru çekilir, böylece katyonlar ve anyonlar birbirini çeker ve kolayca iyonik bileşikler oluşturur.
Anyon ve katyon iyonların bağ yapma şekilleri farklı olabilir. Anyonlar elektron ortaklaşmasıyla ve elektron alış-verişiyle bağ kurarken katyon olan iyonlar yalnızca elektron alış-verişiyle bağ kurar. Bir hidrojen atomu kararlı hale geçmek istediğinde 1 elektron alarak anyon haline gelir. Fakat Lityum atomu ise kararlı hale geçerken 1 elektron vererek katyon haline gelir.
Örnek olarak;
- H+ (1 elektron vermiş atom)
- OH– (1 elektron almış atom grubu)
- (SO4)2– (2 elektron almış atom grubu)
Yalnızca tek bir atomdan oluşan iyonlara atomik veya tek atomlu iyonlar adı verilirken, iki veya daha fazla atom moleküler iyonları veya çok atomlu iyonları oluşturur. Bir akışkanda (gaz veya sıvı) fiziksel iyonlaşmada, kendiliğinden molekül çarpışmaları ile "iyon çiftleri" oluşturulur ve üretilen her çift, bir serbest elektron ve bir pozitif iyondan oluşur.[3] İyonlar aynı zamanda bir tuzun sıvılarda çözünmesi gibi kimyasal etkileşimlerle veya iletken bir çözeltiden doğru akımın geçirilmesi, bir anotun iyonlaşma yoluyla çözülmesi gibi başka yollarla da oluşturulur.
Keşif tarihçe[değiştir | kaynağı değiştir]
İyon kelimesi, Yunanca ἰέναι (ienai) kelimesinin "gitmek" anlamına gelen nötr şimdiki zaman katılımcısından türetilmiştir. Katyon aşağı doğru hareket eden (Yunanca: κάτω, romanize: aşağı, kato, "aşağı" anlamına gelir) ve anyon ise yukarı doğru hareket eden şeydir (Yunanca: ἄνω, romanize: yukarı, ano, "yukarı" anlamına gelir). İyonların zıt yüklü elektroda doğru hareket etmesi nedeniyle bu şekilde adlandırılırlar. Bu terim (İngiliz bilge William Whewell'in[4] önerisinden sonra) İngiliz fizikçi ve kimyager Michael Faraday tarafından 1834 yılında sulu bir ortam aracılığıyla bir elektrottan diğerine giden o zamanlar bilinmeyen türler için kullanılmıştır.[4][5][6] Faraday bu türlerin doğasını bilmiyordu ama metallerin bir elektrotta eriyip çözeltiye girdiğini ve diğer elektrottaki çözeltiden yeni metalin çıktığını yani bir tür maddenin bir akım içinde çözeltiden geçtiği biliyordu. Bu, maddeyi bir yerden diğerine taşır. Faraday ile yazışmalarında Whewell ayrıca anot ve katot sözcüklerinin yanı sıra ilgili elektrotlara çekilen iyonlar olarak anyon ve katyon kelimelerini de icat etti.[4]
Svante Arrhenius, 1884 tarihli tezinde, katı kristal tuzların çözündüğünde eşleştirilmiş yüklü parçacıklara ayrıştığı gerçeğini açıklamadı ve bu sayede 1903 Nobel Kimya Ödülü'nü kazandı.[7] Arrhenius'un açıklaması, bir çözelti oluştururken tuzun Faraday iyonlarına ayrıştığı yönündeydi; iyonların elektrik akımı olmadığında bile oluştuğunu öne sürdü.[8][9][10]
Özellikler[değiştir | kaynağı değiştir]
Gaz benzeri hallerindeki iyonlar oldukça reaktiftir ve nötr moleküller veya iyonik tuzlar vermek üzere zıt yüklü iyonlarla hızla etkileşime girerler. İyonlar sıvıyla etkileşime girmek için birbirlerinden uzaklaşırken enerji ve entropi değişiklik birleşimi içeren nedenlerden dolayı, tuzlar çözücülerle (örneğin su) etkileşime girdiğinde daha kararlı çözünmüş iyonlar ürettiğinde iyonlar sıvı veya katı halde de üretilir. Bu kararlı türler, çevrede düşük sıcaklıklarda daha yaygın bulunur. Buna bir örnek, deniz suyunda bulunan ve çözünmüş tuzlardan türetilen iyonlardır.
Yüklü nesneler olarak iyonlar zıt elektrik yüklerine (pozitiften negatife ve tersi) çekilir ve benzer yükler tarafından itilir. Hareket ettiklerinde yörüngeleri manyetik alan tarafından saptırılabilir.
Elektronlar, daha küçük kütleleri ve dolayısıyla madde dalgaları gibi daha büyük boşluk doldurma özellikleri nedeniyle, herhangi bir elektronlu atomların ve moleküllerin boyutunu belirler. Bu nedenle, anyonlar (negatif yüklü iyonlar), fazla elektronu (ları) birbirini ittiğinden ve iyonun fiziksel boyutuna katkıda bulunduğundan ana molekül veya atomdan daha büyüktür, çünkü boyutu elektron bulutu tarafından belirlenir. Katyonlar, elektron bulutunun daha küçük boyutundan dolayı karşılık gelen ana atom veya molekülden daha küçüktür. Belirli bir katyon (hidrojenin katyonu) hiç elektron içermez ve bu nedenle ana hidrojen atomundan – çok daha küçük tek protondan oluşur.
Anyonlar ve katyonlar[değiştir | kaynağı değiştir]
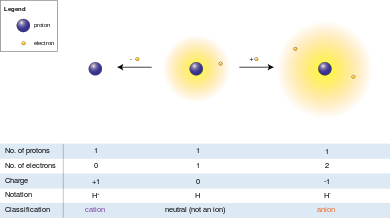
Anyon (-) ve katyon (+), bir iyonun üzerindeki net elektrik yükünü gösterir. Elektronları protonlardan daha çok olan ve ona net negatif yük veren iyona anyon denir ve eksi göstergesi "Anyon (-)" negatif yükü belirtir. Katyonda durum tam tersidir: protonlardan daha az elektronludur, bu ise katyona net pozitif yük verir, dolayısıyla "Katyon (+)" göstergelidir.
Protonun elektrik yükünün büyüklüğü elektronun yüküne eşit olduğundan, iyonun net elektrik yükü iyondaki proton sayısından elektron sayısının çıkarılmasına eşittir.
Anyon (-) (/, Yunanca "yukarı" anlamına gelen ἄνω (ánō) kelimesinden gelir[11]), protonlardan daha çok elektronu olan ve anyona net negatif yük veren iyondur (elektronlar negatif yüklü ve protonlar pozitif yüklü olduğundan).[12]
Katyon (+) (/, Yunanca "aşağı" anlamına gelen κάτω (katot) kelimesinden gelir[13]), protonlardan daha az elektronlu ve katyona pozitif yük veren bir iyondur.[14]
Katyonlar ve anyonlar iyon yarıçaplarına göre ölçülür ve göreceli büyüklükleri farklıdır: "Katyonlar küçüktür, çoğunun yarıçapı 10−10 m'den (10−8 cm) küçüktür. Ancak tıpkı en yaygın Dünya anyonu olan oksijen gibi anyonların çoğu büyüktür. Bu gerçekten, bir kristalin boşluğunun çoğunun anyonlar tarafından işgal edildiği ve katyonların bunların arasındaki boşluklara yerleştiği açıktır."[15]
Doğal oluşumlar[değiştir | kaynağı değiştir]
İyonlar doğada her yerde bulunur ve Güneş'in ışıltısından Dünya'nın iyonosfer varlığına kadar çeşitli olaylardan sorumludurlar. İyonik durumdaki atomların rengi, nötr atomlarınkinden farklı olabilir ve bu nedenle metal iyonları tarafından ışık emilimi, değerli taşların rengini verir. Hem inorganik hem de organik kimyada (biyokimya dahil), su ve iyonların etkileşimi çok önemlidir; Adenozin trifosfatın (ATP) parçalanmasını sağlayan enerji buna bir örnektir.
İlgili teknoloji[değiştir | kaynağı değiştir]
İyonlar, genellikle yüksek voltaj veya sıcaklık içeren çeşitli iyon kaynakları kullanılarak kimyasal olmayan bir şekilde hazırlanabilir. Bunlar kütle spektrometreleri, optik emisyon spektrometreleri, parçacık hızlandırıcıları, iyon implanterleri ve iyon motorları gibi çok sayıda cihazda kullanılır.
Reaktif yüklü parçacıklar olarak mikropları parçalayarak hava temizlemede ve duman dedektörleri gibi bina içi cihazlarda da kullanılırlar.
Organizmalardaki sinyalleşme ve metabolizma, zarlar arasındaki kesin bir iyonik değişim tarafından kontrol edildiğinden, bu değişimin bozulması hücre ölümüne katkıda bulunur. Bu, iyon kanalları gramisidin ve amfoterisin (bir mantar ilacı) dahil olmak üzere doğal ve yapay biyositler tarafından kullanılan yaygın bir mekanizmadır.
İnorganik çözünmüş iyonlar, su kalitesinin yaygın bilinen göstergesi toplam çözünmüş katıların bir bileşenidir.
İyonlaştırıcı radyasyonun tespiti[değiştir | kaynağı değiştir]
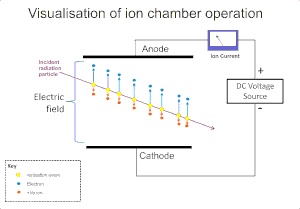
Radyasyonun bir gaz üzerindeki iyonlaştırıcı etkisi, alfa, beta, gama ve X ışınları gibi radyasyonun tespitinde yaygın kullanılır. Bu aletlerdeki orijinal iyonizasyon, gaz molekülleri üzerindeki radyasyonun iyon etkisiyle pozitif iyon ve serbest elektron olarak bir "iyon çifti" oluşmasıyla sonuçlanır. İyonizasyon odası bu dedektörlerin en basitidir ve gazın içindeki doğrudan iyonlaşmanın yarattığı tüm yükleri bir elektrik alanının uygulanması yoluyla toplar.[3]
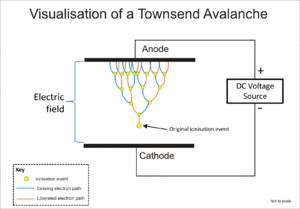
Geiger-Müller tüpü ve orantısal sayacın her ikisi de, Townsend çığı denilen olguyu kullanarak orijinal iyonlaşmanın etkisini, serbest elektronlara iyon çarpmasıyla daha çok elektron salmaları için elektrik alanınca yeterli enerjinin verildiği kademeli bir etki yoluyla çarpmak için kullanır.
Kimya[değiştir | kaynağı değiştir]
Yüklü durumu belirtme[değiştir | kaynağı değiştir]
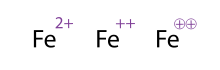
Bir iyonun kimyasal formülü yazılırken, molekülün/atomun kimyasal yapısından hemen sonra iyonun net yükü üst simge olarak yazılır. Net yük işaretinden önceki büyüklükle yazılır; yani çift yüklü bir katyon +2 yerine 2+ olarak gösterilir. Bununla birlikte, tek yüklü moleküller/atomlar için yükün büyüklüğü ihmal edilir; örneğin, sodyum katyonu Na1+ olarak değil Na+
olarak gösterilir.
Çoklu yüke sahip bir molekülü/atomu göstermenin alternatif (ve kabul edilebilir) bir yolu, işaretlerin birden çok kez çizilmesidir; bu genellikle geçiş metallerinde görülür. Kimyacılar bazen işareti daire içine alır; bu sadece süs amaçlıdır ve kimyasal anlamını değiştirmez. Dolayısıyla şekilde gösterilen Fe2+, Fe++
ve Fe⊕⊕
'nin üç gösterimi de eşdeğerdir .

| Fiziksel kimya ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. |
Kaynakça[değiştir | kaynağı değiştir]
- ^ "cation". Merriam-Webster Dictionary. 6 Ekim 2021 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ "anion". Merriam-Webster Dictionary. 6 Ekim 2021 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ a b c Knoll, Glenn F. (1999). Radiation Detection and Measurement (3cü bas.). New York: Wiley. ISBN 978-0-471-07338-3.
- ^ a b c Frank A. J. L. James, (Ed.) (1991). The Correspondence of Michael Faraday, Vol. 2: 1832–1840. s. 183. ISBN 9780863412493. 14 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 16 Ekim 2020.
- ^ Michael Faraday (1791–1867). Birleşik Krallık: BBC.
- ^ "Online etymology dictionary". 14 Mayıs 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Ocak 2011.
- ^ "The Nobel Prize in Chemistry 1903". nobelprize.org. 8 Temmuz 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Haziran 2017.
- ^ Harris, William; Levey, Judith, (Ed.) (1976). The New Columbia Encyclopedia (4cü bas.). New York City: Columbia Üniversitesi. s. 155. ISBN 978-0-231-03572-9.
- ^ Goetz, Philip W. (1992). McHenry, Charles (Ed.). The New Encyclopædia Britannica. Chicago: Encyclopaedia Britannica Inc. 1 (15 bas.). Chicago: Encyclopædia Britannica, Inc. s. 587. Bibcode:1991neb..book.....G. ISBN 978-0-85229-553-3.
- ^ Cillispie, Charles, (Ed.) (1970). Dictionary of Scientific Biography (1 bas.). New York City: Charles Scribner's Sons. ss. 296-302. ISBN 978-0-684-10112-5.
- ^ Oxford University Press (2013). "Oxford Reference: OVERVIEW anion". oxfordreference.com. 18 Ocak 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Ocak 2017.
- ^ University of Colorado Boulder (21 Kasım 2013). "Atoms and Elements, Isotopes and Ions". colorado.edu. 2 Şubat 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Kasım 2013.
- ^ Oxford University Press (2013). "Oxford Reference: OVERVIEW cation". oxfordreference.com. 18 Ocak 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Ocak 2017.
- ^ Douglas W. Haywick, Ph.D.; University of South Alabama (2 Temmuz 2008). "Elemental Chemistry" (PDF). usouthal.edu. 4 Aralık 2011 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 22 Kasım 2013.
- ^ Press, Frank; Siever, Raymond (1986). Earth (14cü bas.). New York: W. H. Freeman and Company. s. 63. ISBN 0-7167-1743-3. OCLC 12556840.