Иодат натрия
 Из Википедии, бесплатной энциклопедии
Из Википедии, бесплатной энциклопедии
| Иодат натрия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Иодат натрия |
| Традиционные названия | Иодноватокислый натрий |
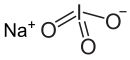
| Хим. формула | NaIO3 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 197,89 г/моль |
| Плотность | 4,277; 4,40 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 422 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 9,525; 26,680; 33100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7681-55-2 |
| PubChem | 23675764 |
| Рег. номер EINECS | 231-672-5 |
| SMILES | |
| InChI | |
| RTECS | NN1400000 |
| ChEBI | 81708 |
| ChemSpider | 22760 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Иодат натрия — неорганическое соединение, соль щелочного металла натрия и иодноватой кислоты с формулой NaIO3, бесцветные кристаллы, растворимые в воде, образует кристаллогидраты.
Получение[править | править код]
- Растворение иода в горячем концентрированном растворе гидроксида или карбоната натрия:
- Электролиз раствора иодида натрия:
- Окисление иода хлором в гидроксида натрия:
- Окисление иода хлоратом или броматом натрия:
- Растворение оксида иода в гидроксида натрия:
Физические свойства[править | править код]
Иодат натрия образует бесцветные кристаллы ромбической сингонии, пространственная группа P nma, параметры ячейки a = 0,637 нм, b = 0,810 нм, c = 0,575 нм, Z = 4.
Хорошо растворяется в воде, растворы имеют нейтральную реакцию. Растворяется в уксусной кислоте. Не растворяется в этаноле.
Образует кристаллогидраты состава NaIO3•H2O и NaIO3•5H2O.
Химические свойства[править | править код]
- Безводная соль получается сушкой кристаллогидрата в вакууме:
- Разлагается при нагревании:
- Является сильным окислителем:
- Электролизом иодата натрия получают периодат натрия:
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |










