Leclanché-Element
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
Das Leclanché-Element ist ein historisches galvanisches Element, das von Georges Leclanché entwickelt und 1866 patentiert wurde.[1] Es stellt eine elektrische Batterie (Primärelement) dar und war in der ursprünglichen Form mit flüssigem Elektrolyt ausgestattet. Verbesserungen führten zu einem gelierten Elektrolyt und es stellt einen Vorläufer der Trockenbatterien wie dem Zink-Kohle-Element und der Alkali-Mangan-Batterie dar.
Allgemeines
[Bearbeiten | Quelltext bearbeiten]
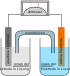
Das Leclanché-Element weist eine Klemmenspannung von 1,5 V auf und besteht aus einer Anode aus Zink, die den negativen Anschluss darstellt und üblicherweise zu einem Becher (Aufnahmegefäß) geformt ist, einem Elektrolyt aus mit Quellmitteln (Mehl, Stärke, Methylcellulose) angedickter Ammoniumchloridlösung, und einer Kathode aus einer gepressten Mischung aus Braunstein und Kohlenstoff (in Form von Graphit oder „Acetylenruß“→Ruß) mit einem Graphitstab als Ableitung, die zentrisch angebracht den positiven Anschluss der Zelle darstellt. Die Kathode ist zum Elektrolyt hin durch Braunstein umgeben, der als Depolarisator wirkt.
Das Leclanché-Element war wirtschaftlich über viele Jahrzehnte erfolgreich und wurde unter anderem zur Versorgung von Eisenbahntelegraphen und Hausklingeln eingesetzt. Dabei durchlief das Element über Jahre laufende Verbesserungen: Eine wesentliche Verbesserung und erster Schritt zum Trockenelement erfolgte durch den Ersatz des flüssigen Elektrolyts (Ammoniumchloridlösung) durch die Zugabe von Quellmitteln. In weiterer Folge wurde der gelierte Elektrolyt durch dünne Separatorpapiere in Sektoren aufgeteilt und durch Beigabe von Zinkchlorid die Energiedichte erhöht. Im Bereich der Zinkanode kamen verschiedene Metalllegierungen und Verschlusssysteme zum Einsatz, um die Wasserstoffentwicklung bei der Entladung zu reduzieren bzw. durch Luftabschluss die Lagerfähigkeit der Elemente zu erhöhen.
Einer der Nachteile des Leclanché-Elementes ist die bei Entladung der Zelle chemische Zersetzung der Zinkanode. Da die Anode durch den äußeren Zinkbecher gebildet wird, kommt es dabei prinzipbedingt zu einem Auslaufen der chemischen Bestandteile am Ende der Nutzung. Dieser konstruktive Nachteil, welcher auch bei dem ähnlich aufgebauten Zink-Kohle-Element besteht, wurde erst durch die Alkali-Mangan-Batterie gelöst.
Elektrochemie
[Bearbeiten | Quelltext bearbeiten]
Die Reaktionsgleichung bei Entladung der Zelle lautet:
Negative Elektrode ([elektrotechnisch: Anode; physikalisch: Kathode – Kationen wandern dorthin]):
Positive Elektrode (Kathode; physikalisch: Anode):
Elektrolytlösung (Komplexbildung):
Als Gesamtreaktion ergibt sich:
Literaturquellen
[Bearbeiten | Quelltext bearbeiten]- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren. 1. Auflage. Springer, 1998, ISBN 3-540-62997-1.
- H.A. Kiehn: Battery Technology Handbook. 2. Auflage. Marcel Dekker Inc., 2003, ISBN 0-8247-4249-4.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Georges Leclanché: Französisches Patent Nr. 71 865, erteilt 1866


![{\displaystyle \mathrm {Zn^{2+}+2NH_{4}^{+}+2Cl^{-}\rightarrow [Zn(NH_{3})_{2}]Cl_{2}+2H^{+}} \,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/50b290cc0f51bb3de1fcca185db633630ba7aaf3)
![{\displaystyle \mathrm {Zn+2MnO_{2}+2NH_{4}Cl\rightarrow [Zn(NH_{3})_{2}]Cl_{2}+2MnO(OH)} \,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/27c648ee61694bddf51513b674c36b24e88e9efa)