Skraup-Synthese
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie

Die Skraup-Synthese wurde nach dem tschechisch-österreichischen Chemiker Zdenko Hans Skraup (1850–1910) benannt und beschreibt die Synthese von Chinolin und dessen Derivaten aus Anilin, Schwefelsäure, Eisen(II)-sulfat und Glycerin. Die Dehydrierung der Zwischenstufe 1,2-Dihydrochinolin erfolgt durch Nitrobenzol.
Reaktionsmechanismus[Bearbeiten | Quelltext bearbeiten]
α,β-ungesättigte Carbonylverbindungen (Aldehyde, Ketone) reagieren durch eine säurekatalysierte Addition mit aromatischen Aminen zu Chinolin. Die zur Synthese benötigten α,β-ungesättigten Carbonylverbindungen werden häufig erst in einem separaten Syntheseschritt dargestellt (z. B. Crotonaldehyd aus Paraldehyd oder Acrolein aus Glycerin).

Erst im nächsten Schritt wird das Amin addiert. Anschließend erfolgt die säurekatalysierte Aldehydkondensation mit dem aromatischen Kern und bildet das Dihydrochinolin.
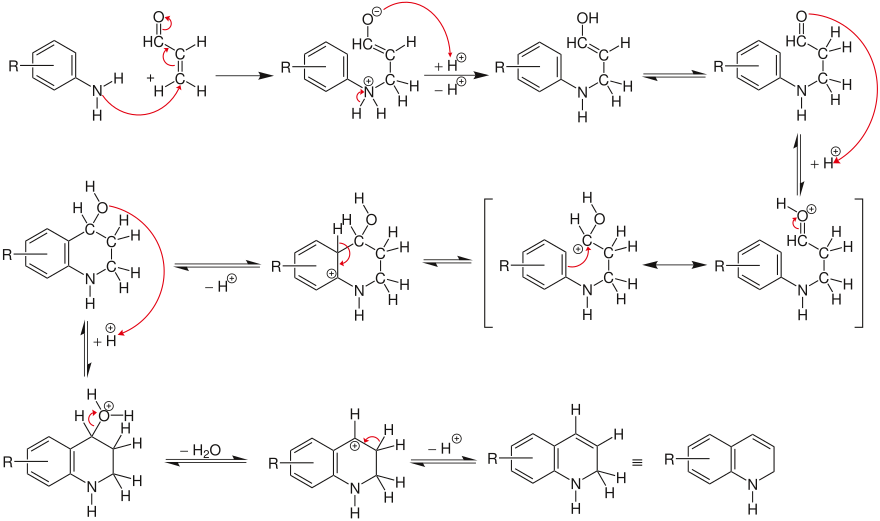
Anschließend wird das Dihydrochinolin durch Nitrobenzol zum aromatischen Chinolin dehydriert, wobei das Nitrobenzol reduziert wird.

Variante[Bearbeiten | Quelltext bearbeiten]
Wird das gebildete Dihydrochinolin zum Tetrahydrochinolin und Chinolinderivat disproportioniert, so handelt es sich um eine Doebner-Miller-Synthese.
Quellen[Bearbeiten | Quelltext bearbeiten]
- Organikum, VEB Deutscher Verlag der Wissenschaften, Berlin 1976
- Adalbert Wollrab: Organische Chemie: Eine Einführung für Lehramts- und Nebenfachstudenten. Springer, 2002, S. 984.