Tantal
 Van Wikipedia, de gratis encyclopedie
Van Wikipedia, de gratis encyclopedie
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Tantal, Ta, 73 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 5, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | grau | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-135-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.304 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 8 ppm (41. Rang)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 180,94788(2)[3] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 145 (200) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 138 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f14 5d3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 7.549571(25) eV[4] ≈ 728.42 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 16.2(5) eV[4] ≈ 1560 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 23.1(1,6) eV[4] ≈ 2230 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 35.0(1,7) eV[4] ≈ 3380 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 48.272(25) eV[4] ≈ 4657.5 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch raumzentriert | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 16,65 g/cm3 (20 °C)[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 6,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch (χm = 1,8 · 10−4)[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 3290 K (3017 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 5693 K[8] (5420 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 10,85 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 753 kJ/mol[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 36 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 3400 m·s−1 bei 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 140 J·kg−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 7,61 · 106 S·m−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 57 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | +5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,81 V (Ta2O5 + 10 H+ + 10 e− → 2 Ta + 5 H2O) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,5 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK | Schweiz: 5 mg·m−3 (gemessen als einatembarer Staub)[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tantal [] ist ein chemisches Element mit dem Symbol Ta und der Ordnungszahl 73; im Periodensystem steht es in der fünften Nebengruppe oder Vanadiumgruppe. Es ist ein selten vorkommendes, duktiles, graphitgraues, glänzendes Übergangsmetall. Tantal wird vorwiegend für Kondensatoren mit hoher Kapazität bei gleichzeitig geringer Größe verwendet. Da das Metall ungiftig und in Bezug auf Körperflüssigkeiten inert ist, wird es auch für Implantate, etwa für Knochennägel, eingesetzt.
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Das Element wurde 1802 von Anders Gustav Ekeberg sowohl in einem Tantalit-Erz aus Kimito in Finnland als auch in Yttererde aus Ytterby in Schweden gefunden. Er trennte ein sehr beständiges Oxid (Tantal(V)-oxid) ab, das sich in keiner Säure löste. Diese Unfähigkeit Säure aufzunehmen, auch wenn sie in großer Menge vorhanden ist, veranlasste Ekeberg in Anspielung auf die mythologische Figur des Tantalos, der mitten in einem Teich stehend nicht trinken konnte, das Metall Tantal zu nennen.[11]
Etwas früher, im Jahr 1801, fand Charles Hatchett in einem Erz aus Massachusetts ein ihm unbekanntes Element, das er Columbium nannte.[12] Die aus den beiden Erzen gewonnenen Oxide wurden 1809 von William Hyde Wollaston verglichen und für Oxide eines einzigen Elementes gehalten. Die gemessenen Unterschiede im spezifischen Gewicht der Oxide erklärte er durch unterschiedliche Oxidationszustände des Elementes.[13] Erst Heinrich Rose misstraute diesem Ergebnis und untersuchte die Erze genauer. Ihm gelang es 1844 zu beweisen, dass es in den Erzen der Columbit-Tantalit-Mischkristallreihe zwei unterschiedliche Elemente gibt. Er benannte das leichtere, im Mineral Columbit vorkommende Element nach Niobe, der Tochter des Tantalos, Niob.[14]
Nach der Entdeckung des neuen Elements wurde von verschiedenen Chemikern versucht, Tantal auch elementar darzustellen. Der Erste, der elementares Tantal durch Reduktion von Kaliumheptafluorotantalat mit Kalium darstellte, war 1824 Jöns Jakob Berzelius.[15] Allerdings bestand sein Metall wie das von Rose dargestellte Tantal nur zu 50 % aus Tantal.[16] Henri Moissan versuchte 1902, Tantal im elektrischen Ofen herzustellen, sein Produkt war jedoch durch den enthaltenen Kohlenstoff sehr hart und spröde.[17]
Der Erste, der reines, duktiles Tantal herstellen konnte, war Werner von Bolton 1903.[18] Er erreichte dies durch Reduktion der glühenden Oxide im Vakuum sowie durch Schmelzen von unreinem Tantalmetall im Vakuum und elektrischem Flammenbogen.[19]
Die erste Anwendung des neuen Elementes war diejenige als Glühfaden in Glühlampen. Der Grund für den Wechsel vom vorher verwendeten Osmium zu Tantal lag darin, dass es leichter zu verarbeiten ist und eine höhere mögliche Nutztemperatur bis zu 2300 °C besitzt.[19] Später wurde es durch Wolfram ersetzt, das einen noch höheren Schmelzpunkt besitzt und damit ein dem Sonnenlicht näheres Lichtspektrum und eine höhere Lichtausbeute ermöglicht.
Im Jahr 1922 wurde mit der Verwendung in Gleichrichtern und ein Jahr später in Radioröhren ein neuer Einsatzzweck für Tantal gefunden.[20]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Tantal ist mit einem Gehalt von 2 ppm in der kontinentalen Erdkruste[21] bzw. 8 ppm in der Erdhülle ein seltenes Element auf der Erde. Die Häufigkeit ist vergleichbar mit der von Arsen und Germanium. Innerhalb der Gruppe nimmt die Häufigkeit jeweils um eine Zehnerpotenz ab. Im Sonnensystem ist 180mTa sogar das seltenste stabile Isotop unter den seltenen Elementen.[22]
Tantal kommt nicht gediegen, sondern nur in Form seiner Verbindungen in verschiedenen Mineralen vor. Auf Grund der Ähnlichkeit der beiden Elemente enthalten Tantalerze stets Niob und umgekehrt (Vergesellschaftung). Die wichtigsten Tantal-Minerale sind Vertreter der Columbit-Tantalit-Mischkristallreihen mit der allgemeinen Formel (Fe,Mn)(Nb,Ta)2O6, die je nach Dominanz von Niob oder Tantal als Columbit (Mischkristallreihe Columbit-(Fe) – Columbit-(Mn)) oder Tantalit (Mischkristallreihe Tantalit-(Fe) – Tantalit-(Mn)) bezeichnet werden, sowie Vertreter der Tapiolit-Reihe. Tantalreiche Columbite werden auch als Tantalite bezeichnet. Beispiele für tantalreiche Minerale dieser Reihen sind Tapiolith-(Fe), (Fe2+,Mn2+)(Ta,Nb)2O6, und Tantalit-(Mn), Mn2+Ta2O6.[23] Häufig werden diese Erze auch Coltan genannt. Coltan ist ein modernes, vorrangig in der Politik verwendetes Akronym aus Columbit – Tantalit, welches Niob-Tantal-Erze bezeichnet, die zu den vier Mischkristallreihen Columbit-(Fe) – Columbit-(Mn), Tantalit-(Mn) – Tantalit-(Fe), Columbit-(Mn) – Tantalit-(Mn) und Columbit-(Fe) – Tantalit-(Fe) zählen. Seltenere tantalreiche Minerale sind die Vertreter der Mikrolithgruppe innerhalb der Pyrochlor-Obergruppe sowie Thoreaulith.
Ein Großteil des Tantalangebots der westlichen Welt stammt allerdings aus Schlacken, die bei der Verhüttung von Zinnerzen wie vor allem Kassiterit anfallen. 2011 entfielen geschätzte 40–50 % des weltweiten Tantalabbaus auf Ruanda und die Demokratische Republik Kongo.[24] 2020 waren dagegen die Demokratische Republik Kongo mit 780 Tonnen und Brasilien mit 430 Tonnen, Nigeria mit 260 Tonnen und Ruanda mit 254 Tonnen die wichtigsten Förderländer von Tantalerzen. Zusammen stellten diese 4 Länder damit 80 % der globalen Primärproduktion.[25] Tantal steht wegen dieser hohen Abhängigkeit von wenigen Ländern auf der Liste kritischer Rohstoffe der EU und der USA.[26][27] Zwei Bergwerke in Australien waren bedeutend: Die Wodgina Mine im Nordwesten und die Mine in Bridgetown-Greenbushes Shire in Westaustralien. Daneben findet man tantalreiche Erze auch in Kanada und verschiedenen afrikanischen Ländern wie Äthiopien, Mosambik und Ruanda. In den Medien bekannt geworden sind die Vorkommen im Osten der Demokratischen Republik Kongo, die im Kongokrieg 1996–2008 stark umkämpft waren[28][29] und in den nachfolgenden bewaffneten Konflikten weiterhin eine wichtige Rolle spielen. Einige Tantalerze wie z. B. die tantalreichen Vertreter der Columbit-Tantalit-Mischkistallreihe wurden 2012 von der US-amerikanischen Börsenaufsicht SEC als so genanntes Konfliktmineral eingestuft,[30] dessen Verwendung für Unternehmen gegenüber der SEC berichtspflichtig ist. Als Grund hierfür werden ebendiese Produktionsorte im Osten des Kongo angeführt, die von Rebellen kontrolliert werden und so im Verdacht stehen, bewaffnete Konflikte mitzufinanzieren.[31]

| Land | 2018 | 2019 | 2020 |
|---|---|---|---|
| (in Tonnen enthaltenes Tantal) | |||
| 23 | 67 | 34 | |
| 70 | 70 | 69 | |
| 250 | 430 | 470 | |
| 23 | 38 | 24 | |
| 90 | 76 | 74 | |
| 740 | 580 | 780 | |
| n.bek. | n.bek. | 43 | |
| 200 | 180 | 260 | |
| 421 | 336 | 254 | |
| 38 | 26 | 49 | |
| n.bek. | n.bek. | 38 | |
| 40 | 45 | 0 | |
| Gesamt (gerundet) | 1.890 | 1.850 | 2.100 |
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Da in den zur Tantalgewinnung verwendeten Erzen Tantal und Niob immer zusammen vorliegen, müssen sie für eine Gewinnung der Reinmetalle getrennt werden. Dies wird durch die große Ähnlichkeit der beiden Elemente erschwert.
Das erste Verfahren zur Trennung wurde 1866 von Jean Charles Galissard de Marignac entwickelt. Er nutzte dabei die unterschiedliche Löslichkeit der beiden Elemente in verdünnter Flusssäure. Tantal bildet das gering lösliche K2TaF7, Niob das gut lösliche K3NbOF5 ·2 H2O.[34]
Das heute technisch verwendete Verfahren beruht auf Extraktion und nutzt die unterschiedliche Löslichkeit von komplexen Fluorsalzen in Wasser und bestimmten organischen Lösungsmitteln. Dabei wird das Erzgemisch zunächst in konzentrierter Flusssäure oder Gemischen aus Fluss- und Schwefelsäure gelöst. Es bilden sich die komplexen Fluoride [NbOF5]2− und [TaF7]2−. Nachdem unlösliche Bestandteile abfiltriert wurden, kann die Trennung durch Flüssig-Flüssig Extraktion mit Hilfe von Methylisobutylketon erfolgen. Wird die Lösung mit Methylisobutylketon versetzt, gehen die Niob- und Tantalkomplexe in die organische Phase über, während andere Elemente wie Eisen oder Mangan in der wässrigen Phase zurückbleiben. Bei Zugabe von Wasser zur abgetrennten organischen Phase löst sich nur der Niobkomplex in diesem, das Tantal bleibt im Methylisobutylketon zurück.[35]
Das Tantal kann mit Hilfe von Kaliumfluorid als schwerlösliches Kaliumheptafluorotantalat K2[TaF7] gefällt werden. Die Reduktion zu elementarem Tantal erfolgt meist durch Natrium.
- Reduktion mit Natrium
Eine mögliche Alternative zur Extraktion besteht in der fraktionierten Destillation. Dazu werden die unterschiedlichen Siedepunkte der beiden Chloride Niob(V)-chlorid und Tantal(V)-chlorid genutzt. Diese können bei hohen Temperaturen aus den Erzen mit Chlor und Koks gewonnen werden. Nach der Trennung wird das Tantalchlorid ebenfalls mit Natrium zum Metall reduziert.
Neben den Columbit-Tantalit-Erzen sind Schlacken aus der Zinnverhüttung eine wichtige Quelle für die Tantalgewinnung (enthalten wenige Prozent Tantal).
Recycling
[Bearbeiten | Quelltext bearbeiten]Tantal aus Kondensatoren in elektronischen Baugruppen wird fast gar nicht recycelt. Die bei der Pulverherstellung und der Herstellung von Kondensatoren entstehenden internen Abfälle dagegen kommen für das Recycling in Frage. Bei der Herstellung von Tantal-Walzerzeugnissen (20 % des Verbrauchs) fallen Späne und Fehlchargen an, die durch Umschmelzen effektiv zu recyceln sind. Außerdem sind Tantalcarbid-Legierungzusätze aus Hartmetallen und die Reste von Sputtertargets recycelbar.
Tantal(V)-oxid aus Gläsern und solches in Form von Lithiumtantalat-Einkristallen in Elektronikbauteilen erfordert einen aufwendigen chemischen Recyclingprozess. Dieser umfasst Rösten, Auflösen in Flusssäure oder Schwefelsäure, Solventextraktion mit Ketonen sowie die Fällung von Tantal(V)-oxid oder die Kristallisation von Kaliumfluorotantalat. Diese werden anschließend im Elektronenstrahlofen aufgeschmolzen.[36]
Aus End-of-Life-Schrotten werden weltweit ca. 10 % des enthaltenen Tantals zurückgewonnen, die fast ausschließlich aus gewerblichen Anwendungen stammen. Die Rückführung von Tantal aus Superlegierungen und Sputtertargets funktioniert besser als die Rückführung aus Kondensatoren, Chemikalien und Hartmetallen. In Konsumgütern wie z. B. Smartphones und anderen mobilen elektronischen Geräten ist zwar Tantal enthalten, jedoch ist dessen Konzentration für das Recycling zu gering. Zusammen mit Neuschrotten, die bei der Produktion und Weiterverarbeitung anfallen, ergibt sich eine Schrotteinsatzquote von ca. 25 % in der Tantalproduktion.[37]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]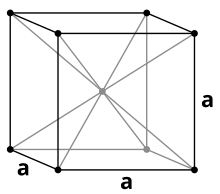
Tantal ist ein deutlich lilagraues, stahlhartes (Vickershärte: 60–120 HV[39]), hochschmelzendes Schwermetall, das in den meisten seiner Eigenschaften dem Niob ähnelt. Es kristallisiert in einer kubisch-raumzentrierten Kristallstruktur. Neben der kubischen α-Struktur ist auch β-Tantal bekannt, das in einer tetragonalen, dem β-Uran entsprechenden, Kristallstruktur mit den Gitterparametern a = 1021 pm und c = 531 pm kristallisiert. Diese Modifikation ist metastabil und lässt sich durch Elektrolyse einer Tantalfluoridschmelze gewinnen.[40]
Mit einem Schmelzpunkt von etwa 3000 °C[41] besitzt Tantal den vierthöchsten Schmelzpunkt aller Elemente nach Wolfram, Kohlenstoff und Rhenium. Ist im Metall nur eine geringe Menge Kohlenstoff oder Wasserstoff eingelagert, steigt der Schmelzpunkt deutlich an. Ein unterstöchiometrisches Tantalcarbid besitzt mit einem Schmelzpunkt von 3983 °C[42] einen der höchsten Schmelzpunkte aller Substanzen.
Unterhalb einer Sprungtemperatur von 4,3 Kelvin wird Tantal zum Supraleiter.[39]
Während reines Tantal duktil ist und sich stark dehnen lässt (Zugfestigkeit: 240 MPa[39]), verändern schon kleine Mengen Beimengungen an Kohlenstoff oder Wasserstoff die mechanische Festigkeit deutlich. Das Material wird spröde und schwer zu verarbeiten. Man nutzt diesen Sachverhalt zur Herstellung von Tantalpulver. Es wird in der Technik mit Wasserstoff beladen und somit versprödet, dann entsprechend zerkleinert und bei höherer Temperatur durch Ausheizen wieder vom Wasserstoff befreit.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Tantal ist ein unedles Metall und reagiert bei hohen Temperaturen mit den meisten Nichtmetallen, wie Sauerstoff, den Halogenen oder Kohlenstoff. Bei Raumtemperatur ist das Metall allerdings durch eine dünne Schicht aus Tantal(V)-oxid geschützt und damit passiviert. Eine Reaktion findet erst ab einer Temperatur von etwa 300 °C statt.[39] Als Pulver ist es ein entzündbarer Feststoff, der durch kurzzeitige Einwirkung einer Zündquelle leicht entzündet werden kann und dann nach deren Entfernung weiterbrennt. Die Entzündungsgefahr ist umso größer, je feiner der Stoff verteilt ist. Das Metall in kompakter Form ist nicht brennbar.[9]
In den meisten Säuren ist Tantal wegen der Passivierung nicht löslich, sogar Königswasser vermag das Metall nicht zu lösen. Angegriffen wird Tantal nur von Flusssäure, Oleum (einer Mischung von Schwefelsäure und Schwefeltrioxid) und Salzschmelzen.
Isotope
[Bearbeiten | Quelltext bearbeiten]Es sind insgesamt 30 Isotope sowie 26 Kernisomere von 155Ta bis 185Ta bekannt.[43] Natürliches Tantal besteht fast ausschließlich (zu 99,988 %) aus dem Isotop 181Ta. Daneben kommt zu 0,012 % das Kernisomer 180mTa vor.
180mTa ist das einzige langlebige, natürlich vorkommende Nuklid, das nicht in seinem Grundzustand, sondern in einem angeregten Zustand vorliegt. Es wurde bislang kein radioaktiver Zerfall beobachtet, die Halbwertszeit des Isomers muss bei mindestens 2 · 1016 Jahren liegen.[44] Der Grundzustand 180Ta ist dagegen instabil und zerfällt mit einer Halbwertszeit von nur 8,125 Stunden. 180mTa hat im Sonnensystem eine Häufigkeit von 2,49 · 10−6 (bezogen auf Silicium = 1 · 106).[22]
Verwendung
[Bearbeiten | Quelltext bearbeiten]
Der größte Teil des Tantals (weltweite Jahresproduktionsmenge 1.400 t) wird für sehr kleine Kondensatoren mit hoher Kapazität verwendet. 2007 wurden 60 % des Tantals für die Herstellung von Kondensatoren gebraucht.[25] Diese Tantal-Elektrolytkondensatoren werden überall in der modernen Mikroelektronik, beispielsweise für Mobiltelefone und im Automobilbau, eingesetzt. Die Wirkung beruht auf der selbst in sehr dünner Ausführung noch stabilen und sicher isolierenden Tantaloxidschicht auf der Oberfläche der aufgewickelten Tantalfolie. Je dünner die Schicht zwischen den Elektroden ist, desto höher wird die Kapazität bei gleichbleibender Folienfläche; zudem hat Tantaloxid eine extrem hohe Permittivität, die ebenfalls die Kapazität erhöht.
Da Tantal nicht giftig ist und nicht mit Körpergewebe oder -flüssigkeiten reagiert, wird elementares Tantal für medizinische Implantate und Instrumente eingesetzt. Es werden beispielsweise Knochennägel, Prothesen, Klammern und Kieferschrauben aus Tantal gefertigt.[39] Als Beschichtung auf einem porösen Karbon-Gitter erzielt es eine besonders gute Osseointegration, weshalb Tantal-beschichtete Implantate vor allem in der Rekonstruktionschirurgie bei größeren tumor- oder infektbedingten Knochensubstanzverlusten eingesetzt wird, ohne dass es allerdings antimikrobiell wirkt.[45] Daneben ist es ein aufgrund der hohen Kosten wenig eingesetztes[39] Röntgenkontrastmittel.[46]
In der chemischen Industrie wird Tantal wegen seiner Beständigkeit eingesetzt. Es dient als Auskleidungsmaterial für Reaktionskessel und wird für Wärmeaustauscher und Pumpen verwendet. Für diese Zwecke wird meist kein reines Tantal, sondern Legierungen mit 2,5–10 % Wolfram verwendet. Diese sind stabiler und widerstandsfähiger als reines Tantal. Gleichzeitig bleibt die erwünschte Duktilität erhalten. Weitere Verwendungszwecke sind Laborgeräte, Spinndüsen und die Kathoden von Elektronenröhren. Hier kommt Tantal zugute, dass es in der Lage ist, bei 800 °C bis zu 740 Volumenteile Gase aufzunehmen (Getterwirkung), was ein hohes Vakuum in den Röhren gewährleistet.
Superlegierungen, die im Bau von Turbinen und Flugzeugtriebwerken eingesetzt werden, enthalten bis zu 9 % Tantal. So erhöht der Zusatz von 3–4 % Tantal zu einer Nickel-Superlegierung die Festigkeit des Materials bei hohen Temperaturen.[39]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Unter Laborbedingungen verursacht der Umgang mit Tantal und seinen Verbindungen normalerweise keine Probleme. Elementares Tantal wie auch Tantalverbindungen sind nicht toxisch. Es gibt aber vage Hinweise auf krebsauslösendes Verhalten einiger Tantalverbindungen. Von Tantalpulver und -staub geht – wie auch von anderen fein verteilten Metallen – eine hohe Feuer- und Explosionsgefahr aus.
Verbindungen
[Bearbeiten | Quelltext bearbeiten]Tantal(V)-oxid ist ein weißes Pulver, das zur Herstellung hochlichtbrechender Gläser und spezieller Kristallmaterialien verwendet wird.
Tantalcarbid dient mit seiner Schmelztemperatur von 3880 °C und einer Härte, die ähnlich der von Quarz ist, als Schutzschicht auf hochwarmfesten Legierungen in Triebwerken und Schneidwerkzeugen.
Literatur
[Bearbeiten | Quelltext bearbeiten]- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage. Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
- Klaus Andersson, Karlheinz Reichert, Rüdiger Wolf: Tantalum and Tantalum Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, 2000, doi:10.1002/14356007.a26_071.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Tantal) entnommen.
- ↑ CIAAW, Standard Atomic Weights Revised 2013.
- ↑ a b c d e Eintrag zu tantalum in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 13. Juni 2020.
- ↑ a b c d e Eintrag zu tantalum bei WebElements, www.webelements.com, abgerufen am 13. Juni 2020.
- ↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1260.
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ a b c Eintrag zu Tantal, Pulver in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. April 2017. (JavaScript erforderlich)
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7440-25-7 bzw. Tantal), abgerufen am 2. November 2015.
- ↑ Anders Gustav Ekeberg: Ueber ein neues Metall, Tantalum, welches zugleich mit der Yttererde in einigen schwedischen Fossilien entdeckt worden ist; nebst einigen Anmerkungen über die Eigenschaften der Yttererde, in Vergleichung mit der Beryllerde. In: Crells Annalen der Chemie. 1, 1803, S. 1–21 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ C. Hatchett: An Analysis of a Mineral Substance from North America, Containing a Metal Hitherto Unknown. In: Philosophical Transactions of the Royal Society of London. 92, 1802, S. 49–66, doi:10.1098/rstl.1802.0005.
- ↑ W. H. Wollaston: On the Identity of Columbium and Tantalum. In: Philosophical Transactions of the Royal Society of London. 99, 1809, S. 246–252, doi:10.1098/rstl.1809.0017.
- ↑ Heinrich Rose: Ueber die Zusammensetzung der Tantalite und ein im Tantalite von Baiern enthaltenes neues Metall. In: Annalen der Physik. 139, 10, 1844, S. 317–341 (Digitalisat auf Gallica).
- ↑ J.J. Berzelius: Flussspatsaure Tantalsäure und flusspatsaure Tantalsalze, Tantalum und verschiedene seiner Verbindungen. In: Annalen der Physik und Chemie. 4, 1825, S. 6–22 (Digitalisat auf Gallica).
- ↑ Werner von Bolton: Das Tantal, seine Darstellung und seine Eigenschaften. In: Z. f. Elektrochem. 11, 1905, S. 45–52 (Referat in: Angew. Chem., 1905, 18, S. 1451–1466, doi:10.1002/ange.19050183603).
- ↑ Henri Moissan: Sur la préparation du tantale au four electrique et sur ses propriétés. In: Comptes Rendus. 134, 1902, S. 211–215 (Digitalisat auf Gallica).
- ↑ Eintrag zu Tantal. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. April 2014.
- ↑ a b Ziemann: Die Tantallampe. Vortrag im Verein deutscher Chemiker, Halle (Saale), 19. März 1905, In: Angew. Chem. 18, 1905, S. 790–800, doi:10.1002/ange.19050182005.
- ↑ S. I. Venetzkij: Erzählungen über Metalle. Leipzig 1988, ISBN 3-342-00324-3.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 85. Auflage. CRC Press, Boca Raton, Florida 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea.
- ↑ a b J. Laeter, N. Bukilic: Isotope abundance of 180Tam and p-process nucleosynthesis. In: Physical Review C. 72, 2005, S. , doi:10.1103/PhysRevC.72.025801.
- ↑ T. S. Ercit, M. A. Wise, R. Černý: Compositional and structural systematics of the columbite group. In: American Mineralogist. 80, 1995, S. 613–619 (PDF)
- ↑ ddc.arte.tv
- ↑ a b Tantalproduktion 2022 (PDF; 86 kB) herausgebracht vom United States Geological Survey.
- ↑ [1] Europäische Kommission Critical Raw Materials.
- ↑ [2] Federal Register der US-Bundesregierung, 2022 final list of critical materials.
- ↑ Krieg in Kongo: Auf der dunklen Seite der digitalen Welt. In: Frankfurter Allgemeine Zeitung. 23. August 2010.
- ↑ Benjamin Dürr: Der Stoff, aus dem die Handys sind. In: stern.de. 16. März 2010.
- ↑ SEC: Conflict Minerals - Final Rule. 2012, S. 34–35, (PDF, 1,96 MB, engl.)
- ↑ SEC Adopts Rule for Disclosing Use of Conflict Minerals. (engl.), Zugriff am 3. September 2012.
- ↑ 1990-1993: U.S. Geological Survey, 1994 Minerals Yearbook. (PDF; 174 kB). (MYB), "COLUMBIUM (NIOBIUM) AND TANTALUM" By Larry D. Cunningham, Table 10; 1994–1997: MYB 1998 (PDF; 79 kB) Table 10; 1998–2001: MYB 2002 (PDF; 322 kB) p. 21.13; 2002–2003: MYB 2004 (PDF; 599 kB) p. 20.13; 2004: MYB 2008 (PDF; 76 kB) p. 52.12; 2005–2009: MYB 2009 (PDF; 132 kB) p. 52.13. USGS did not report data for other countries (China, Kazakhstan, Russia, etc.) owing to data uncertainties.
- ↑ [3] United States Geological Survey Statistiken und Informationen zu Tantal.
- ↑ Jean Charles Galissard de Marignac: Recherches sur les combinaisons du niobium. In: Annales de chimie et de physique. 4, 1866, S. 5–75 (Digitalisat auf Gallica).
- ↑ Joachim Eckert: Niobium and Niobium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, 2000, doi:10.1002/14356007.a17_251.
- ↑ Eintrag zu Tantal-Recycling. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. April 2014.
- ↑ Tantal Recyclingsteckbrief. (PDF) Rewimet e. V., S. 8, abgerufen am 3. März 2021.
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. B30, 1974, S. 193–204.
- ↑ a b c d e f g Klaus Andersson, Karlheinz Reichert, Rüdiger Wolf: Tantalum and Tantalum Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, 2000.
- ↑ Alla Arakcheeva, Gervais Chapuis, Vladimir Grinevitch: The self-hosting structure of β-Ta. In: Acta Crystallographica Section B Structural Science. 58, 2002, S. 1–7, doi:10.1107/S0108768101017918.
- ↑ L. Malter, D. Langmuir: Resistance, Emissivities and Melting Point of Tantalum. In: Physical Review. 55, 1939, S. 743–747, doi:10.1103/PhysRev.55.743.
- ↑ D. J. Rowcliffe, W. J. Warren: Structure and properties of tantalum carbide crystals. In: Journal of Materials Science. 5, 1970, S. 345–350, doi:10.1007/BF02397788.
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- ↑ Mikael Hult, J. S. Elisabeth Wieslander, Gerd Marissens, Jo l Gasparro, Uwe Waetjen, Marcin Misiaszek: Search for the radioactivity of 180mTa using an underground HPGe sandwich spectrometer. In: Applied Radiation and Isotopes. 67, 2009, S. 918–921, doi:10.1016/j.apradiso.2009.01.057.
- ↑ P. L. Harrison, T. Harrison, I. Stockley, T. J. Smith: Does Tantalum exhibit any intrinsic antimicrobial or antibiofilm properties? The Bone & Joint Journal 2017, Band 99-B, Ausgabe 9 vom September 2017 Seiten 1153–1156, [DOI:10.1302/0301-620X.99B9.BJJ-2016-1309.R1]
- ↑ E. Kammler, W. T. Ulmer: Ein neuer Weg in der Bronchographie – Über die Darstellung des Trascheobronchialbaumes beim Tier durch Inhalation von Tantalstaub. In: Pneumologie. Ausgabe 144, Band 4, Springer-Verlag 1971, S. 344–351.

![{\displaystyle \mathrm {K_{2}[TaF_{7}]+5\ Na\longrightarrow Ta+5\ NaF+2\ KF} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a8e5249d029b3b11174bfa47836de66d65159664)