اوره

| اوره | |||
|---|---|---|---|
 | |||
| |||
 | |||
دیگر نامها Carbamide carbonyl diamide carbonyldiamine diaminomethanal diaminomethanone | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۵۷-۱۳-۶ | ||
| پابکم | ۱۱۷۶ | ||
| کماسپایدر | ۱۱۴۳ | ||
| UNII | 8W8T17847W | ||
| دراگبانک | DB03904 | ||
| KEGG | D00023 | ||
| ChEBI | CHEBI:16199 | ||
| ChEMBL | CHEMBL۹۸۵ | ||
| شمارهٔ آرتیئیسیاس | YR6250000 | ||
| کد اِیتیسی | B05,D02AE01 (WHO) | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
| |||
| |||
| خصوصیات | |||
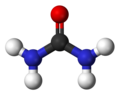
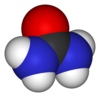
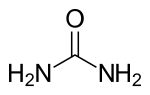
| فرمول مولکولی | CH4N2O۱ | ||
| جرم مولی | ۶۰٫۰۶ g mol−1 | ||
| شکل ظاهری | White solid | ||
| چگالی | 1.32 g/cm3 | ||
| دمای ذوب | ۱۳۳–۱۳۵ °C | ||
| انحلالپذیری در آب | 107.9 g/100 ml (20 °C) 167 g/100ml (40 °C) 251 g/100 ml (60 °C) 400 g/100 ml (80 °C) | ||
| انحلالپذیری | 50g/L ethanol 500g/L glycerol[۱] | ||
| خاصیت بازی (pKb) | pKBH+ = 0.18[۲] | ||
| ساختار | |||
| گشتاور دوقطبی | 4.56 D | ||
| خطرات | |||
| MSDS | JT Baker | ||
| شاخص ئییو | Not listed | ||
| نقطه اشتعال | |||
| LD50 | 8500 mg/kg (oral, rat) | ||
| ترکیبات مرتبط | |||
| مرتبط با ureas | تیورآ هایدروکسی کاربیماید | ||
| ترکیبات مرتبط | کاربامید پروکساید Urea phosphate | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
اوره (به فرانسوی: Urée) یا کاربامید (به فرانسوی: carbamide) یک ترکیب آلی با فرمول شیمیایی CO(NH₂)₂ است. اوره در ابتدا به صورت آمونیاک بوده که از تجزیهٔ آمینواسیدها ساخته میشود. آمونیاک به دلیل سمیت زیاد برای بدن مضر است؛ پس آمونیاکها در کبد با کربن دیاکسید (توسط یاختههای کبد ایجاد شده) واکنش نشان میدهند و به اوره تبدیل میشوند. این کار باعث کم شدن سمیت آن میشود تا بدن بتواند آن را در خود نگه دارد و در کلیه توسط نفرونها دفع کند. اوره، در متابولیسم ترکیبات حاوی نیتروژن در بدن جانوران نقش مهمی ایفا میکند و در عین حال، مادهٔ اصلی حاوی نیتروژن، در ادرار پستانداران بهشمار میآید. این ترکیب، سخت، بیرنگ، و بیبو است (گرچه آمونیاکی که در حضور آب از آن حاصل میشود و شامل بخار آب موجود در هوا نیز است، دارای بوی تندی است)؛ نه خاصیت اسیدی دارد و نه قلیایی، بسیار محلول در آب و نسبتاً غیر سمی است، از اوره به صورت گستردهای در کودهای شیمیایی به عنوان یک منبع غنی و مناسب نیتروژن استفاده میشود. اوره همچنین یکی از مواد اولیهٔ مهم در صنایع شیمیایی است. سنتز و به وجود آوردن این ترکیب آلی از یک پیشساز غیرآلی یا معدنی، توسط فریدریش وهلر در سال ۱۸۲۸، نقطهٔ عطف بسیار مهمی در توسعه و پیشرفت دانش شیمی بهشمار میرود.
دو واژهٔ اوره و کاربامید، همچنین برای نامیدن یک طبقهٔ خاص از مواد و ترکیبات شیمیایی که در همان گروه عملکردی RR'-CO-RR مشترک هستند نیز به کار میرود. بدین معنا که یک گروه کربونیل به دو آمین آلی باقیمانده متصل شدهاست. برای مثال در این مورد میتوان به کاربامید پروکساید، آلانتوئین و هیدانتوئین اشاره کرد. اورهها وابستگی نزدیکی با بیورتها دارند و ساختمان شیمیایی آنها، مربوط و مرتبط با ساختار آمیدها، کارباماتها، دی ایمیدها، کاربودیمیدها و تیوکاربامیدها است.
تاریخچه
[ویرایش]اوره برای نخستین بار، در سال ۱۷۷۳ میلادی توسط شیمیدان فرانسوی به نام هیلاری رول درون ادرار کشف گردید. در سال ۱۸۲۸ میلادی، شیمیدان آلمانی فریدریش وهلر، طی تلاشی ناموفق برای تهیه کردن سیانات آمونیم، و هنگامی که به ایزوسیانات نقره، کلرید آمونیوم اضافه کرد، اوره به دست آورد:
AgNCO + NH4Cl → (NH2)۲CO + AgCl
این اولین باری بود که یک ترکیب آلی به صورت مصنوعی از مواد پیشساز غیرآلی (معدنی) سنتز میگردید، بدون اینکه جانداران، هیچگونه دخالتی در این روند داشته باشند. نتایج حاصل از این تجربه یا آزمایش، بهطور ضمنی اعتقاد به اصالت حیات و نظریهٔ ازلی بودن موجودات زنده را، بیاعتبار ساخت: بر مبنای این نظریه، مواد شیمیایی که بدن جانداران را تشکیل میدهند، اساساً متفاوت از همین مواد در اشیاء و پدیدههای بیجان هستند. درک همین موضوع، نقش بسیار مهمی در توسعهٔ شیمی آلی ایفا نمود. در واقع همین کشف مهم وهلر، موجب شد که او نامهٔ پیروزمندانهای به یوناس یاکوب برزیلیوس بنویسد و طی آن اشاره کند که:
«من باید به شما بگویم که: من قادر هستم بدون استفاده از کلیهها، چه در انسان و چه در سگ، اوره تولید بکنم!، سیانات آمونیوم، در واقع همان اورهاست…»
بسیاری معتقدند که وهلر را باید به خاطر همین اکتشاف، پدر شیمی آلی در نظر گرفت.
فیزیولوژی
[ویرایش]اوره در بدن بسیاری از موجودات زنده، به عنوان قسمتی از سیکل یا چرخهٔ اوره، از اکسیداسیون اسیدهای آمینه یا آمونیاک تولید میشود. در چرخهٔ مذکور، گروههای آمینه اهدا شده توسط آمونیاک و ال - آسپارتات، به اوره تبدیل میگردند، در حالی که ال - اورنیتین، سیترولین، ال آرژینینوسوکسینات و ال آرژینین به عنوان واسطه عمل میکنند. تولید اوره در کبد اتفاق میافتد و توسط ان استیل گلوتامات تنظیم میشود. اوره به شکل محلول در خون یافت میشود (در محدودهٔ مرجع بین ۲٫۵ تا ۷٫۵ میلیمول بر لیتر) و توسط کلیهها به عنوان جزئی از ادرار دفع میگردد. علاوه بر این، مقدار کمی از اوره هم در عرق ترشح میشود، که دفع آن همراه با کلرید سدیم و آب است.
اسیدهای آمینهای که از غذا دریافت میشوند، در صورتی که برای سنتز پروتئینها و دیگر مواد بیولوژیکی، مورد استفاده قرار نگیرند، توسط بدن اکسیده میشوند و اوره و دیاکسید کربن حاصل میکنند، که به عنوان منبعی جایگزین برای انرژی است. مسیر اکسیداسیون، با حذف گروه آمینه توسط ترانسآمینازها آغاز میشود و سپس گروه آمینه چرخهٔ اوره را تغذیه میکند.
آمونیاک یکی دیگر از محصولات فرعی مشترک متابولیسم ترکیبات نیتروژنی است. مولکولهای آمونیاک نسبت به اوره کوچکتر هستند، همچنین در مقایسه با اوره، میزان تحرّک و فرّاریت بیشتری هم دارند. اگر به این ترکیب اجازهٔ تجمع داده شود، آمونیاک پیاچ داخل سلولی را تا سطوح سمی بالا خواهد برد؛ بنابراین بسیاری از جانداران آمونیاک را به اوره تبدیل میکنند، حتی اگر چنین سنتزی به هزینه کردن انرژی خالص نیاز داشته باشد. خنثی بودن اوره در مرحلهٔ عمل و اینکه این ترکیب بسیار محلول در آب است، آن را تبدیل به وسیلهٔ امنی برای حمل و نقل و دفع نیتروژن اضافی بدن نمودهاست.
در آب، گروههای آمین ضمن جایگزینی آهسته توسط مولکولهای آب، آمونیاک و آنیون کربنات تولید میکنند. به همین دلیل، ادرار مانده و کهنه، بوی قویتر و تندتری نسبت به ادرار تازه دارد.
در انسان
[ویرایش]تنظیم اوره توسط کلیهها یک بخش حیاتی از سوختوساز یا متابولیسم بدن انسان را تشکیل میدهد. علاوه بر نقشی که اوره به عنوان حامل مواد زائد نیتروژندار در بدن ایفا میکند، این ترکیب در تبادلات جاری متقابلی که در سیستم نفرونها انجام میپذیرد (تبادلات نفرونی) نیز نقش دارد، بدین صورت که اجازه میدهد تا جذب مجدد (بازجذب) آب و یونهای مهمی که به منظور دفع، در ادرار ترشح شدهاند، صورت بگیرد. خود اوره در لولههای جمعکننده ادرار واقع در مدولای داخلی نفرونها بازجذب میشود، در نتیجه میزان اسمولاریته در مدولای اینترسیشیال، اطراف لوله صعودی (بالا رونده) و نازک قوس هنله افزایش مییابد که همین بالا رفتن اسمولاریته به نوبهٔ خود باعث بازجذب مجدد آب میشود. با فعالیت حامل شماره ۲ اوره یا همان اوره ترانسپورتر ۲، بخشی از این اوره بازجذب شده، در نهایت دوباره به شاخهٔ نازک و صعودی توبول، جریان پیدا میکند، و سرانجام از طریق لولههای جمعآوریکننده، به درون ادرار دفع میشود.
این مکانیسم، که توسط هورمون ضد ادراری یا آنتیدیورتیک کنترل میشود، به بدن اجازه میدهد تا ادرار هیپراسموتیک ایجاد کند، یعنی ادراری که غلظت بالاتری نسبت به مواد حل شده در پلاسمای خون دارد. این مکانیسم همچنین برای جلوگیری از، از دست دادن آب نیز مهم است و به حفظ فشار خون، و نیز حفظ غلظت مناسب یونهای سدیم در پلاسمای خون کمک میکند.
در گونههای دیگر
[ویرایش]در جانداران آبزی، رایجترین شکل ضایعات نیتروژن آمونیاک است، در حالی که در ارگانیزمهای ساکن خشکی، آمونیاک سمی به اوره یا اسید اوریک تبدیل میگردد. اوره را میتوان در ادرار پستانداران و دوزیستان، و همچنین بعضی از ماهیها پیدا کرد. در پرندگان و خزندگان سوسماری شکل، سوختوساز نیتروژن تا حدودی متفاوت است، نیاز به آب در این نوع سوخت و ساز کمتر است و منجر به دفع نیتروژن در شکل اسید اوریک میشود. قابل توجهاست که در بچه وزغها یا نوزادان قورباغه، آمونیاک دفع میگردد، اما این وضع بعد از دگردیسی آنها به سمت تولید اوره تغییر جهت مییابد. بدین ترتیب و بر اساس، تعمیمی که در فوق ارائه شد، وجود مسیر و چرخهٔ اوره نه تنها در پستانداران و دوزیستان، بلکه در بسیاری از جانداران دیگر، همچون پرندگان، مهرهداران، حشرات، گیاهان، مخمرها، قارچها، و حتی در میکروارگانیسمها، مستند شده و به اثبات رسیدهاست.
کاربردها
[ویرایش]کشاورزی
[ویرایش]بیشتر از ۹۰٪ از تولید اوره در دنیا، به منظور استفاده به عنوان کودهای شیمیایی حاوی نیتروژن است. در کاربردهای عمومی، اوره دارای بالاترین مقدار ازت در میان تمامی کودهای جامد نیتروژنی است (۴۶٫۷ ٪). بر این اساس، اوره پایینترین هزینههای حمل و نقل را به ازای هر واحد از تغذیه نیتروژنی به بار میآورد.
اوره در خاک، هیدرولیز شده و به آمونیاک و دیاکسید کربن مبدل میگردد. آمونیاک حاصل از این فرایند، توسط باکتریهای موجود در خاک به نیترات اکسیده میشود و در نتیجه میتواند توسط گیاه جذب گردد. اوره همچنین در بسیاری از موارد، در فرمولاسیون چند جزئی کودهای جامد نیز، مورد استفاده واقع میشود. از آنجا که اوره به میزان زیادی محلول در آب است، بنابراین برای استفاده در محلولهای کودی نیز بسیار مناسب است (از جمله در ترکیب با آمونیوم نیترات و به صورت: UAN)، به عنوان مثال در کودهای foliar feed'خوراک برگ مانند (کود مخصوص برگ؟).
در بهکارگیری کودها، شکل گرانولی کود بر شکل پریل آن ارجح است، چراکه به دلیل باریکتر بودن اندازه ذرات در نوع گرانولی توزیع و انتشار آن راحتتر انجام میپذیرد و این برای برنامه مکانیکی یک امتیاز بهشمار میآید.
شایعترین نوع ناخالصی موجود در اوره صناعی، بیورت است، که موجب تضعیف رشد گیاه میشود.
اوره بهطور معمول، به میزان بین ۴۰ تا ۳۰۰ کیلوگرم به ازای هر هکتار، [در اراضی کشاورزی] پخش میگردد، اما در مجموع این میزان، متفاوت است. در برنامههای کوچکتر میزان اتلاف و ضرر به علت شسته شدن پایینتر است. در طول تابستان، اوره اغلب درست قبل از آبیاری (بارش باران)، یا در حین آن پخش میشود تا زیان عمل تبخیر به حداقل رسانده شود (فرایندی که در آن، نیتروژن به صورت گاز آمونیاک در اتمسفر ناپدید میشود). اوره با سایر کودها چندان سازگار نیست.
به دلیل آنکه غلظت نیتروژن (ازت) در اوره بالاست، دستیابی به میزان گستردن و پخش آن، بسیار مهم است. تجهیزات مورد نیاز در این راستا، باید به درستی کالیبره شده و به طرز مناسبی مورد استفاده قرار گیرند. حفاری و سوراخ کردن زمین نباید در جایی که تماس نزدیک با دانه دارد، انجام بگیرد، چراکه خطر صدمه و آسیب به روند جوانه زدن وجود دارد. اوره بهصورت محلول در آب، بهصورت افشانه یا از طریق سیستمهای آبیاری نیز کاربرد دارد.
در مورد دانهٔ پنبه و غلات، اوره معمولاً در زمان انجام آخرین مرتبهٔ کشت و درست قبل از مرحلهٔ کاشت مورد استفاده قرار میگیرد. در مناطقی که بارش باران در آن مناطق بالاست و همچنین در خاکهای شنی (که نیتروژن میتواند به طریق شسته شدن از دست برود) یا هنگامیکه فصل بارش خوبی انتظار میرود، میتوان در طی فصل رشد، از اوره برای پوشانیدن کنارهها یا نقاط مرتفع زمین کشاورزی استفاده کرد. پوشانیدن نقاط مرتفع به وسیلهٔ اوره، همچنین در مراتع و اراضی خاص محصولات علوفهای نیز، محبوب است و طرفدار دارد. در مورد کشت نیشکر، از اوره به روش پوشانیدن کنارهها و پس از کاشت محصول بهره برده میشود. این روش برای تمامی محصولات مشابه نیشکر مثل خیزران ratoon نیز به کار میرود.
در آبیاری محصولات کشاورزی، اوره را میتوان به صورت خشک به خاک افزود، یا آن را به صورت محلول و از طریق آب آبیاری به کار برد. اوره با وزن خودش به راحتی در آب قابل حل است، اما در صورتیکه غلظت آن افزایش پیدا کند، میزان انحلال آن در آب بهطور فزایندهای دشوار میشود. فرایند انحلال اوره در آب یک فرایند اندومتریک است که باعث افت دمای محلول در هنگام حل شدن اوره میشود.
به عنوان یک راهنمایی عملی، که در واقع روش ساده و راحتی برای کوددهی توسط اوره (تزریق اوره در مسیرهای آبیاری) است، میتوان توصیه نمود که بیش از ۳۰ کیلوگرم اوره در هر ۱۰۰ لیتر آب حل شود و مورد استفاده قرار گیرد.
در مورد محصولات باغی، میتوان از افشانههای مخصوص برگ، که اوره را با غلظت ۰٫۵ ٪ تا ۲٫۰ ٪ پخش میکنند، استفاده کرد. در این مورد اغلب از اورهای که میزان بیورت در آن اندک است، استفاده میشود.
از آنجا که اوره جاذب رطوبت از اتمسفر و سطح هواست، در نتیجه برای ذخیرهسازی آن، بهطور معمول از بسته یا کیسهٔ مهر و موم شده پالت مانند (به شکل تشک) استفاده میشود. همچنین اگر نیاز به ذخیره کردن آن به صورت عمده باشد، باید آن را تحت پوشش با پارچهٔ مخصوص کرباسی که قیراندود و عایق آب است، قرار داد. ضمناً توصیه میشود که اوره را باید همانند بسیاری از دیگر کودهای جامد، در محلی خنک و خشک، که تهویه در آن محل به خوبی صورت میگیرد، ذخیره کرد.
صنایع شیمیایی
[ویرایش]اوره مادهٔ اولیه برای تولید بسیاری از ترکیبات شیمیایی مهم است، مانند:
- انواع پلاستیک، به ویژه رزینهای فرمالدهید اوره.
- انواع چسب، همچون اوره فرمالدهید و اوره ملامین فرمالدهید، که در ساخت تخته سهلایی مخصوص آب کاربرد دارد.
- پتاسیم سیانات به عنوان مادهٔ اولیهٔ برخی از صنایع.
- نیترات اوره، یک نوع مادهٔ منفجره.
سیستمهای خودرو
[ویرایش]اوره در واکنشهای SNCR و SCR به منظور کاهش آلایندههای NO دار، که در گازهای حاصل از احتراق موجود هستند، کاربرد دارد. به عنوان مثال، گازهایی که از نیروگاهها یا از موتورهای دیزلی خارج میشوند. در مورد موتورهای دیزلی، این فرایند به نام فیلتر بازسازی ذرات دیزلی خوانده میشود. در مورد سیستمهای بلوتک (BlueTec)، به عنوان مثال، از تزریق اورهٔ محلول در آب به سیستم اگزوز خودرو استفاده میشود. آمونیاک حاصل شده از فرایند تجزیهٔ اوره، با اکسید نیتروژن خروجی واکنش داده و توسط یک مبدل کاتالیزوری، به نیتروژن و آب تبدیل میشود.
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ http://toxnet.nlm.nih.gov/cgi-bin/sis/search/f?./temp/~ZAvqWP:1:sol
- ↑ Williams, R. (2001-10-24). "pKa Data" (PDF). Archived from the original (PDF) on 2 June 2010. Retrieved 2009-11-27.