Радон

Радон (англ. radon, radium emanation; нім. Radon n) — радіоактивний хімічний елемент періодичної системи. Символ Rn. Відкритий у 1900 р. англійським фізиком Е. Резерфордом і американським фізиком Робертом Оуенсом. Належить до інертних газів, ат. н. 86, ат. м. 222,0176. Р. — одноатомний газ без кольору і запаху. Радіоактивний. Токсичний. Хімічно малоактивний. Утворює сполуки включення з водою, фенолом, толуолом і т. д., хімічні сполуки — фториди. Утворюється в радіоактивних рудах і мінералах при розпаді радію (звідси походить і назва елемента), торію і актинію. Штучно одержують з солей радію. Відомо понад 25 ізотопів Rn. Найстійкішим є ізотоп 222Rn (період напіврозпаду — 3,824 доби). Густина 9,73 кг/м³; tпл = -71 °С; tкип = -61,8 °С.
Радон застосовують у геохімії для якісної оцінки збереження кристалічної структури радіоактивних мінералів, що використовуються в ізотопній геохронології. Запропонований також радон-ксеноновий метод визначення віку уранових мінералів. Крім того, застосовують при розвідці родовищ урану (за еманаціями Rn у приповерхневому шарі атмосфери), у медицині (радонові ванни, радіаційна терапія), техніці (Rn-Be джерела нейтронів).
У 1898 році П'єр і Марія Кюрі відкрили радіоактивне випромінювання торію. У 1899 році вони ж описали «індуковану радіоактивність», що виникала навколо радію — але існувала окремо від нього[2].
У 1899 році Ернест Резерфорд, разом з Робертом Оуенсом[en] що працювали тоді в університеті Макгілла в Канаді, відзначив, що препарати торію випускають, крім α-частинок ще якусь невідому раніше речовину, через що повітря навколо препаратів торію поступово стає радіоактивним[2]. Вони змогли показати, що ця радіоактивність створюється якоюсь окремою речовиною, а не перетвореннями звичайної, нерадіоактивної речовини у радіоактивну, як думали Кюрі. Проте, Резерфорд вважав, що ця речовина є або невеличкими шматочками пилу, що відриваються від мінералу, або ж парами торію. Лише у 1901 році Гаррієт Брукс[en], учениця Резерфорда, провела дослідження і показала, що нова речовина має бути невідомим раніше газом[3]. Цю речовину було запропоновано назвати еманація (від лат. emanatio — витікання) торію. Радіоактивність еманації зменшувалася за експоненційним законом з періодом напіврозпаду 56 с[2].
У 1900, Фрідріх Дорн показав, що еманація радону, яку знайшли Кюрі, розпадається з періодом напіврозпаду близько 4 діб[2].
У 1903 році Вільям Рамзай разом з Фредеріком Содді показали, що під час радіоактивного розпаду радію утворюються гелій і невідомий радіоактивний газ, що започаткувало сучасне розуміння реакцій ядерного розпаду[4].
У 1904 Андре-Луї Деб'єрн також знайшов еманацію, що утворювалася при розпаді актинію. Період її напіврозпаду становив лише 4 секунди[2].
Всі три гази вважались різними речовинами (в першу чергу, через різні періоди напіврозпаду), і, неофіційно, називалися еманацією торію, радію і актинію. Інший варіант назв для цих елементів — ексторій, ексрадій і ексактиній.
Еманація радію була достатньо довгоживучою щоб її вдалося зібрати, хоч і у мізерній кількості (десята доля кубічного міліметра). Незважаючи на такий невеликий об'єм, Рамзай і Роберт Вітлоу-Грей[en] змогли у 1911 році визначити густину газу і деякі його хімічні властивості. Для цього вони заповнювали ним тонкі кварцеві капіляри, і зважували їх за допомогою винайдених ними надточних вагах. Оскільки елемент виявився інертним газом, а отже — одноатомним, знаючи його густину можна було визначити його атомну масу, що виявилася рівною приблизно 222. Це також відповідало припущенню про те, що еманація утворюється після того як радій (атомну масу якого вважали близькою до 226) випускав альфа-частинку (з масою 4)[5]. Дослідники запропонували назву нітон (Nt) для цього елементу (від лат. nitos, блискучий), через його здатність викликати фосфоресценцію деяких речовин. Для еманації радію пропонувалося і кілька інших назв — наприклад, радіонеон і радіон від Марії Кюрі[2].
У 1911 році Міжнародний комітет атомних мас включив нітон у свій річний звіт, вказавши його офіційно прийняту масу в 222,4. Також, було зазначено експеримент Деб'єрна, у якому він отримав значення маси 220[6].
У 1913 році Генрі Мозлі показав, що атомний номер може бути встановлений за спектром, а отже має фізичне наповнення. Того ж року Содді запропонував концепцію ізотопів — різновиди атомів одного елементу, що мали однакові хімічні властивості, але різну масу[7]. Протягом кількох наступних років Содді разом з Казиміром Фаянсом відкрили закон радіоактивних зміщень[en], за допомогою чого вони, разом з Резерфордом, Отто Ганом, Лізою Майтнер і багатьма іншими вченими змогли зіставити відкриті на той час радіоактивні ізотопи (а їх було відомо вже кілька десятків), і показати, що всі вони належать невеликій кількості елементів[8].
У 1923 році IUPAC офіційно встановила назви радон, торон і актінон для трьох ізотопів[9], а у 1930 році у статті, співавторами якої були і Кюрі і Резерфорд і Деб'єрн, було встановлено загальну назву еманація (Em), що мала відноситися до всіх трьох ізотопів (при цьому окремі назви для них також зберігалися)[10]. При цьому, в реальності термін «радон» використовувався частіше за «еманація», і часто замінював його, оскільки саме радон був найбільш стабільним ізотопом, і зазвичай саме він використовувався в усіх експериментах.
У 1936 були отримана перша сполука радону (клатратного типу) — гідрат радону[11].
У 1948 році був відкритий четвертий ізотоп елементу, що утворювався при розпаді астату. Для нього не пропонувалося ніяких спеціальних назв[2].
У 1951 році «Free Enterprise Mine» у Монтані відкрилася як перший публічний заклад радонотерапії[12].
У 1957 році IUPAC затвердила назву радон (Rn) для всього елементу, а окремі назви для ізотопів скасували. Деякий час це призводило до плутанини, оскільки при використанні слова «радон» не було зрозуміло, чи йде мова про елемент чи ізотоп[2]. Проте, іноді термін торон у значенні радон-220 використовується і зараз[13].
Радон — найважчий з відомих газів за нормальних умов (густина 9,73 г/л, майже у 7,5 разів більше за повітря). При температурі -61,8 °C він зріджується. Рідкий радон, на відміну від прозорого і безбарвного газу, світиться яскравим біло-блакитним світлом. При температурі -71 °C радон твердішає, і при подальшому охолоджені змінює колір світіння на жовтий, а при температурі рідкого повітря — на помаранчево-червоний[14].
Радон добре абсорбується на різних поверхнях, особливо на активованому вугіллі. Порівняно з іншими інертними газами — добре розчиняється у воді (0,5 об'єму радона у 1 об'ємі води[15]), а у органічних розчинниках радон розчиняється ще краще.
Хімічна активність інертних газів зростає зі збільшенням їх порядкового номера, тому радон є найактивнішим серед них. При нагріванні зі фтором до 400 °C утворюється діфторид радону, RnF2[11]. З деякими комплексними фторидами радон може реагувати навіть за кімнатної температури. Також, за кімнатної температури він реагує з фторидами галогенів, наприклад:[11]
Також відомо багато сполук клатратного типу, наприклад , , тощо. У таких сполуках не утворюється справжніх хімічних зв'язків, а атоми радону просто затискаються у порожнинах між молекулами інших речовин, утримуючись Ван дер Ваальсовими силами[11]. Такі сполуки є нестійкими, і за атмосферного тиску швидко дисоціюють.
Один з найрідкісніших елементів на Землі. Загальна кількість радону в земній корі глибиною до 1,6 км бл. 115 т. Середня концентрація радону в атмосфері бл. 6·10−17 % (мас.), що відповідає 7 Бк/м³. Втім, оскільки радон весь час утворюється у ґрунті і розпадається в атмосфері — його концентрація може коливатись в десятки разів в залежності від місця заміру. Вона є значно нижчою над Антарктидою і поблизу океану (особливо на островах), і набагато вищою у приміщеннях — сотні Бк/м³. Ще вищою його концентрація є під землею, особливо на уранових шахтах[12].

Відомі 4 ізотопи радону, що утворюються в природі. Найбільш відомий і стабільний — радон-222, що утворюється при альфа-розпаді радію-226. Інші природні ізотопи:
- Радон-220 утворюється при розпаді радію-224, що входить до ряду торію. Має період напіврозпаду 55,6 с.
- Радон-219 переважно утворюється при розпаді радію-223 (також, невелика доля цього ізотопа утворюється при бета-розпаді астату-219). Цей ізотоп входить до ряду актинію. Має період напіврозпаду 3,96 с.
- Радон-218 може дуже рідко (0,1 % випадків) утворюватися при розпаді астату-218[16]. Цей ізотоп, як і радон-226 входить до радіоактивного ряду радію. Має період напіврозпаду 35 мс.
Відомо чотири ізотопи радону, що мають період напіврозпаду більше години[17]:
| Масове число | Період напіврозпаду | Основний канал розпаду |
|---|---|---|
| 210 | 2,4 години | Альфа-розпад |
| 211 | 14,6 годин | Захоплення електрону |
| 222 | 3,8235 діб | Альфа-розпад |
| 224 | 107 хвилин | β–-розпад |
Загалом відомо 42 ізотопи радону з масовими числами від 193 до 229, 5 з яких — метастабільні.
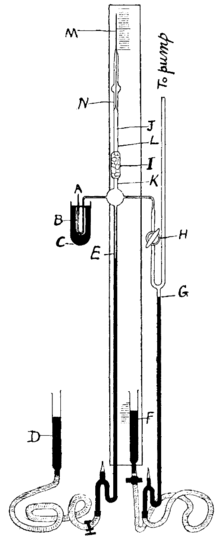
Для отримання радону через водний розчин будь-якої солі радію продувають повітря, яке забирає із собою радон що утворюється при радіоактивному розпаді радію. Далі повітря ретельно фільтрують для відділення мікрокрапель розчину, який містить сіль радію і які можуть бути захоплені струменем повітря. Для отримання власне радону із суміші газів видаляють хімічно активні речовини (кисень, водень, водяні пари і т. д.), залишок конденсують рідким азотом, потім з конденсату фракційно відганяють азот та інші інертні гази (аргон, неон тощо).
Радон застосовують у геохімії для якісної оцінки збереження кристалічної структури радіоактивних мінералів, що використовуються в ізотопній геохронології. Запропонований також радон-ксеноновий метод визначення віку уранових мінералів. Крім того, застосовують при розвідці родовищ урану (за еманаціями Rn у приповерхневому шарі атмосфери), у медицині (радонові ванни, радіаційна терапія), техніці (Rn-Be джерела нейтронів).
Радон вважається одним з найнебезпечніших радіоактивних елементів, оскільки через його газоподібний стан він завжди присутній в атмосфері у невеликій кількості і може проникати безпосередньо в тіло при диханні. При цьому він є сильним альфа-випромінювачем. Радон є другою після тютюнопаління причиною раку легенів. За різними оцінками, він є причиною від 3 до 14 % випадків цього захворювання[18].
Радон утворюється під землею, при розпаді порід, що містять радіоактивні елементи. Він потрапляє до приміщень з водою (особливо з артезіанських свердловин), з природнім газом або ж утворюється безпосередньо у стінах, якщо при виготовленні будівельних матеріалів не були дотримані правила безпеки. На нижчих поверхах концентрація радону є, зазвичай, вищою. Радон накопичується у приміщенні при поганій вентиляції[19].
7 листопада, у день народження Марії Кюрі у багатьох країнах, в тому числі і в Україні, відзначається день захисту від радону[19].
- ↑ Radon – Specific Heat, Latent Heat of Fusion, Latent Heat of Vaporization(англ.)
- ↑ а б в г д е ж и Recalling radon's recognition(англ.)
- ↑ RUTHERFORD, THE «TRUE DISCOVEREROF RADON» [Архівовано 27 січня 2021 у Wayback Machine.](англ.)
- ↑ Sir William Ramsay [Архівовано 21 січня 2021 у Wayback Machine.](англ.)
- ↑ The density of niton («radium emanation») and the disintegration theory [Архівовано 24 жовтня 2019 у Wayback Machine.](англ.)
- ↑ Annual Report of the International Committee on Atomic Weights, 1912 [Архівовано 27 січня 2021 у Wayback Machine.](англ.)
- ↑ Frederick Soddy [Архівовано 12 червня 2018 у Wayback Machine.](англ.)
- ↑ Soddy and Isotopes [Архівовано 28 січня 2021 у Wayback Machine.](англ.)
- ↑ REPORT OF THE INTERNATIONAL COMMITTEE ON CHEMICAL ELEMENTS: 1923 [Архівовано 27 січня 2021 у Wayback Machine.](англ.)
- ↑ THE RADIOACTIVE CONSTANTS AS OF 1930. REPORT OF THE INTERNATIONAL RADIUM-STANDARDS COMMISSION [Архівовано 17 жовтня 2021 у Wayback Machine.](англ.)
- ↑ а б в г Chemical Properties of Radon(англ.)
- ↑ а б Radon Sources and Associated Risk in Terms of Exposure and Dose [Архівовано 19 січня 2022 у Wayback Machine.](англ.)
- ↑ Thoron in the environment [Архівовано 29 січня 2021 у Wayback Machine.](англ.)
- ↑ Radon Chemical and Physical Properties [Архівовано 28 січня 2021 у Wayback Machine.](англ.)
- ↑ Неорганическая химия [Архівовано 28 січня 2021 у Wayback Machine.](рос.)
- ↑ 218At{{ref-en [Архівовано 29 січня 2021 у Wayback Machine.]}}
- ↑ Isotopes of the Element Radon [Архівовано 28 січня 2021 у Wayback Machine.](англ.)
- ↑ Health effects of radon [Архівовано 28 січня 2021 у Wayback Machine.](англ.)
- ↑ а б День захисту від радону. Чим небезпечний радон та як уберегтися. Архів оригіналу за 18 січня 2021. Процитовано 20 січня 2021.
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк: Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2.



