カルコゲン化物
 ウィキペディアから無料の百科事典
ウィキペディアから無料の百科事典
カルコゲン化物(カルコゲンかぶつ、英: chalcogenide、カルコゲニドまたはカルコゲナイド)は、少なくとも1つのカルコゲン化物アニオン(カルコゲン元素)と少なくとも1つ以上の陽性元素(それより電気陰性度の低い元素)からなる化合物である。

周期表の第16族元素はすべてカルコゲン化物として定義されているが、カルコゲン化物という用語は、酸化物ではなく、硫化物、セレン化物、テルル化物、ポロニウム化物を指すのが一般的である[1]。多くの金属鉱石はカルコゲン化物として存在する。一部の顔料や触媒もカルコゲン化物をベースとしている。金属ジカルコゲン化物MoS2は一般的な固体潤滑剤である。光伝導性(or光導電性)のカルコゲン化物ガラスはゼログラフィーやテレビに用いられ、シドニー大学によって開発された受光素子としてカルコゲン化物を用いる光学処理チップが、光ファイバー網とコンピュータの間の接続を高速化できる可能性がある[2]。
アルカリ金属およびアルカリ土類カルコゲン化物[編集]
アルカリ金属およびアルカリ土類金属のモノカルコゲン化物は塩状で、無色で、多くの場合水溶性である。硫化物は加水分解を受けて、二硫化物 (SH-) アニオンを含む誘導体を形成する傾向がある。アルカリ金属カルコゲン化物は、反蛍石構造および塩化ナトリウムをモチーフにしたアルカリ土類塩構造で結晶化することがよくある。
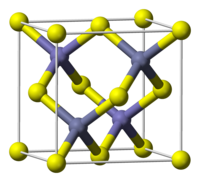
遷移金属カルコゲン化物[編集]
遷移金属カルコゲン化物は、多くの化学量論比と構造で起こる[3]。最も一般的で最も技術的にも重要なのは(しかしながら)1:1や1:2などの単純な化学量論比のカルコゲン化物である。極端な場合には、広範な金属間結合を示す金属リッチ相 (Ta2Sなど)[4]や、広範なカルコゲン – カルコゲン結合を特徴とするRe2S7などのカルコゲン化物リッチ材料が含まれる。
これらの材料を分類する目的でカルコゲン化物はジアニオン、つまりS2-、Se2-、Te2-、Po2-として見られることがよくある。事実、その半導体特性が示すように、遷移金属カルコゲン化物は共有結合性が高く、イオン性ではない[3]。
金属リッチカルコゲン化物[編集]

ほとんどのカルコゲン化物では、遷移金属はII以上の酸化状態をとる。にもかかわらず、金属原子の数がカルコゲンよりはるかに多い例がいくつか存在する。このような化合物は通常、広範な金属間結合を持っている[6]。
モノカルコゲン化物[編集]
金属モノカルコゲン化物は化学式MEで表され、文字Mには遷移金属が、及びEにはS、Se、Teが当て嵌る。それらは通常、対応する硫化亜鉛の形態にちなんで命名された、2つのモチーフのいずれか1つに結晶化する。閃亜鉛鉱構造では、硫化物原子が立方対称に詰め込まれ、Zn2+イオンが四面体の穴の半分を占める。その結果、ダイヤモンドイドの構造になる。モノカルコゲン化物の主な代替構造はウルツ鉱構造であり、原子の接続性は類似しているが (四面体)、結晶の対称性は六方晶系である。金属モノカルコゲン化物の3番目のモチーフはヒ化ニッケル格子であり、金属とカルコゲン化物はそれぞれ八面体と三角柱の配位をとる。このモチーフは通常、不定比化合物の影響を受ける[7]。
重要なモノカルコゲン化物には、いくつかの顔料、特に硫化カドミウムが含まれる。多くの鉱物や鉱石は一硫化物である[8]。
ジカルコゲン化物[編集]

金属ジカルコゲン化物は化学式ME2で表され、文字Mには遷移金属が、及びEにはS、Se、Teが当て嵌る[9]。最も重要なメンバーは硫化物である。これらは常に暗色の反磁性固体であり、すべての溶媒に不溶であり、半導体特性を示す。一部は超伝導体である[10]。
電子構造に関して言えば、これらの化合物は通常、M4+の誘導体とみなされ、M4+にはTi4+ (d0立体配置)、V4+ (d1立体配置)、Mo4+ (d2立体配置)が当て嵌る。二硫化チタンはリチウムによる可逆的なインターカレーションを受ける能力を利用して、二次電池用正極の試作品で研究された。二硫化モリブデンは何千もの記事の主題であり、そしてモリブデンの主な鉱石は輝水鉛鉱と呼ばれる。固体潤滑剤および水素化脱硫触媒として使用される。対応するジセレン化物、さらにはジテルル化物には、たとえばTiSe2、MoSe2、WSe2などが知られている。
遷移金属[編集]
遷移金属ジカルコゲン化物は、通常、二ヨウ化カドミウムまたは二硫化モリブデンの構造をとる。CdI2モチーフでは、金属は八面体構造を示す。MoS2モチーフでは(ジハロゲン化物では観察されないが)金属は三角柱構造を示す[1]。金属とカルコゲン化物配位子との間の強い結合は、層間の弱いカルコゲニド – カルコゲニド結合とは対照的である。これらの対照的な結合強度により、これらの材料はアルカリ金属によるインターカレーションに関与する。インターカレーションプロセスには電荷移動が伴い、M(IV)中心がM(III)に還元される。2D(次元)二セレン化タングステンにおける電子と正孔の間の引力は、典型的な3D(次元)半導体よりも数百倍強い[10]。
黄鉄鉱および関連するジスルフィド[編集]
古典的な金属ジカルコゲン化物とは対照的に、一般的な鉱物である黄鉄鉱は、通常、Fe2+と過硫化物アニオンS22-から構成されると説明される。ペルスルフィド(過硫化)ジアニオン内の硫黄原子は、短いS-S結合を介して結合している[3]。「後期」遷移金属二硫化物 (Mn、Fe、Co、Ni) は、2つのカルコゲン化物ジアニオンで4+の酸化状態をとる初期の金属 (V、Ti、Mo、W) とは対照的に、ほとんどの場合、黄鉄鉱または関連する白鉄鉱モチーフをとる。
トリカルコゲン化物およびテトラカルコゲン化物[編集]
いくつかの金属、主に初期の金属 (Ti、V、Cr、Mn グループ) もトリカルコゲン化物を形成する。これらの材料は通常、M4+(E22−)(E2−) (EにはS、Se、Teが当て嵌る) として記述される。よく知られている例は三セレン化ニオブである。アモルファスMoS3は、テトラチオモリブデン酸塩(w:Tetrathiomolybdate)を酸で処理することによって生成される:
化学式VS4を持つ鉱物パトロナイト(w:Patrónite)は、金属テトラカルコゲン化物の一例である。結晶学的分析により、この物質はビス(過硫化物)、つまりV4+,(S22−)2であると考えられることが示されている[3]。
典型元素カルコゲン化物[編集]

カルコゲン誘導体は、希ガスを除くすべての典型元素について知られている。通常それらの化学量論比は、SiS2、B2S3、Sb2S3のように古典的な原子価の傾向に従う。ただし、P4S3とS4N4のように多くの例外が存在する。多くの典型物質の構造は、最密充填ではなく、方向性のある共有結合によって決定される[1]。 カルコゲンには、ハロゲン化物、窒化物、酸化物の正の酸化状態が割り当てられる。
関連項目[編集]
出典[編集]
- ^ a b c Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ * Chip may speed up internet 100 times Deborah Smith for Sydney Morning Herald July 10, 2008
- ^ a b c d Vaughan, D. J.; Craig, J. R. "Mineral Chemistry of Metal Sulfides" Cambridge University Press, Cambridge: 1978. ISBN 0-521-21489-0.
- ^ Hughbanks, Timothy (1995). “Exploring the metal-rich chemistry of the early transition elements”. Journal of Alloys and Compounds 229: 40–53. doi:10.1016/0925-8388(95)01688-0.
- ^ Franzen, H.F.; Beineke, T.A.; Conrad, B.R. (1968). “The crystal structure of Nb21S8”. Acta Crystallographica B 24 (3): 412–p416. doi:10.1107/S0567740868002463.
- ^ Franzen, Hugo F. (1978). “Structure and Bonding of Metal-Rich Compounds: Pnictides, chalcogenides and halides”. Progress in Solid State Chemistry 12: 1–39. doi:10.1016/0079-6786(78)90002-X.
- ^ "Sulfide Mineralogy: Volume 1" Paul H. Ribbe, editor, 1974, Mineralogical Society of America. ISBN 0-939950-01-4
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ^ a b Wood, Charlie (2022年8月16日). “Physics Duo Finds Magic in Two Dimensions” (英語). Quanta Magazine. 2022年8月22日閲覧。
外部リンク[編集]
- Tiny Chip Demonstrates Big Memory in Cosmos Michael P. Kleiman for Air Force Research Laboratory, Space Vehicles Directorate (SpaceDaily) Jul 27, 2006
- Breakthrough switching speed with an all-optical chalcogenide glass chip: 640 Gbit/s demultiplexing Michael Galili, Jing Xu, Hans C. Mulvad, Leif K. Oxenløwe, Anders T. Clausen, Palle Jeppesen, Barry Luther-Davis, Steve Madden, Andrei Rode, Duk-Yong Choi, Mark Pelusi, Feng Luan, and Benjamin J. Eggleton (Optics Express, Vol. 17, Issue 4, pp. 2182–2187) February 2, 2009
- Maksym V. Kovalenko, Marcus Scheele, and Dmitri V. Talapin. "Colloidal Nanocrystals with Molecular Metal Chalcogenide Surface Ligands". Science 324(12June2009): 1417-1420
- Big Blue boffins hatch dirt-cheap solar cells The Register, 12 February 2010
- PC Watch
- 遷移金属ダイカルコゲナイド
- 厚さ原子3個分の半導体で励起子の動きを可視化する技術。筑波大ら開発 – 2022年10月17日
- 産総研ら、2nm以降のロジック半導体の高性能化を実現する技術 – 2023年2月13日
- 【福田昭のセミコン業界最前線】
- TSMCが12月のIEDMでサブnm時代をにらんだトランジスタ技術を発表へ – 2022年10月31日
- NANDフラッシュメモリに続いて大容量DRAMも将来は3次元積層へ – 2023年6月9日
- 2,000名近い参加者と過去最高の投稿件数を集めた国際電子デバイス会議(IEDM) – 2023年12月16日
- 遷移金属ダイカルコゲナイド
- GIGAZINE
- MoS2
- 半導体
- ニューロン同士が情報を伝達する仕組みをソフトではなくハードそのもので再現する研究が進んでいる – 2019年1月15日
- 受信したWi-Fiを電力に変換するため新素材を使った「レクテナ」をMITが開発 – 2019年1月29日
- 世界初の2次元素材であるグラフェンは3次元素材でもあるとの研究結果 – 2019年9月24日
- 次世代素材「グラフェン」製のマイクロチップでPCやスマホを何千倍も高速化できる可能性 – 2021年2月16日
- 光触媒
- 浄水器
- 水の中にぽちゃんと落とすだけで殺菌可能な切手サイズの新型デバイスを開発 – 2016年8月19日
- 太陽光を利用して汚染水を迅速に飲料水に変える超高速殺菌剤が誕生、世界人口の30%が救われる革命的進歩 – 2023年5月23日
- 水の中にぽちゃんと落とすだけで殺菌可能な切手サイズの新型デバイスを開発 – 2016年8月19日
- その他
- 太陽光のエネルギーを高い変換効率で使いやすい水素に変換する新たな手法が開発される – 2021年11月22日
- 浄水器
- その他
- 電子顕微鏡の分解能が0.39オングストロームに到達し世界記録が更新される – 2018年7月20日
- わずか20年で40兆km以上離れた恒星にマイクロ宇宙船を送りこむ「ブレークスルー・スターショット」の新たな課題は「紙より薄い帆」にあり – 2022年03月19日
- 半導体
- MoS2
