ストレッカー反応
 ウィキペディアから無料の百科事典
ウィキペディアから無料の百科事典
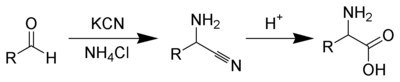
ストレッカー反応(ストレッカーはんのう、英: Strecker reaction)は、アルデヒドまたはケトンとアンモニア、シアン化水素との反応により、アミノ酸を合成する反応である[1][2]。ストレッカーのアミノ酸合成とも呼ばれる。アドルフ・ストレッカーにより1850年に報告された歴史の古い反応であるが、様々な変法が生み出され、現在でもアミノ酸合成において重要な地位を占める。また、生命の発生以前に、この反応によってタンパク質の素となるアミノ酸が作り出されたものと考えられている。
反応機構[編集]
まずアルデヒドとアンモニアからイミンができ、ここにシアン化物イオンが求核反応を起こしてアミノニトリルができる。多くの場合、これを単離せずワンポットで加水分解(濃塩酸で加熱などの条件)することにより、目的のアミノ酸を得る[3][4]。アルデヒドとしては芳香族・脂肪族どちらの誘導体も使用可能である。
変法[編集]
一般的には危険性の高いシアン化水素の使用を避け、シアン化ナトリウムなどと塩化アンモニウムを用いて反応を行う(ゼリンスキー・スタドニコフの変法)。また炭酸アンモニウムとシアン化アルカリを用いると、ヒダントイン誘導体として生成物が得られてくる。ここで十分精製を行った後に水酸化ナトリウムなどで加水分解を行うことにより、純度の高いアミノ酸が容易に得られる。アミノ酸は水溶性が高く、抽出・精製が難しいケースがままあるのでこの方法は有用性が高い。
不斉ストレッカー反応[編集]
光学活性なアミノ酸の需要は大きいため、古くからストレッカー反応の不斉化は試みられてきた。窒素原子上に電子求引基を付けてイミンを安定に単離しておき、ここに不斉触媒存在下でシアン化物イオンを作用させる方法が多く、柴崎[5]ら、丸岡[6]ら、ジェイコブセン[7]らがそれぞれ独自の手法を発表している。また不斉補助基を用いるエルマン[8]らの手法も応用範囲が広い。
ストレッカー不斉反応[編集]
ストレッカー不斉反応は1963年に生み出された[9][10]。アラニンをS-αフェニルエチルアミンを不斉補助剤で置換して反応させる。不斉反応として報告されたのは1996年のことである[11]。
ストレッカー不斉触媒反応[編集]

エリック・N・ジェイコブセンが2009年に発表した。この反応ではチオ尿素由来の触媒を利用する。2012年には、単純なBINOL由来の触媒がキラルのシアニドアニオンの生成に利用できることがわかった[12] 。
応用[編集]
今日ではL-バリン誘導体を3-メチル-2-ブタノンからキログラム単位で合成するために利用される[13][14]。
脚注[編集]
- ^ Strecker, A. (1850). “Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper”. Ann. 75: 27-45. doi:10.1002/jlac.18500750103.
- ^ Strecker, A. (1854). “Ueber einen neuen aus Aldehyd - Ammoniak und Blausäure entstehenden Körper”. Ann. 91: 349-351. doi:10.1002/jlac.18540910309.
- ^ Kendall, E. C.; McKenzie, B. F. (1929). "dl-Alanine". Organic Syntheses (英語). 9: 4.; Collective Volume, vol. 1, p. 21
- ^ Clarke, H. T.; Bean, H. J. (1931). "α-Aminoisobutyric acid". Organic Syntheses (英語). 11: 4.; Collective Volume, vol. 2, p. 29
- ^ Kato, N.; Suzuki, M.; Kanai, M.; Shibasaki, M. (2004). “General and practical catalytic enantioselective Strecker reaction of ketoimines: significant improvement through catalyst tuning by protic additives”. Tetrahedron Lett. 45: 3147–3151. doi:10.1016/j.tetlet.2004.02.082.
- ^ Kano, T.; Ueda, M.; Takai, J.; Maruoka, K. (2006). “Direct asymmetric hydroxyamination reaction catalyzed by an axially chiral secondary amine catalyst”. J. Am. Chem. Soc. 128: 6046–6047. doi:10.1021/ja0604515.
- ^ Sigman, M. S.; Vachal, P.; Jacobsen, E. N. (2000). “A general catalyst for the asymmetric Strecker reaction”. Angew. Chem. Int. Ed. 39: 1279–1281. doi:10.1002/(SICI)1521-3773(20000403)39:7<1279::AID-ANIE1279>3.0.CO;2-U.
- ^ 河内卓彌, 百足勉, Jonathan A. Ellman (2004). 有機合成化学協会誌 62: 128.
- ^ Asymmetric Synthesis of α-Amino-acids by the Strecker Synthesis Kaoru Harada Nature 200, 1201 (21 December 1963); doi:10.1038/2001201a0
- ^ Asymmetric Strecker Reactions Jun Wang, Xiaohua Liu, Xiaoming Feng 2011 Chemical Reviews Article ASAP doi:10.1021/cr200057t
- ^ Asymmetric Catalysis of the Strecker Amino Acid Synthesis by a Cyclic Dipeptide Mani S. Iyer,, Kenneth M. Gigstad,, Nivedita D. Namdev, and, Mark Lipton Journal of the American Chemical Society 1996 118 (20), 4910–4911 doi:10.1021/ja952686e
- ^ "Scalable organocatalytic asymmetric Strecker reactions catalysed by a chiral cyanide generator" doi:10.1038/ncomms2216 http://www.nature.com/ncomms/journal/v3/n11/full/ncomms2216.html
- ^ A Concise Synthesis of (S)-N-Ethoxycarbonyl—methylvaline Jeffrey T. Kuethe, Donald R. Gauthier, Jr., Gregory L. Beutner, and Nobuyoshi Yasuda J. Org. Chem., 72 (19), 7469 -7472, 2007. doi:10.1021/jo7012862
- ^ The initial reaction product of 3-methyl-2butanone with sodium cyanide and ammonia is resolved by application of L-tartaric acid. The amino acid is isolated as its salt with dicyclohexylamine.
