ネビラピン
 ウィキペディアから無料の百科事典
ウィキペディアから無料の百科事典
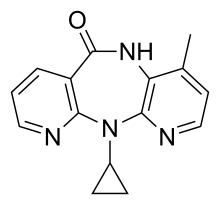 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Viramune |
| Drugs.com | monograph |
| MedlinePlus | a600035 |
| 胎児危険度分類 |
|
| 薬物動態データ | |
| 生物学的利用能 | 93% ± 9% |
| 代謝 | Hepatic |
| 半減期 | 45 hours |
| 排泄 | Renal: <6% (Parent drug) Biliary <5% (Parent drug) |
| 識別 | |
| CAS番号 | 129618-40-2 |
| ATCコード | J05AG01 (WHO) |
| PubChem | CID: 4463 |
| DrugBank | DB00238 |
| ChemSpider | 4308 |
| UNII | 99DK7FVK1H |
| KEGG | D00435 |
| ChEMBL | CHEMBL57 |
| NIAID ChemDB | 001856 |
| 化学的データ | |
| 化学式 | C15H14N4O |
| 分子量 | 266.298 g/mol |
| |
ネビラピン(Nevirapine、略号:NVP)は、非ヌクレオシド系逆転写酵素阻害薬(NNRTI)であり、HIV-1感染症及びAIDSの治療に用いられる。商品名ビラミューン。他の抗レトロウイルス薬と同様に、ネビラピンを単剤で用いると速やかに耐性が形成されるので、他に2種類以上の抗レトロウイルス薬を併用することが望ましい。
基本的医療制度に必要な重要な医薬品としてWHO必須医薬品モデル・リストに掲載されている[1]。
効能・効果
[編集]初回の抗レトロウイルス治療の場合は、ネビラピンを含む3剤併用療法で効果的にウイルス量を低下させることができる[2]。いくつかの臨床試験で、ネビラピンを含むHAART療法(ART)はプロテアーゼ阻害薬(PI)を用いた治療法[3][4]やエファビレンツを用いた治療法[5]よりも効果的にHIV量を減少させることが示された。一部ではウイルス量が多い場合やCD4数が少ない場合の初期治療にネビラピンを用いることに懸念が示されているが、これらの患者でもネビラピンが有効であるとの報告もある[5]。
ネビラピンは初期治療に失敗した場合の救済療法としても有用で、特に初期治療にNNRTIを使用しなかった場合の、1つ以上のPIやヌクレオシド系逆転写酵素阻害薬(nRTI)との併用療法が効果的である。
母子感染(垂直感染)の防止
[編集]ウガンダで実施された臨床試験では、母と子へのネビラピンの単回投与はジドブジンの超短期投与と比較してHIV量をほぼ50%に減少させた[6]。その後タイで実施された臨床試験では、ジドブジンにネビラピン単回投与を加えた群の方が、ジドブジン単独群よりも予防効果が高いことが示された[7]。これらを始めとする複数の臨床試験の結果、WHOはネビラピン単回投与を開発途上国での安価な垂直感染予防策であると認めるに至った。しかし米国ではウガンダの試験には瑕疵があるとされ[8]、2006年時点ではネビラピンの感染予防への使用は承認されなかった[9]。だがHIVNET012試験の支持者らは、試験の瑕疵は事務官の不手際によるところが大きく、試験で得られたネビラピン単回投与の安全性と有効性の知見は科学的に揺ぎないものであり、絶対に破棄すべきでないと主張した[10]上、リソースに乏しいアフリカの研究者達に欧米と同じ水準のモラル・試験手順を求めるのは非現実的であり、(試験結果の破棄は)科学界におけるアフリカの役割を過小評価し、アフリカでの科学の発展を妨げると論じた[11]。もう1つ、授乳中の垂直感染の防止を目的とした臨床試験が実施され、2011年3月に完了した[12]が、投与開始後6週間〜6ヶ月の感染率(ネビラピン群:1.1%、偽薬群:2.4%)では有意差(p=0.049)が付いたものの、死亡率及び感染・死亡率では有意差は付かなかった[13]。同試験は18ヶ月まで実施され、感染率(ネ群:2.2%、偽群:3.1%)の数字はネビラピン群の方が低かったものの有意差や傾向は見られなかった(p=0.28)[14]。
この方法で最も心配されていることは、単回投与された母子の双方でNNRTI耐性変異が観察されている事であり[15]、将来NNRTIを含む処方を用いた際の効果が低くなる可能性が指摘されている[16]。そのため米国公衆衛生局タスクフォースは、母体へのジドブジン・ラミブジン短期投与を推奨している[17]。
禁忌
[編集]ネビラピンは重篤な肝機能障害のある患者やケトコナゾール経口投与、経口避妊薬を使用中の患者には禁忌である[18]。
また服用後に過敏症、重篤な発疹、肝機能障害が発生した患者には再投与は禁忌とされている。
副作用
[編集]国内・海外治験並びに製造販売後臨床試験で認められた副作用は通算で36.6%であり[18]、主な副作用は、発疹、悪心・嘔吐、頭痛、傾眠、疲労、発熱等であった[19]:35-39[20][21]。
重大な副作用としては、
- 中毒性表皮壊死症(0.1%)、皮膚粘膜眼症候群(0.7%)、過敏症症候群、
- 肝炎(劇症肝炎を含む)、肝機能障害(AST(GOT)、ALT(GPT)、γ-GTP、Al-P、総ビリルビンなどの上昇)、黄疸、肝不全(11.40%)、
- 顆粒球減少、うつ病、幻覚、錯乱、脱水症、心筋梗塞、出血性食道潰瘍、全身痙攣、髄膜炎(3.77%)、
- アナフィラキシー様症状(0.36%)
これらの内、最も注意すべき副作用は皮膚障害と肝障害であり、日本の添付文書では警告欄が設けられている。重篤な皮膚障害[18]・肝障害[20][22]は投与開始から概ね6週間以内に発生する。2000年に米国食品医薬品局はネビラピンの添付文書に黒枠警告を設置し、肝不全を含む肝障害について注意喚起する様に指示した[23]。一部の患者(CD4数 男性:>400、女性:>250)では肝障害リスクが許容できない程に高く[5][24]、米国保健福祉省はネビラピンの使用をリスクが低く明らかに利益の方が上回る患者に限るよう勧告したが[22]、2NN試験で見られたCD4数制限はタイの患者に限られている。2NN後の臨床試験では、CD4数の多い患者について次の結論を導いている。
- ART施行前にCD4数が少なくネビラピンを含む治療でCD4が増加した患者とウイルス量が測定不能の患者で、過敏症等により治療を中断する確率は、前治療がなく治療中のCD4数が少ない患者と同程度である。
この結論は、ネビラピンを含む治療の安全性はCD4が多い患者でも変わらないことを示唆している。しかし、ウイルス量を測定可能な患者では、CD4数の基準を順守する方が賢明であろう[25]。米国公衆衛生局タスクフォースはネビラピンを妊娠中に使用すると毒性が増加する可能性について注意喚起している[17]。
相互作用
[編集]抗結核薬のリファンピシンを併用するとシトクロムP450のCYP3A酵素が誘導されてネビラピンの血中濃度が低下するので、同時に服用すべきではない[20]。日本の添付文書ではこの他リファブチンについても同様の注意が記載されている[18]。また逆に、CYP3A酵素を阻害する薬剤(シメチジン、マクロライド系抗生物質、イトラコナゾール)はネビラピンの血中濃度を上昇させる[18]。
ネビラピン自身はCYP3A4やCYP2B6の誘導薬である。抗ウイルス薬であるエファビレンツ、インジナビル、ロピナビル、ネルフィナビル、サキナビルのほか、クラリスロマイシン、ケトコナゾール、ホルモン避妊薬、メサドンの血中濃度を低下させる[20]。
作用機序
[編集]
ネビラピンは非ヌクレオシド系逆転写酵素阻害薬(NNRTI)に分類される抗レトロウイルス薬である[26]。ヌクレオシド系、非ヌクレオシド系抗レトロウイルス薬は同じ逆転写酵素を標的としている。この酵素はウイルスRNAをDNAに変換する際に必須のウイルス酵素である。酵素の活性中心に結合するヌクレオシド系薬剤とは異なり、NNRTIは活性部位から離れたNNRTIポケットと呼ばれる部位に結合し、酵素の立体構造を変化させ失活させる。
ネビラピンがHIV-2に無効であるのは、このポケットの構造がHIV-1とは異なるためである[27]。
ウイルスの抑制が不完全であると、忽ちネビラピン耐性が形成されてしまう[2]。ネビラピン投与後に観察される主な変異は、Y181CとK103Nであり、これらは他のNNRTIでも生じて来る[20][28]。NNRTIのほとんどは酵素の同じ部位に結合するので、ネビラピン耐性となったウイルス株は他のNNRTI(エファビレンツやデラビリジン等)にも耐性を持っている。しかしリルピビリンやエトラビリンなどの第2世代のNNRTIは、ネビラピンなどの第1世代NNRTIに耐性のウイルス株にも効果を示す。
開発の経緯
[編集]ネビラピンは米国で最初に承認されたNNRTIである。1996年6月に成人患者について、1998年9月に小児について承認された。欧州では1998年2月に[29]、日本では1998年11月に[30]承認された。
脚注
[編集]- ^ “WHO Model List of EssentialMedicines”. World Health Organization (October 2013). 22 April 2014閲覧。
- ^ a b “A randomized, double-blind trial comparing combinations of nevirapine, didanosine, and zidovudine for HIV-infected patients: the INCAS Trial. Italy, The Netherlands, Canada and Australia Study”. JAMA 279 (12): 930–7. (Mar 1998). doi:10.1001/jama.279.12.930. PMID 9544767.
- ^ “A randomized trial to study first-line combination therapy with or without a protease inhibitor in HIV-1-infected patients”. AIDS 17 (7): 987–99. (May 2003). doi:10.1097/00002030-200305020-00007. PMID 12700448.
- ^ “A randomized clinical trial comparing nelfinavir or nevirapine associated to zidovudine/lamivudine in HIV-infected naive patients (the Combine Study)”. Antiviral Therapy 7: 81–90.
- ^ a b c “The effect of baseline CD4 cell count and HIV-1 viral load on the efficacy and safety of nevirapine or efavirenz-based first-line HAART”. AIDS 19 (5): 463–71. (Mar 2005). doi:10.1097/01.aids.0000162334.12815.5b. PMID 15764851.
- ^ “Intrapartum and neonatal single-dose nevirapine compared with zidovudine for prevention of mother-to-child transmission of HIV-1 in Kampala, Uganda: HIVNET 012 randomised trial”. Lancet 354 (9181): 795–802. (Sep 1999). doi:10.1016/S0140-6736(99)80008-7. PMID 10485720.
- ^ Lallemant M, Gonzague Jourdain G, Sophie Le Coeur S, et al. (2004) Single-Dose Perinatal Nevirapine plus Standard Zidovudine to Prevent Mother-to-Child Transmission of HIV-1 in Thailand. N Engl J Med 351: 217-28
- ^ The HIVNET 012 Study and the Safety and Effectiveness of Nevirapine in Preventing Mother-to-Infant Transmission of HIV, http://www3.niaid.nih.gov/news/newsreleases/2004/hivnet012.htm
- ^ Celia Farber, "Out of Control: AIDS and the Corruption of Science" http://www.harpers.org/archive/2006/03/0080961
- ^ Crane, J 2010, 'Adverse events and placebo effects: African scientists, HIV, and ethics in the 'global health sciences, Social Studies Of Science, 40, 6, pp. 843-870 http://sss.sagepub.com.ezp.lib.unimelb.edu.au/content/40/6/843.full.pdf+html
- ^ Lock, M. & Nguyen, V 2010, an Anthropology of Biomedicine, Malden, Wiley-Blackwell.
- ^ http://clinicaltrials.gov/show/NCT00074412
- ^ Coovadia HM, Brown ER, Fowler MG, Chipato T, Moodley D, Manji K et al. (2012). “Efficacy and safety of an extended nevirapine regimen in infant children of breastfeeding mothers with HIV-1 infection for prevention of postnatal HIV-1 transmission (HPTN 046): a randomised, double-blind, placebo-controlled trial.”. Lancet 379 (9812): 221-8. doi:10.1016/S0140-6736(11)61653-X. PMC 3539769. PMID 22196945.
- ^ Fowler MG, Coovadia H, Herron CM, Maldonado Y, Chipato T, Moodley D et al. (2014). “Efficacy and safety of an extended nevirapine regimen in infants of breastfeeding mothers with HIV-1 infection for prevention of HIV-1 transmission (HPTN 046): 18-month results of a randomized, double-blind, placebo-controlled trial.”. J Acquir Immune Defic Syndr 65 (3): 366-74. doi:10.1097/QAI.0000000000000052. PMC 3945386. PMID 24189151.
- ^ “Emergence of drug-resistant HIV-1 after intrapartum administration of single-dose nevirapine is substantially underestimated”. J Infect Dis. 192 (1): 16–23. (Jul 2005). doi:10.1086/430741. PMID 15942889.
- ^ “Intrapartum exposure to nevirapine and subsequent maternal responses to nevirapine-based antiretroviral therapy”. N Engl J Med. 351 (3): 229–40. (Jul 2004). doi:10.1056/NEJMoa041305. PMID 15247339.
- ^ a b Recommendations for Use of Antiretroviral Drugs in Pregnant HIV-1-Infected Women for Maternal Health and Interventions to Reduce Perinatal HIV-1 Transmission in the United States. Public Health Service Task Force. (November 17, 2005) (Available for download from AIDSInfo)
- ^ a b c d e f “ビラミューン錠200 添付文書” (2014年7月). 2016年7月26日閲覧。
- ^ “ビラミューン錠200 インタビューフォーム” (PDF) (2014年7月). 2016年7月28日閲覧。
- ^ a b c d e f Viramune (nevirapine) tablets; Viramune (nevirapine) oral suspension prescribing information
- ^ “Facts sheet from the AIDS Treatment Data Network”. 2006年1月13日時点のオリジナルよりアーカイブ。2006年1月16日閲覧。
- ^ a b DHHS panel. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents (May 4, 2006). (Available for download from AIDSInfo Archived 2006年5月6日, at the Wayback Machine.)
- ^ Viramune (nevirapine) letter (November 2000)
- ^ “A comprehensive hepatic safety analysis of nevirapine in different populations of HIV-infected patients”. J Acquir Immune Defic Syndr 34 (Suppl 1): S21–S33. (2003). doi:10.1097/00126334-200309011-00005.
- ^ “Discontinuation of nevirapine because of hypersensitivity reactions in patients with prior treatment experience, compared with treatment-naive patients: the ATHENA cohort study”. Clin Infect Dis. 46 (6): 933–40. (Mar 2008). doi:10.1086/528861. PMID 18271750.
- ^ “New drug profile: nevirapine”. Clinical Immunotherapeutics 6 (4): 307–317. (Oct 1996).
- ^ “Structure of HIV-2 reverse transcriptase at 2.35-A resolution and the mechanism of resistance to non-nucleoside inhibitors”. Proc Natl Acad Sci USA. 99 (22): 14410–5. (Oct 2002). doi:10.1073/pnas.222366699. PMC 137897. PMID 12386343.
- ^ “Development of drug resistance in patients receiving combinations of zidovudine, didanosine and nevirapine”. AIDS 15 (10): 1269–74. (Jul 2001). doi:10.1097/00002030-200107060-00008. PMID 11426071.
- ^ “Viramune > Authorisation details”. European Medical Agency. 2016年7月28日閲覧。
- ^ “新医薬品として承認された医薬品について” (PDF). 厚生労働省 (1998年11月27日). 2016年7月28日閲覧。