フロー電池
 ウィキペディアから無料の百科事典
ウィキペディアから無料の百科事典
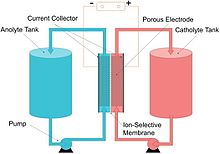
フロー電池(フローでんち、英: flow battery)またはレドックスフロー電池 (redox flow battery) とは、2種類の化学物質を溶解させた液体を系内に蓄え、膜で隔てた形をとる化学電池の1種である[2][3]。それぞれの液体を別々に循環させ、膜を通じたイオン交換を起こさせる。セル電圧はネルンストの式により電気化学的に決定されるが、実用電池では1.1から2.2ボルトの範囲におさまる。
フロー電池は燃料を消費したら再充填して使える燃料電池や、電力により電池を再生できる二次電池と似た利用ができる。従来型の二次電池に比べ、液体タンクが分割可能な点やほぼ無限の耐久性などの利点があるのに対し、21世紀初頭における一般的なフロー電池は比較的出力が低く、複雑なエレクトロニクスが必要となる。
エネルギー容量は電解質体積(電解質溶液の量)の関数として、出力は電極表面積の関数として決まる。
構成原理[編集]
フロー電池は1種類以上の電気化学的活性種を溶解させた電解液をセル内に流通させ、化学エネルギーを可逆的かつ直接的に電気に変換する化学電池である(電気化学的活性種とは「電極反応に関与する、もしくは電極内に吸着される溶液中の化学種」"elements in solution that can take part in an electrode reaction or that can be adsorbed on the electrode"を指す)[4]。追加の電解液は外部に、一般的にはタンクに蓄えられ、通常はポンプによりリアクターセル内に流通させるが、重力による供給を行うシステムも知られている[5]。フロー電池は、内燃機関における燃料補給と同じように、電解液を交換してエネルギー化で消費された物質を補給することにより、素早く「充電」することができる。
換言すれば、フロー電池とは電解液を電極周りのセルに封止せず、セル外部に蓄えておいて発電時にセルに送り込むという点以外は化学電池と変わりがない。発電可能な総量は貯蔵タンクのサイズに依存する。
フロー電池は電気化学工学的に確立された設計原理に基く[6]。
種類[編集]
レドックス型やハイブリッド型、膜なし型など、様々なフロー電池が開発されている[7]。フロー電池と従来型の電池との基本的な違いは、従来型ではエネルギーが電極材料に蓄えられているのに対して、フロー電池では電解液に蓄えられるという点である。
レドックス型[編集]
レドックス(酸化還元)フロー電池は、電気化学種が電解液に溶解している二次電池であり、再充電が可能である[8]。従来型電池のような固体内拡散やインターカレーションではなく、不均一電子移動反応を用いるため、化学電池というより燃料電池といったほうがより適切である。産業的には、燃料電池は H2/O2 型のように一次電池と考えられることが多いが、それに限られるものではない。NASAのヘリオス試作機に搭載された一体化再生型燃料電池も可逆型燃料電池の例として挙げられる。欧州特許機構ではレドックスフロー電池 (H01M8/18C4) を再生型燃料電池 (H01M8/18) の下位分類として位置付けている。レドックスフロー電池の例として、バナジウムレドックスフロー電池や多硫化ソーダ/臭化ソーダ電池 (Regenesys)、ウランレドックスフロー電池が挙げられる[9]。レドックス燃料電池は商業的にはあまり一般的ではないが、多くのシステムが提案されている[10][11][12][13]。
試作型の亜鉛-多ヨウ化物フロー電池は 167 Wh/l (ワット時毎リットル)のエネルギー密度を達成している。 それ以前の亜鉛-臭化物セルでは 70 Wh/l に達している。比較のためにリン酸鉄リチウムイオン電池の容量を挙げると 233 Wh/l である。亜鉛-多ヨウ化物電池は他のフロー電池に比べて酸性電解液を用いておらず、不燃性のため安全で、動作温度範囲が-20 ℃から+50 ℃で、しかも冷却機構がいらず重量的にも容積的にも有利であるとされる。未解決の問題として、負極に膜から浸透してきた亜鉛が蓄積し、効率を下げるという問題がある。Zn デンドライト形成のため、亜鉛-ハロゲン化物電池は高い電流密度 (>20 mA/cm2) で動作させることができず、出力密度に劣る。ZnI電池の電解液に、ある種のアルコール類を加えることで若干この問題を軽減することができる[14][15][16]。
電池が完全に放電しきったとき、両方のタンクには同じ亜鉛陽イオン (Zn2+) とヨウ化物陰イオン I− の混合物が残ることになる。充電時には、片方のタンクには別の陰イオン、多ヨウ化物イオン I3− が含まれる。この電池は外部タンクから液体をセルスタック領域に送りこみ、そこで液体が混ざりあうことにより電力を産み出す。スタック内では亜鉛イオンが選択的浸透膜を通過し、負極側で金属亜鉛へと変化する[17]。
伝統的なフロー電池の化学構成では比エネルギーが低く、電気自動車に用いるには電池が重くなりすぎ、また比出力が低く、固定型エネルギー貯蔵としては高価になり過ぎる。しかし、近年の水素-臭素フロー電池では面積比出力が 1.4 W/cm2 と向上し、水素-臭素酸フロー電池ではタンク容量あたりの比エネルギーが 530 Wh/kg と向上している[18][19][20]。
有機ポリマーと塩水、セルロース膜を用いるシステムも存在する。試作型では 1万回の充電放電サイクルの後も相当量の容量を保つ耐久性が示されている。エネルギー密度は 10 Wh/l[21]。電流密度は 100 mA/cm2 を達成している[22]。
ハイブリッド型[編集]
ハイブリッド型フロー電池では1種類以上の電気化学活性種が固体層として積層されている[23]。この場合、電気化学セルは化学電池電極を1つと燃料電池電極を1つ含むことになる。この型では電極表面積によりエネルギーが制限される。ハイブリッド型フロー電池には亜鉛–臭素電池や亜鉛–セリウム電池[24]、鉛–酸フロー電池などがある。
膜なし型[編集]
膜なし型電池は、2種類の電解液が2つのチャネルに流通する際に生じる層流に依存する。これらが電気化学反応を起こし、エネルギーを蓄えたり開放したりする。電解液は互いにほとんど混ざり合わず並列に流れる。流れによって自然に液体同士が分かれるため、膜がいらなくなる[25]。
膜は特定の反応物に繰り返し曝されることにより腐蝕することがあり、電池内で最もコストがかかり、かつ最も信頼性が低い構成材であることが多い。膜がないことにより液体臭素溶液と水素を用いることができる。膜を使用する場合、この組み合わせは臭化水素酸の生成により膜を痛めるため問題となる。両材料は低コストで利用可能である[26]。
この設計では2つの電極の間に小さなチャネルを設ける。液体臭素は炭素カソード上のチャネルを、臭化水素酸は多孔質アノード上のチャネルを流れる。同時に、水素ガスをアノードに流通させる。膜なし設計としては初めて、逆反応を起こして電池を充電することが可能である[26]。2013年8月に発表された膜なしフロー電池は他の膜なしシステムの3倍となり、リチウムイオン電池よりも高い最大出力密度 7950 W/m2 を達成している[26]。
Primus Power はレドックス型亜鉛-臭素フロー電池における膜やセパレータを不要とし、コストと故障率を低下させる特許技術を開発した。Primus Power の膜なしレドックスフロー電池はアメリカ合衆国とアジアにおける2017年2月21日に発表された第2世代製品に用いられている。Primus Power EnergyPod 2 が生産中である。
有機型[編集]
2009年に登場した有機レドックスフロー電池は、数十年前に開発されたバナジウムレドックスフロー電池や Zn-Br2 電池をはじめとする従来型の無機水溶液レドックスフロー電池に存在する、大規模な商用化を妨げている主な欠点を乗り越える大きな可能性を秘めている。有機レドックスフロー電池の主な利点は酸化還元活性種の酸化還元物性を調節できるという点にある。
有機レドックスフロー電池はさらに Aqueous Organic Redox Flow Battery (AORFB) と Non-aqueous Organic Redox Flow Battery (NAORFB) に分類できる。AORFB では酸化還元活性種を溶かす電解液の溶媒に水が用いられ、NAORFB では有機溶媒が用いられる。有機酸化還元活性種を1つ使うのか2つ使うのかに基いて AORFB と NAORFB はさらに全有機システムと無機材料も用いる半有機システムに分けられる。AORFB は NAORFB よりも先に概念実証が行われている。大規模エネルギー貯蔵施設としては、AORFB のほうが NAORFB よりも低コストかつ大電流、大出力で、さらに安全性も優れているので適している。NAORFB は AORFB よりもエネルギー密度が高いので限られた用途には有用かもしれないが、安全性や有機溶媒のコスト、ラジカル誘導副反応、電解質クロスオーバー、限られた寿命などの問題点を克服する必要がある。以下ではAORFBに関する代表的な研究を主に扱う。
キノンを用いたAORFBがいくつか存在する[27][28]。ある研究では、酸性AORFBに 1,2-ジヒドロベンゾキノン-3,5-ジスルホン酸 (BQDS) と 1,4-ジヒドロベンゾキノン-2-スルホン酸 (BQS) をカソードとして、伝統的な Pb/PbSO4 アノードが用いられている。これら最初のAORFBはカソード側にのみ有機酸化還元活性種を用いているので版有機型である。キノンは伝統的カソード材料に比べて2倍の電荷をうけとるので、体積あたり2倍のエネルギーを貯蔵できる可能性がある。
別のキノン、9,10-アントラキノン-2,7-ジスルホン酸 (AQDS) も評価されている[29]。AQDSは硫酸中、ガラス状炭素電極上で高速な2電子/2プロトン還元反応を起こす。安価な炭素電極を用い、キノン/ヒドロキノンと Br2/Br− レドックス対を組み合わせた水系フロー電池は、6000 W/(m2) を超えるピーク電流出力密度を 13000 A/(m2) において達成している。サイクル特性は毎サイクル >99% の容量を保持する。体積エネルギー密度は 20 Wh/l を超える[30]。アントラキノン-2-スルホン酸とアントラキノン-2,6-ジスルホン酸を負極、1,2-ジヒドロベンゾキノン- 3,5-ジスルホン酸を正極に使えば、有害な Br2 の使用を避けられる。この電池は劣化なしに 1,000 サイクル保つとされるが、公式なデータは公開されていない[31]。この全有機システムは頑健性があるだろうと見込まれているものの、セル電圧がおよそ 0.55 V と低く、エネルギー密度も <4 Wh/L と低い。
臭化水素酸の代りに、ずっと毒性の低いアルカリ溶液 (1M KOH) とフェロシアン化物を使う系もある[32]。pH が高いので腐食性が低く、安価なポリマータンクを使うことができる。膜中の電気抵抗の増加は電圧の上昇により保証される。セル電圧は 1.2 V である[33][34]。セル効率は 99% を超え、ラウンドトリップ効率は 84% と計測されている。この電池は最低でも 1,000 サイクルの寿命を持つと予想されている。理論エネルギー密度は 19 Wh/L である[35]。フェロシアン化物の高 pH KOH溶液中において Fe(OH)2 や Fe(OH)3 を生じずに化学的に安定かどうかはスケールアップ前に検証する必要がある。
メチルビオロゲン(MV)をアノード液として、4-ヒドロキシ-2,2,6,6-テトラメチルピペリジン-1-オキシル(TEMPO)をカソード液として用い、塩化ナトリウムと低コスト陰イオン交換膜を使って充放電を可能とした有機AORFBも実証されている。このMV/TEMPOシステムの最高セル電圧は 1.25 V で、報告されているAORFBの中で最低かもしれないコスト ($180/kWh) を達成している。水系電解液は既存の設備を変更することなく使えるドロップインリプレースメント(交換液)として設計されている。600ミリワット級の試作電池は安定で、100サイクル後も 20–100 mA/cm2 の範囲でほぼ100パーセントの効率を達成し、最高性能を達成できる 40–50 mA/cm2 では初期電圧の70%を保持する[36][37]。 この研究の重要な点は、中性のAORFBは酸性またはアルカリ性AORFBよりも環境にやさしく、かつ腐食性の酸性またはアルカリ性のRFBに匹敵する電気化学的性能を発揮しているという点である。MV/TEMPO AORFB のエネルギー密度 8.4 Wh/L であり、制限要因はTEMPO側にある。次のステップは、MV(水への溶解度およそ3.5M, 93.8 Ah/L)に匹敵するエネルギー密度を持つカソード液の特定である。
酸化還元活性を持つ有機ポリマーに基いたフロー電池設計のひとつとして、部分構造としてメチルビオロゲンを持った化合物と、TEMPOに加えて半透膜を用いるものがある。ポリマーベースのレドックスフロー電池 (pRFB) では、官能基を導入した(アクリルガラスや発泡スチロールに似た)高分子が水に溶かしてカソード側だけでなくアノード側活性物質としても用いられる。そのため、バナジウムと硫酸などの金属および腐食性の高い電解質を避けることができ、単純な半透膜を利用することができる。この形のフロー電池においてカソードとアノードを分けている膜は濾過器のように大きな「スパゲッティ状」高分子を通さず、低分子対イオンを通すだけでよく[38]、従来型で用いられていたイオン交換膜に比べて製造が簡単でコストも低く抑えられる。この設計により従来のNafiron膜の高いコストを解決できる可能性があるものの、酸化還元活性をもちつつ水への溶解度の高いポリマーを設計、合成するという問題は簡単ではない。
金属水素化物[編集]
プロトンフロー電池 (PFB) は金属水素化物貯蔵電極と可逆的プロトン交換膜 (PEM) 燃料電池を統合したものである。充電中、PFB は水分解によって発生した水素イオンと燃料電池の片方の電極中の金属粒子中の電子と結合させる。エネルギーは固体金属水素化物の形で貯蔵される。放電の際は、逆の過程が起こって電気が流れるのに伴い、プロトンが雰囲気中の酸素と反応して水が生じる。リチウムよりも安価な金属を利用することができ、かつリチウム電池よりも高いエネルギー密度を達成することができる[39][40]。
ナノネットワーク[編集]
ナノ粒子のネットワークを構築したリチウム–硫黄システムでは、導電体板と直接接触している粒子から電荷が出たり入ったりする必要がなくなり、液体全体にわたってナノ粒子ネットワークを通じて電気が流れることができる。これにより、より多くのエネルギーを取り出すことができる[41]。
半固体[編集]
半固体フロー電池は、正極と負極はキャリア液体中に懸濁した粒子により構成される。正極および負極懸濁粒子は別々のタンクに貯蔵され、別々のパイプを通って互いに隣接し、薄い多孔質膜で隔てられた反応室スタックへとポンプにより流通させられる。半固体フロー電池は、液体電解質に懸濁した電極材料を使用する水系フロー電池の基本構造と、リチウムイオン電池の化学構成を組み合わせ、カーボンフリー懸濁粒子と導電性カーボンネットワークスラリーを両方使ったものである[42][43][44]。 カーボンフリー半固体レドックスフロー電池は、固体分散レドックスフロー電池とも呼ばれる[45]。物質を溶解させることにより、その化学的振る舞いは大きく変わる。しかし、微小な固体物質を懸濁しても固体の特性は保たれる。結果として、糖蜜のような流動特性をもつ粘性懸濁液が得られる[46]。
化学構成[編集]
多様な化学構成のフロー電池が試みられてきている[2]。
| レドックス対 | 最大セル電圧 (V) | 平均電極出力密度 (W/m2) | 平均流体エネルギー密度 | サイクル数 |
|---|---|---|---|---|
| 水素–臭素酸リチウム | 1.1 | 15000 | 750 Wh/kg | |
| 水素–塩素酸リチウム | 1.4 | 10000 | 14000 Wh/kg | |
| 臭素-水素 | 1.07 | 7950 | ||
| 鉄–スズ | 0.62 | <200 | ||
| 鉄–チタン | 0.43 | <200 | ||
| 鉄–クロム | 1.07 | <200 | ||
| 有機(2013) | 0.8 | 13000 | 21.4 Wh/L | 10 |
| 有機 (2015) | 1.2 | 7.1 Wh/L | 100 | |
| MV-TEMPO | 1.25 | 8.4 Wh/L | 100 | |
| バナジウム–バナジウム(硫酸塩) | 1.4 | ~800 | 25 Wh/L | |
| バナジウム–バナジウム(臭素化物) | 50 Wh/L | 2000[2] | ||
| ナトリウム–多硫化臭素 | 1.54 | ~800 | ||
| 亜鉛–臭素 | 1.85 | ~1000 | 75 Wh/kg | |
| 鉛–酸(メタンスルホン酸) | 1.82 | ~1000 | ||
| 亜鉛–セリウム(メタンスルホン酸) | 2.43 | <1200–2500 |
長所と短所[編集]
レドックスフロー電池と、それには劣るもののハイブリッドフロー電池は出力要素とエネルギー要素が別々なことに起因するレイアウトの柔軟性と、固相–固相相転移がないことに起因する長いサイクル寿命、高い応答性、「イコライザ」(各セルを同じ電荷だけ充電し、特定のセルの過充電を防ぐ機器)が不要、有害物質を放出しないといった利点を持つ。いくつかの種類では(電圧依存性を通じた)充電状態の判断ができ、メンテナンスの必要性が低く、過充電・過放電への許容性がある。リチウムイオン電池などの固体二次電池に比べて、RFBと特にARFBは高い電流密度と出力密度での動作が可能である。これらの技術的利点から、レドックスフロー電池は大規模エネルギー貯蔵に適した選択肢といえる。
負の面としては、リチウムイオン電池などの携帯型電池に比べてエネルギー密度が、ものによって大きく違いはするものの、一般的に低いという点が挙げられる。
また、電池内部を流している電解液が液漏れを起こさないようにする必要がある、温度管理が必要である、電解液を循環させるポンプの管理が必要である、などなど管理に手がかかる部分も持っている[47]。
用途[編集]
フロー電池は通常、比較的大規模な (1 kWh – 10 MWh) 固定用途向けに考えられている。次のような用途が挙げられる。
- 負荷平準化 – 送電系統に電池を接続し、オフピーク時の余剰電力により充電し、ピーク時に放電し電力を供給する。この用途に向けた共通の問題は、ほとんどの化学構成のフロー電池は面積比出力(動作電流密度)が低く、出力単位のコストが高いことが挙げられる。
- 風力発電や太陽発電などの再生可能エネルギー源により充電し、ピーク需要時に放電する[48]。
- ピークカット – ピーク需要を電池により供給する[49]。
- UPS – 主電源が停止した際に途切れなく電力供給するために電池を使う。
- 電力変換 – すべてのセルは同じ電解質を共有する。そのため、一定の数のセルで充電した電解質を別の数のセルで放電に使うことができる。電池の電圧はセルの数に比例するので、これにより非常に強力なDC–DC変換回路を構成することができる。さらに、入力側および出力側のセル数を絶えず変化させることにより AC/DC, AC/AC, DC–AC 電力変換回路として動作させることができる。その動作周波数はスイッチング機構により制限される[50]。
- 電気自動車 – フロー電池は電解液を交換することに迅速に「充電」することができるので、内燃機関と同程度の速さでエネルギー補給をする必要がある自動車に使用できる可能性がある[51][52]。共通の問題として、電気自動車用途に用いられるほとんどのRFB化学構成ではエネルギー密度が低く、走行距離が短くなる。溶解度の高いハロゲン酸ベースのものは特筆すべき例外である[53]。
- スタンドアローン電力システム – 例えば、送電網に接続されていない携帯電話基地局が挙げられる。発電機に、太陽光発電や風力発電などの電力源を変動する出力水準をこの電池で平準化しつつ組み合わせることにより効率的に燃料消費を抑えることができる[54][55]。フロー電池は現状、カリブ地域におけるマイクロ太陽光発電網に利用されている[要出典]。
関連項目[編集]
出典[編集]
- ^ Qi, Zhaoxiang; Koenig, Gary M. (2017-05-12). “Review Article: Flow battery systems with solid electroactive materials”. Journal of Vacuum Science & Technology B, Nanotechnology and Microelectronics: Materials, Processing, Measurement, and Phenomena 35 (4): 040801. doi:10.1116/1.4983210. ISSN 2166-2746.
- ^ a b c Badwal, Sukhvinder P. S.; Giddey, Sarbjit S.; Munnings, Christopher; Bhatt, Anand I.; Hollenkamp, Anthony F. (24 September 2014). “Emerging electrochemical energy conversion and storage technologies”. Frontiers in Chemistry 2. doi:10.3389/fchem.2014.00079. PMC 4174133. PMID 25309898.
- ^ Alotto, P.; Guarnieri, M.; Moro, F. (2014). “Redox Flow Batteries for the storage of renewable energy: a review”. Renewable & Sustainable Energy Reviews 29: 325–335. doi:10.1016/j.rser.2013.08.001.
- ^ Science-Dictionary.org. "Electroactive Substance" 14 May 2013.
- ^ T. Fujii, T. Hirose, and N. Kondou, in JP patent 55096569 (1979), to Meidensha Electric Mfg. Co. Ltd.
- ^ Arenas, L.F.; Ponce de León, C.; Walsh, F.C. (June 2017). “Engineering aspects of the design, construction and performance of modular redox flow batteries for energy storage”. Journal of Energy Storage 11: 119–153. doi:10.1016/j.est.2017.02.007.
- ^ Noack, J.; Roznyatovskaya, N.; Herr, T.; Fischer, P. (2015). “The Chemistry of Redox-Flow Batteries.”. Angew. Chem. Int. Ed. 54: 9776–9809. doi:10.1002/anie.201410823.
- ^ Linden, D.; Reddy, T.B. (2002). Handbook of Batteries (Eds.). McGraw-Hill.
- ^ Shiokawa, Y.; Yamana, H.; Moriyama, H. (2000). “An Application of Actinide Elements for a Redox Flow Battery”. Journal of Nuclear Science and Technology 37 (3): 253–256. doi:10.1080/18811248.2000.9714891.
- ^ W. Borchers, in US patent 567959 (1894)
- ^ W. Nernst, in DE patent 264026 (1912)
- ^ R. M. Keefer, in US patent 3682704 (1970), to Electrocell Ltd.
- ^ Kummer, J. T.; Oei, D. -G. (1985). “A chemically regenerative redox fuel cell. II”. Journal of Applied Electrochemistry 15 (4): 619–629. doi:10.1007/BF01059304.
- ^ Borghino, Dario (2015年2月27日). “High-performance flow battery could rival lithium-ions for EVs and grid storage”. Gizmag
- ^ High-performance flow battery could rival lithium-ions for EVs and grid storage
- ^ New flow battery to keep big cities lit, green & safe
- ^ White, Frances (2015年2月25日). “New flow battery to keep big cities lit, green and safe”. R&D
- ^ Cyclic Performance Analysis of Hydrogen/Bromine Flow Batteries for Grid-Scale Energy Storage. doi:10.1002/cplu.201402043/suppinfo.
- ^ “Hydrogen-halogen electrochemical cells: A review of applications and technologies”. Russian Journal of Electrochemistry 50: 301–316. doi:10.1134/S1023193513120069.
- ^ “Energy cycle based on a high specific energy aqueous flow battery and its potential use for fully electric vehicles and for direct solar-to-chemical energy conversion”. Journal of Solid State Electrochemistry 19: 2711–2722. doi:10.1007/s10008-015-2805-z.
- ^ “Chemists present an innovative redox-flow battery based on organic polymers and water”. phys.org. Phys.org (2015年10月21日). 2015年12月6日閲覧。
- ^ Janoschka, Tobias; Martin, Norbert; Martin, Udo; Friebe, Christian; Morgenstern, Sabine; Hiller, Hannes; Hager, Martin D.; Schubert, Ulrich S.. “An aqueous, polymer-based redox-flow battery using non-corrosive, safe, and low-cost materials”. Nature 527 (7576): 78–81. doi:10.1038/nature15746. PMID 26503039.
- ^ Bartolozzi, M. (1989). “Development of redox flow batteries. A historical bibliography”. Journal of Power Sources 27 (3): 219–234. doi:10.1016/0378-7753(89)80037-0.
- ^ Leung, P. K.; Ponce-De-León, C.; Low, C. T. J.; Shah, A. A.; Walsh, F. C. (2011). “Characterization of a zinc–cerium flow battery”. Journal of Power Sources 196 (11): 5174–5185. doi:10.1016/j.jpowsour.2011.01.095.
- ^ “New rechargeable flow battery enables cheaper, large-scale energy storage”. KurzweilAI. doi:10.1038/ncomms3346. 2013年8月20日閲覧。
- ^ a b c Braff, W. A.; Bazant, M. Z.; Buie, C. R. (2013). “Membrane-less hydrogen bromine flow battery”. Nature Communications 4: 2346. doi:10.1038/ncomms3346. PMID 23949161.
- ^ Xu, Y.; Wen, Y.; Cheng, J.; Yanga, Y.; Xie, Z.; Cao, G. In World Non-Grid-Connected Wind Power and Energy Conference, 2009.
- ^ Xu, Yan; Wen, Yue-Hua; Cheng, Jie; Cao, Gao-Ping; Yang, Yu-Sheng (2010). “A study of tiron in aqueous solutions for redox flow battery application”. Electrochimica Acta 55 (3): 715–720. doi:10.1016/j.electacta.2009.09.031. ISSN 0013-4686.
- ^ WALD, MATTHEW L. (2014年1月8日). “From Harvard, a Cheaper Storage Battery”. New York Times 2014年1月10日閲覧。
- ^ "Harvard team demonstrates new metal-free organic–inorganic aqueous flow battery; potential breakthrough for low-cost grid-scale storage". 11 January 2014.
{{cite web}}: Cite webテンプレートでは|access-date=引数が必須です。 (説明) - ^ Szondy, David (29 June 2014). "New water-based organic battery is cheap, rechargeable and eco-friendly". Gizmag.
{{cite web}}: Cite webテンプレートでは|access-date=引数が必須です。 (説明) - ^ "A rechargeable battery to power a home from rooftop solar panels".
{{cite web}}: Cite webテンプレートでは|access-date=引数が必須です。 (説明) - ^ Matthew Gunther,ChemistryWorld. "Flow Battery Could Smooth Irregular Wind and Solar Energy Supply". Scientific American.
{{cite web}}: Cite webテンプレートでは|access-date=引数が必須です。 (説明) - ^ Alkaline quinone flow battery Lin et al.
- ^ Borghino, Dario (2015年9月30日). “Greener, safer flow battery could store renewable energy on the cheap”. www.gizmag.com. 2015年12月8日閲覧。
- ^ Moss, Richard (2015年12月22日). “New flow battery projected to cost 60% less than existing standard”. www.gizmag.com. 2015年12月23日閲覧。
- ^ Liu, Tianbiao; Wei, Xiaoliang; Nie, Zimin; Sprenkle, Vincent; Wang, Wei (1 November 2015). “A Total Organic Aqueous Redox Flow Battery Employing a Low Cost and Sustainable Methyl Viologen Anolyte and 4-HO-TEMPO Catholyte” (英語). Advanced Energy Materials 6: 1501449. doi:10.1002/aenm.201501449. ISSN 1614-6840.
- ^ Tobias Janoschka, Norbert Martin, Udo Martin, Christian Friebe, Sabine Morgenstern, Hannes Hiller, Martin D. Hager, Ulrich S. Schubert (2015).
- ^ “Proton flow battery simplifies hydrogen power”. Gizmag.com. 2014年2月13日閲覧。
- ^ Andrews, J.; Seif Mohammadi, S. (2014). “Towards a 'proton flow battery': Investigation of a reversible PEM fuel cell with integrated metal-hydride hydrogen storage”. International Journal of Hydrogen Energy 39 (4): 1740–1751. doi:10.1016/j.ijhydene.2013.11.010.
- ^ Kevin Bullis (2014年4月24日). “Nanoparticle Networks Promise Cheaper Batteries for Storing Renewable Energy”. MIT Technology Review. 2014年9月24日閲覧。
- ^ Qi, Zhaoxiang (2017-05-12). “Review Article: Flow battery systems with solid electroactive materials”. Journal of Vacuum Science & Technology B, Nanotechnology and Microelectronics: Materials, Processing, Measurement, and Phenomena 35 (4): 040801. doi:10.1116/1.4983210. ISSN 2166-2746.
- ^ Duduta, Mihai (May 2011). “Semi-Solid Lithium Rechargeable Flow Battery”. Advanced Energy Materials 1: 511-516.
- ^ Qi, Zhaoxiang (2016-08-15). “A carbon-free lithium-ion solid dispersion redox couple with low viscosity for redox flow batteries”. Journal of Power Sources 323: 97–106. doi:10.1016/j.jpowsour.2016.05.033.
- ^ Qi, Zhaoxiang (2017-02-20). “Carbon-free Solid Dispersion LiCoO2 Redox Couple Characterization and Electrochemical Evaluation for All Solid Dispersion Redox Flow Batteries”. Electrochimica Acta 228: 91–99. doi:10.1016/j.electacta.2017.01.061.
- ^ “Go with the Flow - Cambridge Crude”. (2011年8月23日)
- ^ 『Flow Battery System Design for Manufacturability』 p.19 - p.23
- ^ REDT Energy. "Storing Renewable Energy".
{{cite web}}: Cite webテンプレートでは|access-date=引数が必須です。 (説明) - ^ [1] Archived 9 February 2010 at the Wayback Machine.
- ^ P. M. Spaziante, K. Kampanatsanyakorn, and A. Zocchi, in WO patent 03043170 (2001), to Squirrel Holdings Ltd.
- ^ "Electric Vehicle Refuelling System (EVRS) used in conjunction with Vanadium Redox Flow Technology". REDT Energy Storage.
{{cite web}}: Cite webテンプレートでは|access-date=引数が必須です。 (説明) - ^ Antony Ingram. "nanoFLOWCELL-powered Quant e-Limo approved for german road trials". Fox News.
{{cite web}}: Cite webテンプレートでは|access-date=引数が必須です。 (説明) - ^ Tolmachev, Yuriy V.; Piatkivskyi, Andrii; Ryzhov, Victor V.; Konev, Dmitry V.; Vorotyntsev, Mikhail A. (2015). “Energy cycle based on a high specific energy aqueous flow battery and its potential use for fully electric vehicles and for direct solar-to-chemical energy conversion”. Journal of Solid State Electrochemistry 19 (9): 2711–2722. doi:10.1007/s10008-015-2805-z.
- ^ Talk by John Davis of Deeya energy about their flow battery's use in the telecomms industry - YouTube
- ^ Performance Testing of Zinc-Bromine Flow Batteries for Remote Telecom Sites