Hemijsko jedinjenje

 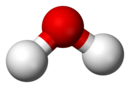 | |
| Na gornjoj slici: čista voda (H2O) u čaši, primjer je hemijskog spoja. Dolje: takozvani molekulski model "lopte i štapa" koji predstavlja da je sastavljena voda iz dva dijela vodonika (prikazan bijelo) i jednog dijela kiseonika (crveno) |
Hemijski spoj jeste čista hemijska supstanca koja se sastoji iz dva ili više različitih hemijskih elemenata[1][2][3], a koja se pomoću hemijskih reakcija može razdvojiti u jednostavnije supstance.[4] Svaki hemijski spoj ima jedinistvenu, definiranu hemijsku strukturu. Oni se sadrže od atoma u fiksnom omjeru[3] koji su povezani jedan s drugim hemijskim vezama u definiranom prostornom rasporedu. Hemijski spojevi mogu biti molekularni spojevi koji su povezani zajedno kovalentnim vezama, soli koje su nastale vezanjem atoma ionskim vezama, međumetalni spojevi koji se drže na okupu metalnim vezama ili kompleksi koji su povezani koordiniranim kovalentnim vezama. Razlika između hemijskog spoja i smjese ogleda se u tome što se smjesa može rastaviti na svoje pojedinačne sastojke fizičkim metodama razdvajanja (separacije), poput filtriranja, sedimentacije, destilacije i drugih.
Čisti hemijski elementi se ne smatraju hemijskim spojevima, čak i kada su oni sastavljeni iz molekula koje sadrže samo jednu vrstu atoma jednog elementa (kao naprimjer molekule H2, S8, itd.),[5] a koje se nazivaju diatomne ili poliatomne molekule.
Postoje određeni izuzeci od gornje definicije, jer mnogi čvrsti hemijski materijali koji su uobičajeni na Zemlji (naprimjer mnogi silikatni minerali), nemaju jednostavne hemijske formule u kojima su različiti elementi spojeni hemijskim vezama jedan s drugim, ne stoje u tačnom i fiksnom omjeru. Takvi kristalni spojevi nazivaju se nestehiometrijski spojevi. Njihov sastav varira bilo zbog prisustva drugih elemenata koji su zarobljeni unutar njihove kristalne strukture bilo da nedostaje ili ima viška nekog od njihovih osnovnih elemenata. Takvi nestehiometrijski hemijski spojevi sačinjavaju najveći dio Zemljine kore i Zemljinog plašta.
Drugi spojevi, za koje se smatra da su hemijski identični, mogu imati različite količine težih ili lakših izotopa svojih sastavnih elemenata, a koji neznatno mijenjaju maseni omjer elemenata.
Ugrubo, danas naučnici razlikuju više od 80 miliona poznatih hemijskih spojeva, ionskih, tj. spojeva sličnih solima kao i kompleksa, metalnih kao i molekularnih spojeva. Također jedna od osnovnih podjela jeste podjela na neorganske i organske spojeve, pri čemu se kao organski, uz samo nekoliko izuzetaka, označavaju svi spojevi koji sadrže ugljik. U 2002. godini bilo je poznato oko 16 miliona organskih, tri miliona neorganskih spojeva i oko jedan milion polimera.[6]
U osnovama, a u zavisnosti od načina i vrste veze između atomima elemenata iz kojih je sastavljen određeni spoj, mogu se razlikovati četiri osnovne vrste hemijskih spojeva:
- molekularni spojevi (po pravilu spojevi od jednog nemetalnog elemente i jednog ili više drugih nemetala)
- ionski spojevi (po pravilu sastoje se iz jednog metala i jednog ili više nemetala)
- metalni spojevi (od metala)
- kompleksi (kompleksni spojevi, od kationa metala i iona ili drugih molekula)
Tačnija, preciznija kategorizacija spojeva i njihova sistematizacija u neku od ova četiri kategorije može se načiniti pomoću razlika u elektronegativnošću elemenata koji ulaze u sastav nekog spoja. Međutim, postoje i određeni prelazni oblici između četiri navedena idealna tipa spojeva.
Molekularni spojevi nastaju od dva ili više atoma nemetala. Oni su općenito izolatori, ne provode električnu struju, i uglavnom imaju relativno nisku tačku ključanja (osim spojeva sličnih dijamantu i vještačkim materijalima sa izuzetno velikim molekulama). Najmanji djelići molekularnih spojeva su neutralni spojevi atoma (molekule). Oni se mogu sastojati iz dva atoma (kao naprimjer ugljen-monoksid, CO), tri atoma (naprimjer ugljen-dioksid), a neki i do nekoliko hiljada ili desetina hiljada atoma (ogromne molekule, polimeri, naprimjer vještački materija polietilen ili molekula koja prenosi genetski materijal (DNK). Atomi u molekulama su povezani putem atomskih veza, tj. atomi koji su međusobno povezani zajednički koriste parove vanjskih elektrona.
Primjeri molekularnih spojeva, osim vode, su i gas metan, šećer, ugljik dioksid, polietilen itd.


Ionski spojevi (soli) sastoje se iz kationa i aniona. Oni su često poput soli:
- krti,
- formiraju kristale
- imaju relativno visoku tačku topljenja i ključanja, i
- provode električnu struju samo u smjesi ili otopini.
Ioni nastaju reakcijama atoma metala i nemetala, pri čemu atomi metala otpuštaju elektrone (oksidiraju), a te elektrone primaju atomi nemetala (reduciraju se). Tako nastali kationi metala i anioni nemetala se spajaju zbog elektrostatičke privlačnosti kristalnih iona. Prema vrsti nemetala koji učestvuju pri ionskim vezama razlikuju se sljedeći ionski spojevi: oksidi (kisik kao anion), sulfidi (sumpor), fluoridi (fluor), hloridi, bromidi, jodidi, nitridi (sa dušikom), karbidi (sa ugljikom), hidridi (sa vodikom) i drugi. Pored toga, u sastav aniona ulazi i kisik kao treći element, pa tako nastaju još i sulfati, hlorati, nitrati, karbonati itd.
Neki od primjera ionskih spojeva su željezo(III) oksid (slično hrđi), pirit (željezo-sulfid), natrij hlorid (kuhinjska so) i kalcij sulfat (gips).
Međumetalni spojevi (često u svakodnevnom govoru poznati i kao legure) nastaju iz dva ili više metala. Oni su:
- vrlo dobri provodnici električne struje,
- dobro se mogu oblikovati,
- imaju metalni sjaj,
- dobro provode toplotu i
- na sobnoj temperaturi su uglavnom u čvrstom stanju.

Spajanje različitih metala u legure može se vršiti u proizvoljnim omjerima, naročito kada se radi o miješanju dva ili više istopljena metala u smjesu. Kada se grade međumetalni spojevi, tada su elementi koje ih grade sadržani u njima samo u tačno određenim količinskim omjerima (međumetalnim fazama, stehiometrijskim sastavima, vidi također i članak stehiometrija)
Primjeri legura su bronza (od bakra i kalaja), mesing (bakar sa cinkom) i bakar-nikl (metal za izradu kovanica). Primjeri međumetalnih spojeva su spojevi između magnezija i germanija (formula: Mg2Ge), Al2Cu, magnezij silicid (Mg2Si), bronza Cu4Sn, te cementit Fe3C (od željeza i ugljika, pri čemu se ugljik ponaša kao metal) i WC (volfram karbid).

Spojevi višeg reda (kompleksi) nastaju putem reakcije građenja kompleksa, većinom iz kationa obojenih metala i molekula sa slobodnim elektronskim parovima (ligandima). Mnogi od kompleksa su izrazito obojeni raznim bojama.
Naprimjer, supstanca koja daje crvenu boju krvi, hemoglobin, sastoji se iz iona željeza(II) i molekula bjelančevina, te tamnoplavi kompleks bakar-tetramina sastavljen iz iona bakra(II) i amonijaka.
Molekularni spojevi, u kojima je sadržan ugljik spojen sa vodikom, označavaju se kao organski spojevi. Oni sačinjavaju daleko najveći dio svih poznatih hemijskih spojeva, a njihova raznovrsnost kreće se od najjednostavnijih poput gasa metana iz grupe alkana, odnosno općenito ugljikovodika, do vrlo složenih spojeva. Pored ugljikovog "skeleta" (lanca), u organskim spojevima često se nalaze i mnoge druge atomske grupe, koji u znatnoj mjeri utječu na osobine organskih spojeva.
Prema ugljikovom skeletu (lancu), organski spojevi se otprilike mogu podijeliti na:
- alifatske ugljikovodike (alifate, između ostalih aciklične ugljikovodike, zasićene alkane, nezasićene alkene i alkine, te ciklične ugljikovodike.
- aromatske ugljikovodike (aromate, koji se dalje dijele na jednostavne i kondenzirane aromate),
- heterociklične spojeve, kao i
- biohemijske spojeve (alkaloide, aminokiseline, ugljikohidrate, bjelančevine, steroide, terpene, vitamine itd.)
Prema funkcionalnim grupama, organski spojevi se mogu podijeliti na:
- spojeve kisika i hidroksi-spojeve (alkohole, aldehide, estre, etre, ketone, karboksilne kiseline itd.)
- spojeve dušika (amine, amide, nitro-spojeve, nitrile),
- spojeve sumpora (alkantiole, sulfide, disulfide, estre sumporne kiseline, sulfone, sulfokside, tionamide, tioestre, tio kiseline itd.)
- spojeve fosfora (fosfate, fosfine),
- organometalne spojeve.
Karakteristične osobine spojeva su:
- Hemijski elementi u spoju nalaze se u određenoj proporciji
Naprimjer jedan atom natrijuma i jedan atom hlora postaju jedna molekula natrijum-hlorida (osnovnog sastojka kuhinjske soli)
- Spojevi imaju konačan skup osobina
Elementi iz kojih se sastoji neki spoj, ne zadržavaju svoje prvobitne osobine.
Naprimjer, vodik (zapaljivi gas koji ne podržava sagorijevanje) + kisik (nezapaljivi gas koji podržava sagorijevanje) postaju voda (nezapaljivi spoj koji ne podržava sagorijevanje)
Valencija predstavlja broj atoma vodika koji se mogu spojiti (kombinirati) sa atomom nekog elementa da bi dali (proizveli) neki hemijski spoj.
Hemičari opisuju spojeve koristeći hemijske formule u raznim formatima.[10][11][12] Za spojeve koji postoje u vidu molekula, koriste se formule za molekularne jedinice. Za polimerne materijale, kao i minerale i mnoge metalne oksine, obično se navodi empirijske formula, npr. NaCl za kuhinjsku so.
Elementi u hemijskoj formuli obično su navedeni po određenom redu, nazvanom Hillov sistem. U tom sistemu, obično su prvo navedeni atomi ugljika (ako ih ima), zatim se navode atomi vodika (ako ih ima), te poslije njih svi ostali elementi po abecednom redu. Ako formula ne sadrži ugljik onda se svi elementi, uključujući i vodik, navode po abecednom redu. Međutim, od tog pravila postoji nekoliko važnih izuzetaka. Za ionske spojeve, pozitivni ion se gotovo uvijek navodi na prvom mjestu, dok se negativni ion navodi nakon njega. Za okside, atomi kisika se obično navode na kraju formule.
Općenito, organske kiseline slijede normalna pravila da se C i H atomi navode prvi u formuli. Naprimjer, formula za trifluoroacetatnu kiselinu obično se piše kao C2HF3O2. Međutim, više strukturnih podataka mogu otkriti opisne formule, kao što je naprimjer formula za istu kiselinu u obliku CF3CO2H. Na drugoj strani, hemijske formule za većinu neorganskih kiselina i baza su izuzeci od normalnih pravila. One se pišu u skladu sa pravilima za ionske spojeve (pozitivni prvi, negativni drugi), ali one također slijede pravila koja naglašavaju njihove Arrheniusove definicije. Tačnije, formula za većinu neorganskih kiselina počinje sa vodikom a formula za većinu baza završava sa hidoksid ionom (OH-).
Formule za neorganske spojeve često ne daju detaljnije strukturne podatke o njima, kao što to ilustrira uobičajena upotreba formule H2SO4 za molekulu (sumporne kiseline) koja ne sadrži H-S veze. Prezentacija koja bi dala mnogo više opisa i podataka bila bi O2S(OH)2, ali se gotovo nikad ne piše na ovaj način.
Spojevi se također, kao i hemijski elementi, mogu pojavljivati u nekoliko agregatnih stanja. Svi spojevi mogu postojati u čvrstom stanju, barem na dovoljno niskim temperaturama. Molekularni spojevi također mogu postojati i kao tekućine, gasovi, a u nekim izuzetnim slučajevima, i u vidu plazme. Svi spojevi se mogu razložiti (raspasti) ukoliko se izlože dovoljno visokoj temperaturi. Temperatura pri kojoj se dešava takva fragmentacija često se naziva temperatura raspadanja (termolize). Ta tačka često nije precizno određena i u velikoj mjeri zavisi od brzine zagrijavanja. Naprimjer, voda se u maloj mjeri razlaže na kisik i vodik pri zagrijavanju na preko 2000 °C. Neki smatraju da ugljen-dioksid ima najvišu tačku termalnog raspada od preko 3870 °C.
Hemijska jedinjenja se dele u klase: neorganska i organska.[13] Druga klasa u svojoj široj definiciji uključuje organometalna jedinjenja, kao što su organoboroni, silikoni, organofosforna jedinjenja i drugi.
Neke vrste složenih neorganskih jedinjenja:
- Oksidi (H2O, CaO, CO2, P2O5 (P4O10) i sl.)
- Hidroksidi
- neorganske kiseline (HCl, HCN, i drugi.)
- Nitridi (NH3, Si3N4, itd .)
- Soli (NaCl, KNO3, Fe2 (SO4)3, LiBr, i drugi).
- Hidrat (CuSO4 · 5H2O, i drugi.)
- Kompleksi (K3[Fe(CN)6],[15] i drugi)
Organska jedinjenja ili organske materije su klasa hemijskih jedinjenja, koja sadrže ugljenik (izuzev karbida, ugljene kiseline, karbonata, oksida ugljenika i cijanid)a.[16]
Neorgansko jedinjenje ili neorganski spoj je hemijsko jedinjenje koje nije organsko, i.e. ne sadrži ugljenik i (izuzev karbida, cijanida, ugljenikovih oksida i drugih jedinjenja ugljenika koja se tradicionalno nazivaju neorganskim). Neorganskih jedinjenja ne poseduju karakteristični ugljikov kostur.
Alifatični ugljovodonici se dele u tri grupe homolognih redova na osnovu njihovog stepena zasićenosti:[17]
- parafini ili alkani su ugljovodonici bez dvostruki ili trostrukih veza[18]
- olefini ili alkeni sadrže jednu ili više dvostrukih veza, npr. diolefini (dieni) ili poliolefini
- alkini sadrže jednu ili više trostruke veze.
Ostatak grupe se klasifikuje na osnovu funkcionalnih grupa. Takva jedinjenja mogu da imaju prav lanac, razgranat lanac ili da budu ciklična.
Ciklična jedinjenja mogu da budu zasićena i nezasićena. Najstabilniji prsteni sadrže pet ili šest atoma ugljenika, mada su veliki prsteni (makrociklična jedinjenja) i manji prsteni često sreću. Najmanja cikloalkanska familija je tročlani ciklopropan ((CH2)3). Zasićena ciklična jedinjenja (cikloalkani) sadrže samo jednostruke veze. Cikloalkeni i cikloalkini sadrže dvostruke i trostruke veze, respektivno.[19]
Aromatični ugljovodonici sadrže konjugovane dvostruke veze. Najvažniji primer je benzen. NJegovu strukturu je formulisao Kekule koji je prvi predložio princip delokalizacije ili rezonancije radi objašnjavanja strukture. Za „konvencionalna“ ciklična jedinjenja, aromatičnost je određena prisustvom 4n + 2 delokalizovana pi elektrona, gde je n ceo broj. Posebnu nestabilnost (antiaromatičnost) manifestuju jedinjenja sa 4n konjugovana pi elektrona.[20][21][22]
Za svaku poznatu supstancu, uključujući i sve hemijske spojeve, dodijeljen je jedinstveni CAS registarski broj, po kojima ih naučnici i istraživači mogu jednoznačno raspoznati.
- ↑ Brown, Theodore L.; LeMay H. Eugene; Bursten Bruce E. et.al (2009). Chemistry: The Central Science, AP Edition (11.izd. izd.). Upper Saddle River, NJ: Prentice Hall. str. str.5–6.[mrtav link] ISBN 0-13-236489-1
- ↑ Hill, John W.; Petrucci Ralph H.; McCreary Terry W. et.al. (2005). General Chemistry (4.izd. izd.). Upper Saddle River, NJ: Prentice Hall. str. str.6. ISBN 978-0-13-140283-6
- ↑ 3,0 3,1 Whitten, Kenneth W.; Davis Raymond E.; Peck M. Larry (2000). General Chemistry (6.izd. izd.). Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers. str. str. 15. ISBN 978-0-03-072373-5
- ↑ Wilbraham, Antony; Matta Michael; Staley Dennis; Waterman Edward (2002). Chemistry (1.izd. izd.). Upper Saddle River, NJ: Prentice Hall. str. str.36. ISBN 0-13-251210-6
- ↑ Halal, John (2008). „Chapter 8: General Chemistry”. Milady's Hair Structure and Chemistry Simplified (5.izd. izd.). Milady Publishing. str. str. 96–98. ISBN 1-4283-3558-7
- ↑ „chemische Verbindung“ im Universal-Lexikon. Arhivirano 2014-09-09 na Wayback Machine-u Pristupljeno 8. augusta 2012.
- ↑ Weed, Robert I.; Reed, Claude F. and Berg, George (1963). „Is hemoglobin an essential structural component of human erythrocyte membranes?”. J Clin Invest. 42 (4): 581–8. DOI:10.1172/JCI104747. PMC 289318. PMID 13999462.
- ↑ Perutz, M.F.; Rossmann, M.G.; Cullis, A.F.; Muirhead, H.; Will, G.; North, A.C.T. (1960). „Structure of H”. Nature 185 (4711): 416–422. DOI:10.1038/185416a0. PMID 18990801.
- ↑ Perutz MF (1960). „Structure of haemoglobin”. Brookhaven symposia in biology 13: 165–83. PMID 13734651.
- ↑ Nomenclature of Organic Chemistry (3rd izd.), London: Butterworths, 1971 [1958 (A: Hydrocarbons, and B: Fundamental Heterocyclic Systems), 1965 (C: Characteristic Groups)], ISBN 0-408-70144-7.
- ↑ Rigaudy, J.; Klesney, S. P., ur. (1979). Nomenclature of Organic Chemistry. IUPAC/Pergamon Press. ISBN 0-08022-3699.. IUPAC, A Guide to IUPAC Nomenclature of Organic Compounds (the Blue Book); Oxford: Blackwell Science (1993). ISBN 0-632-03488-2. Online edition: [1]. . IUPAC, Chemical Nomenclature and Structure Representation Division (27 October 2004). Nomenclature of Organic Chemistry (Provisional Recommendations). IUPAC..
- ↑ Compendium of Chemical Terminology, IMPACT Recommendations (2nd Ed.), Oxford:Blackwell Scientific Publications. (1997)
- ↑ Zumdahl, Steven S. Chemical Principles, Fifth Edition. New York: Houghton Mifflin, 2005. 943–946, 957. OCLC 77760970
- ↑ Лидин Р.А., Андреева Л. Л., Молочко В. А. (2006). Под ред. Р. А. Лидина. ur. Константы неорганических веществ: справочник. М.: Дрофа. str. 685. ISBN 5-7107-8085-5.
- ↑ Sharpe, A. G. (1976). The Chemistry of Cyano Complexes of the Transition Metals. London: Academic Press.
- ↑ Хомченко Г. П. Пособие по химии для поступающих в вузы. — 3-е изд. испр. и доп. — М.: ООО «Издательство Новая Волна», ЗАО «Издательский Дом ОНИКС», 2000. с. 334. ISBN 5-7864-0103-0, ISBN 5-249-00264-1
- ↑ Međunarodna unija za čistu i primenjenu hemiju (1995). "Aliphatic compounds". Kompendijum Hemijske Terminologije Internet edition.
- ↑ Arora, A. (2006). Hydrocarbons (Alkanes, Alkenes And Alkynes). Discovery Publishing House Pvt. Limited. ISBN 9788183561426.
- ↑ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th izd.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ↑ Schleyer, Paul von Ragué (2001). „Introduction: Aromaticity”. Chemical Reviews 101 (5): 1115. DOI:10.1021/cr0103221. PMID 11749368.
- ↑ A. T. Balaban, P. v. R. Schleyer and H. S. Rzepa (2005). „Crocker, Not Armit and Robinson, Begat the Six Aromatic Electrons”. Chemical Reviews 105: 3436–3447. DOI:10.1021/cr0300946.
- ↑ Schleyer, Paul von Ragué (2005). „Introduction: DelocalizationPi and Sigma”. Chemical Reviews 105: 3433. DOI:10.1021/cr030095y.
- Robert Siegfried (2002). From elements to atoms: a history of chemical composition. American Philosophical Society. ISBN 978-0-87169-924-4
- Pauling, Linus (1970). General Chemistry. New York: Dover Publications, Inc.. ISBN 978-0-486-65622-9.
- Ebbin, Darrell, D. (1990). General Chemistry, 3rd Ed.. Boston: Houghton Mifflin Co.. ISBN 978-0-395-43302-7.
- Brown, T.L. (2003). Chemistry – the Central Science, 9th Ed.. New Jersey: Prentice Hall. ISBN 978-0-13-066997-1.
- Chang, Raymond (1998). Chemistry, 6th Ed.. New York: McGraw Hill. ISBN 978-0-07-115221-1.
- Zumdahl, Steven S. (1997). Chemistry, 4th ed.. Boston: Houghton Mifflin. ISBN 978-0-669-41794-4.
- Robert Siegfried (2002). From elements to atoms: a history of chemical composition. American Philosophical Society. ISBN 978-0-87169-924-4.
- Silberberg, Martin. Chemistry: The Molecular Nature Of Matter and Change. New York: McGraw-Hill Companies, 2004. ISBN 0-07-310169-9
- Под редакцией С. М. Локтева, ur. (1970). Высшие жирные спирты (области применения, методы производства, физико-химические свойства). М.: «Химия».
- Курц А. Л., Брусова Г. П., Демьянович В. М.. „Одно- и двухатомные спирты, простые эфиры и их сернистые аналоги”. Учебные материалы. Органическая химия. ChemNet. Химический факультет МГУ. Arhivirano iz originala na datum 2011-08-21. Pristupljeno 2010-07-10.
- Маркизова Н. Ф., Гребенюк А. Н., Башарин В. А., Бонитенко Е. Ю. (2004). Спирты. Токсикология для врачей. СПб.: «Фолиант». str. 112. ISBN 5-93929-089-2.
- Реутов О. А., Курц А. Л., Бутин К. П.. ISBN 978-5-94774-614-9.
- „Спирты”. Энциклопедия по охране и безопасности труда. Том IV. Раздел XVIII. Справочники. Обзор химических соединений. Институт промышленной безопасности, охраны труда и социального партнерства. Arhivirano iz originala na datum 2016-03-04. Pristupljeno 2010-12-27.
- Химия. Справочное руководство. Пер. с нем. Л., Химия 1975, сс. 240—242.
- Химическая Энциклопедия в 5 томах. ред. И. Л. Кнунянц. 5 том.
- Кнунянц И. Л. и др. (1988). „т.1 А-Дарзана”. Химическая энциклопедия. М.: Советская энциклопедия. str. 623.
- Сайкс П. Механизмы реакций в органической химии. М.: Химия. 1991
- Адамс М. Карбоновые кислоты в органике. М.: Химия. 1990
- Дж. Роберт, М.Касерио "Основы органической химии" т. 1 Издание 2-е, дополненное. 1978
- Кнунянц И. Л. и др. (1988). „т.1 А-Дарзана”. Химическая энциклопедия. Советская энциклопедия. str. 623.
- Carl Schorlemmer: Ursprung und Entwicklung der organischen Chemie, Akademische Verlagsgesellschaft Geest & Portig, Leipzig, 1984.
- H. Hart, L.E. Craine, D. J. Hart, C. M. Hadad, N. Kindler: Organische Chemie. 3. izd. Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8.
- Kurt Peter C. Vollhardt i N.E. Schore: Organische Chemie. 4. izd, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8.
- Heinz A. Staab: Hundert Jahre organische Strukturchemie. Angewandte Chemie 70(2), str. 37–41 (1958), DOI:10.1002/ange.19580700202
- Joachim Buddrus: Grundlagen der Organischen Chemie, Walter de Gruyter, Berlin – New York, 3. izd. 2003, ISBN 978-3-11-014683-7.
- Hartmut Laatsch: Die Technik der organischen Trennungsanalyse, Georg Thieme Verlag Stuttgart/New York 1988, ISBN 3-13-722801-8.
- dtv-atlas Chemie (Hans Breuer): Band 2: Organische Chemie und Kunststoffe, 9. izd. 2006, Deutscher Taschenbuch Verlag, ISBN 3-423-03218-9.
- R. L. Shriner, R. C. Fuson, D. Y. Curtin, T. C. Morrill: The Systematic Identification of Organic Compounds – a laboratory manual 6. izd., John Wiley & Sons New York/Chichester/Brisbane/Toronto 1980, ISBN 0-471-78874-0.
